肉桂醛调节SDF-1/CXCR4轴对慢性阻塞性肺疾病大鼠气道炎症的影响
2023-11-03高小梅何佳颖朱圆圆张红霞
高小梅 何佳颖 朱圆圆 张红霞
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种慢性呼吸系统疾病,其症状为咳嗽、咳痰、喘息和不完全可逆的气流受限,后期会出现慢性肺心病等并发症。目前使用的抗生素和激素类药物只能暂时缓解症状,且可能会出现副作用[1-2]。因此,寻找新的策略和治疗药物非常重要。基质细胞衍生因子1(stromal cell-derived factor 1,SDF-1)是趋化细胞因子超家族的关键成员,在多种受损的组织中高表达[3]。SDF-1可以与其受体C-X-C趋化因子受体4型(C-X-C chemokine receptor type 4,CXCR4)结合参与炎症反应和组织修复等过程,已知SDF-1/CXCR4信号被抑制能够阻碍COPD的进展[4-5]。肉桂醛(cinnamaldehyde,CA)是肉桂的主要活性成分,具有抗菌、抗炎和抗氧化等生理活性[6]。研究称CA可以保护脂多糖(lipopolysaccharide,LPS)诱导的小鼠急性肺损伤,也可以缓解高脂肪饮食诱导的动脉粥样硬化[7-8]。但CA在COPD中的作用还未了解。因此,本研究旨在探讨CA对COPD大鼠肺损伤的保护作用及其中的具体机制。
资料与方法
一、材料
1 动物 SPF级Wistar大鼠,6周龄,(160±20)g,购自于辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2020-0002。实验前将所有大鼠置于温度26℃,湿度60%的环境中饲养。本研究经动物伦理委员会批准(K202211-09)。
2 主要试剂 肉桂醛(HPLC≥98%,四川省维克奇生物科技有限公司);氨茶碱片(安徽国正药业股份有限公司,国药准字H20067772);AMD3100(货号:HY-10046,美国MedChemExpress公司);苏木素-伊红(HE)染色液、刘氏染色液(货号:SY2022、YT8870,北京伊塔生物科技有限公司);白三烯B4(LTB4)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)ELISA检测试剂盒(货号:EK-R36908、EK-R36902、EK-R36877、EK-R38696,上海酶研生物科技有限公司);SDF-1、CXCR4兔单抗(货号:ab155090、ab124824,英国abcam公司);山羊抗兔二抗(货号:XY0650,上海信裕生物科技有限公司)。
二、方法
1 大鼠COPD模型的建立和分组处理 将所有大鼠随机分为对照组、模型组、氨茶碱组(阳性药物)、AMD3100组(CXCR4抑制剂)、CA低剂量组、CA高剂量组,每组10只。除对照组,其余组均参照文献[9]方法使用香烟烟熏和LPS注射组合建立COPD大鼠模型。在造模的第1 天和第14 天,麻醉大鼠并进行气管注射200 μg用生理盐水溶解的LPS,在第2~13 天和15~60天将大鼠置于透明的密闭容器中进行烟熏,9支香烟/次,2 h/次,2次/天。从第31 天开始,氨茶碱组灌胃54 mg/kg的阳性药物氨茶碱混悬液[10],AMD3100组灌胃1 mg/kg的CXCR4抑制剂AMD3100[11];CA低、高剂量组分别灌胃10 mg/kg、40 mg/kg的CA[7],对照组和模型组均灌胃等量的生理盐水,1次/天,持续30 天。
2 肺功能评估 给药结束后,用1%的戊巴比妥钠(40 mg/kg)麻醉大鼠,使其仰卧位置于密闭体描箱内,其呼吸借助一端与插管连接,另一端与体描箱外动物呼吸机的皮管连接,并使大鼠适应5 min。然后用动物肺功能检测仪检测大鼠功能残气量(FRC)、呼气峰流量(PEF)、第0.3秒用力呼气容积(FEV0.3)及第0.3秒用力呼气容积与用力肺活量的百分比(FEV0.3/FVC)。
3 样本采集 将大鼠麻醉后,打开胸腔,对大鼠的右支气管进行结扎,然后用1 mL生理盐水灌洗左肺支气管肺泡,重复3次,收集支气管肺泡灌洗液(BALF),并在4℃下1500 r/min离心10 min,分别收集沉淀和上清用于细胞计数和ELISA实验。然后将大鼠处死摘取大鼠右肺组织,用预冷的PBS冲洗干净,在每组中随机选取5个右肺组织置于4%多聚甲苯中固定,剩余右肺组织冻存于-80℃用于蛋白检测。
4 HE染色观察肺组织病理学变化 将方法3中固定过夜的右肺组织石蜡包埋并切片,然后用二甲苯脱蜡,梯度酒精脱苯,HE染液染色,蒸馏水冲洗后用梯度乙醇脱水,二甲苯透明,最后中性树脂封片。在光学显微镜下观察肺组织的病理形态。
5 BALF中的细胞计数 将方法3中收集的BALF的细胞沉淀用1 mL PBS重悬,用标准血细胞计数器计数BALF中的白细胞总数。通过细胞离心制备涂片,用刘氏染色液染色,并根据标准形态学标准,对中性粒细胞和淋巴细胞进行计数。
6 ELISA检测BALF中炎症因子LTB4、IL-6、IL-1β、TNF-α的水平 将方法3中保存的BALF上清液取出置于冰上溶解,然后分别根据ELISA试剂盒的操作步骤检测BALF中LTB4、IL-6、IL-1β、TNF-α的含量。
7 Western Blot检测肺组织SDF-1、CXCR4蛋白表达 将方法3中冻存的右肺组织取出,加蛋白裂解液置于玻璃匀浆器中,匀浆后离心收集上清,用BCA测定蛋白浓度。然后用10% SDS-PAGE凝胶电泳分离蛋白并转移至PVDF膜上。用5% BSA封闭液浸泡PVDF膜,4℃孵育过夜,随后加入一抗稀释液(SDF-1比例1 ∶10 000,CXCR4比例1 ∶1 000),室温孵育2 h后加入羊抗兔IgG二抗稀释液(1 ∶500)中,室温孵育2 h,最后用ECL显影。以GAPDH为内参蛋白,用凝胶成像仪和Image J软件观察并分析蛋白条带灰度值。
三、统计学分析
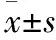
结 果
一、各组大鼠肺功能评估结果
与对照组相比,模型组大鼠FRC值升高,PEF、FEV0.3及FEV0.3/FVC值降低(P<0.05);与模型组相比,氨茶碱组、AMD3100组和CA低、高剂量组大鼠FRC值降低,PEF、FEV0.3及FEV0.3/FVC值升高(P<0.05),且CA高剂量组与氨茶碱组和AMD3100组均无显著差异(P>0.05)(见图1)。
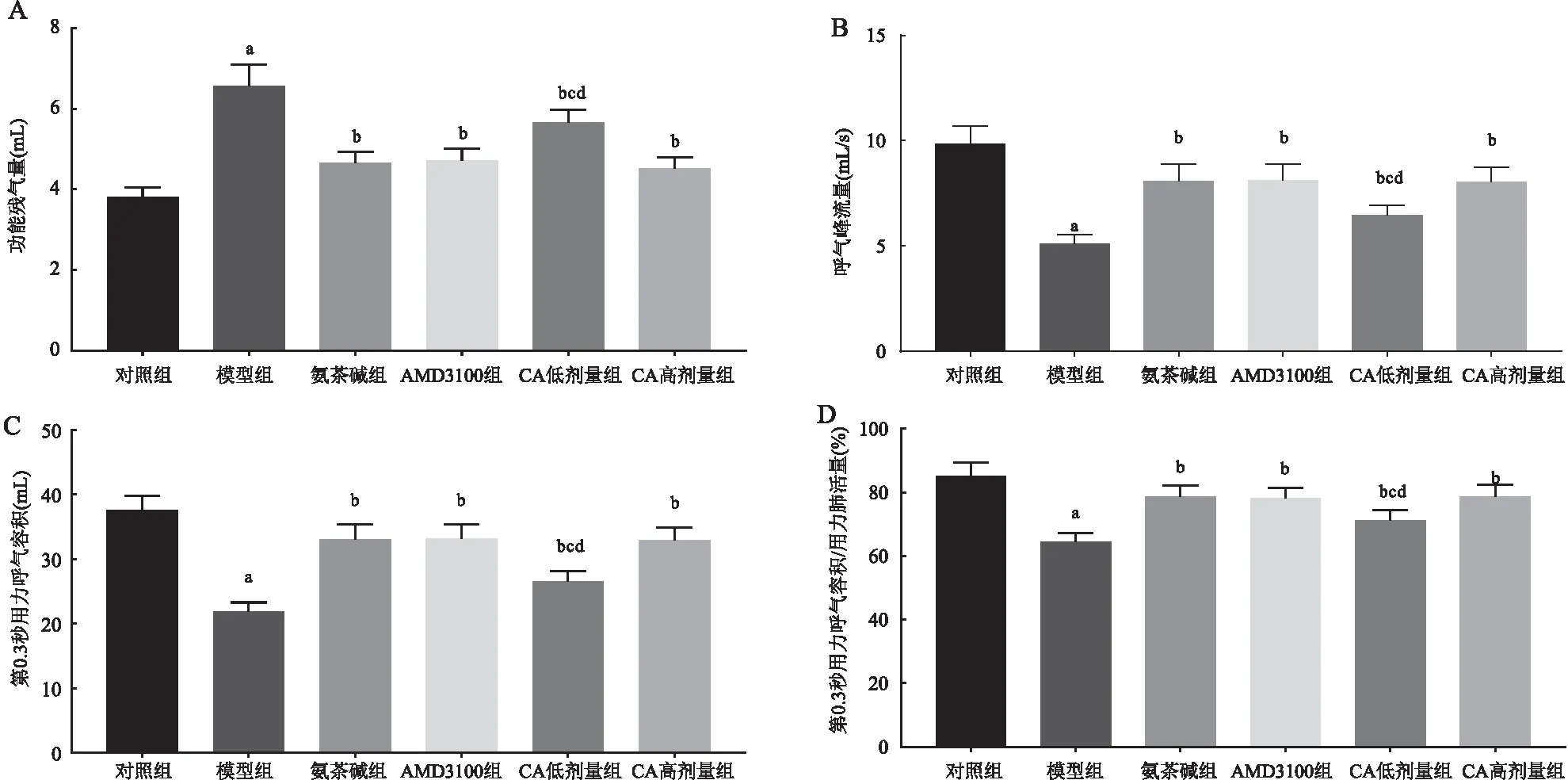
图1 各组大鼠肺功能评估 A:各组大鼠功能残气量;B:各组大鼠呼气峰流量;C:各组大鼠第0.3秒用力呼气容积;D:各组大鼠第0.3秒用力呼气容积与用力肺活量的百分比;与对照组相比,aP<0.05;与模型组相比,bP<0.05;与氨茶碱组相比,cP<0.05;与AMD3100组相比,dP<0.05
二、各组大鼠肺组织病理形态
与对照组相比,模型组大鼠肺泡间隔变窄并断裂,肺泡扩大成肺大疱,支气管道周围明显炎症细胞浸润;氨茶碱组、AMD3100组和CA低、高剂量组肺泡结构恢复,肺泡轻微扩张,炎症细胞浸润减少(见图2)。
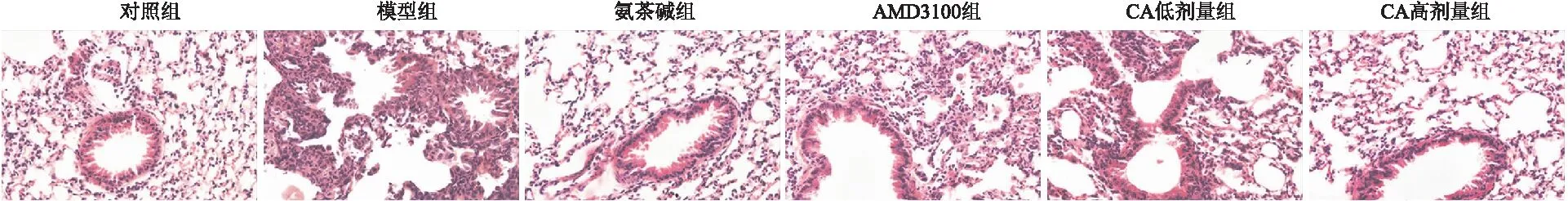
图2 HE染色检测各组大鼠肺组织的病理变化(×200)
三、各组大鼠BALF中白细胞总数、中性粒细胞和淋巴细胞数
与对照组相比,模型组大鼠BALF中白细胞总数、中性粒细胞和淋巴细胞数增加(P<0.05);与模型组相比,氨茶碱组、AMD3100组和CA低、高剂量组大鼠BALF中白细胞总数、中性粒细胞和淋巴细胞数降低(P<0.05),且CA高剂量组与氨茶碱组和AMD3100组均无显著差异(P>0.05)(见图3)。

图3 各组大鼠BALF中白细胞总数、中性粒细胞和淋巴细胞数
四、各组大鼠BALF中LTB4、IL-6、IL-1β、TNF-α的水平
与对照组相比,模型组大鼠BALF中LTB4、IL-6、IL-1β、TNF-α含量增加(P<0.05);与模型组相比,氨茶碱组、AMD3100组和CA低、高剂量组大鼠BALF中LTB4、IL-6、IL-1β、TNF-α含量降低(P<0.05),且CA高剂量组与氨茶碱组和AMD3100组均无显著差异(P>0.05)(见图4)。
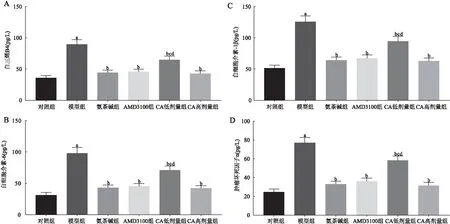
图4 各组大鼠BALF中LTB4、IL-6、IL-1β、TNF-α的水平
五、各组大鼠肺组织中SDF-1、CXCR4蛋白的表达
与对照组相比,模型组大鼠肺组织中SDF-1、CXCR4蛋白表达升高(P<0.05);与模型组相比,氨茶碱组、AMD3100组和CA低、高剂量组大鼠肺组织中SDF-1、CXCR4蛋白表达降低(P<0.05),且CA高剂量组与氨茶碱组和AMD3100组均无显著差异(P>0.05)(见图5,6)。

图5 各组大鼠肺组织中SDF-1、CXCR4蛋白表达条带
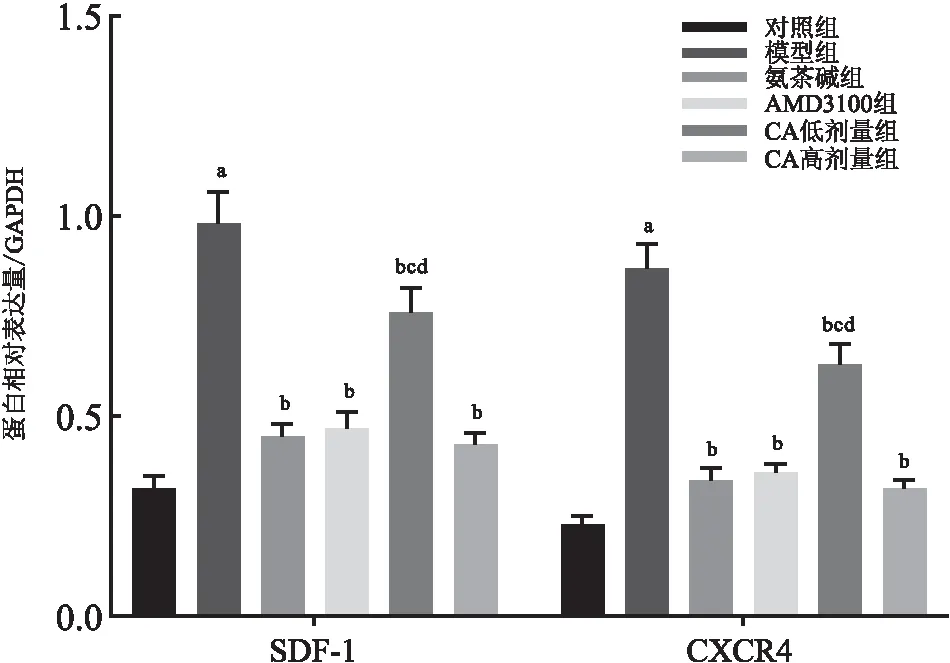
图6 各组大鼠肺组织中SDF-1、CXCR4蛋白相对表达量
讨 论
COPD是由各种原因引起的慢性异常肺部炎症反应,受遗传和环境因素影响,其特征是进行性加重和不完全可逆的气流阻塞,死亡率较高[12]。肺功能检查和肺组织病理改变是COPD的诊断标准,FRC、FEV1/FVC和PEF均反映气流阻塞情况,但由于大鼠呼吸频率较快,因此用FEV0.3/FVC来代表一秒的频率[13]。本研究通过烟熏和LPS注射联合建立大鼠模型,结果发现模型组大鼠FRC值增加,FEV0.3/FVC及PEF值降低,此外,HE染色也显示出大鼠肺泡间隔变窄并断裂,肺泡扩大成肺大疱,支气管道周围明显炎症细胞浸润,提示大鼠出现慢性阻塞性通气障碍,COPD模型建立成功。当阳性药物氨茶碱和CA不同剂量组干预后,大鼠FRC值降低,FEV0.3/FVC及PEF值升高,且肺组织中肺泡结构逐渐恢复,肺泡轻微扩张,炎症细胞浸润减少。这些结果揭示了CA可以减轻气道阻塞,有效改善肺功能病理性损伤。
已知有害气体和颗粒(如吸烟)引起肺部异常炎症反应是COPD的主要危险因素[14]。肺部炎症可使不同肺腔室中的白细胞、中性粒细胞、淋巴细胞等炎性细胞显著增加,并释放多种介质,如LTB4、IL-6、IL-1β、TNF-α等促炎细胞因子及其他炎症介质,进而导致肺结构损伤和炎症反应,因此促炎因子的水平可反映COPD的严重程度[15]。本研究结果显示,模型组大鼠BALF中白细胞、中性粒细胞和淋巴细胞数量以及LTB4、IL-6、IL-1β、TNF-α的含量较对照组升高;而氨茶碱组和CA不同剂量组大鼠BALF中白细胞、中性粒细胞和淋巴细胞数量及LTB4、IL-6、IL-1β、TNF-α的含量较模型组降低。由此表明了CA可以抑制COPD大鼠的炎症反应,减轻肺组织炎性损伤,进而阻止COPD的发展,其作用与阳性药物氨茶碱一致。
SDF-1,也称为CXCL12,是CXCR4的主要特异性配体,在患有炎症、缺血、缺氧和血管生成的生物体中显著上调,说明SDF-1可能是组织修复和再生所必需的[16]。而CXCR4在多种造血细胞、炎症细胞和非造血祖细胞中表达,其被发现与多种疾病有关。在动脉粥样硬化的发病机理中,CXCR4参与动脉壁的慢性炎症,其特征在于趋化因子介导的白细胞流入[17-18]。研究显示CXCR4/CXCL12信号通路可能在炎症部位的中性粒细胞滞留中发挥重要作用,用CXCR4抑制剂AMD3100阻断CXCR4/CXCL12信号通路后,抑制炎症部位的中性粒细胞浸润,减轻急性矽肺病小鼠肺部炎症和纤维化[19-20]。本研究结果显示,模型组中大鼠肺组织中SDF-1和CXCR4的蛋白表达较对照组升高,CA不同量组SDF-1和CXCR4的蛋白表达较模型组降低,同时AMD3100组中大鼠的肺功能评估、白细胞数量、促炎因子水平以及SDF-1、CXCR4蛋白表达均与高剂量CA组无显著差异。揭示了CA与AMD3100作用一致,均可以阻断SDF-1/CXCR4信号通路,抑制肺组织中炎性细胞分泌炎症介质,减轻炎症反应。由此本研究推测CA减轻COPD大鼠气道炎症的具体机制可能与SDF-1/CXCR4信号通路被阻断有关。
综上所述,CA可能通过抑制SDF-1/CXCR4轴来缓解COPD大鼠的气道炎症。本研究为治疗COPD提供了新的药物和策略。但COPD的核心特征炎症涉及的机制比较复杂,因此CA改善COPD肺组织损伤的具体机制还有待进一步深入研究。
