海上高温W 油田硫化氢微生物成因分析
2023-11-02张世仑王大威王秀军
张世仑,王大威,黄 波,靖 波,王秀军
1. 海洋油气高效开发全国重点实验室,北京 102209;2.中海油研究总院有限责任公司,北京 100028
硫酸盐还原菌(Sulfate-Reducing Bacteria,SRB)是一类利用硫酸根离子(SO42-)作为末端电子受体进行能量代谢并产生硫化氢(H2S)的厌氧微生物的统称。许多SRB 也具有利用单质硫、亚硫酸盐、硫代硫酸盐等作为电子受体产生H2S 的能力。SRB 广泛分布在海洋沉积物、稻田、深海热泉、地下管道等厌氧或缺氧的环境中[1]。
向油藏中大量注水以提高地层压力是油田开发的核心工艺技术之一。但是,随着注水开发的不断进行,注入水或驱油剂中含有的含硫化合物(SO42-)等物质大量进入油藏环境,这些物质能够促进SRB生长繁殖,进而释放大量H2S,导致石油开采、地面集输系统的生产设备及管道腐蚀与损坏[2]。此外,硫化物会污染环境、危害身体健康,给油田带来巨大的经济损失。调查研究显示,管道腐蚀每年给我国油田造成的直接经济损失接近百亿元,其中50%以上的经济损失是由SRB 引起的[3]。
开发解决微生物腐蚀与硫化物污染问题的新方法,是石油工业新技术研究的前沿和热点。南海W油田经过注水开发,已经有多个采出井出现了H2S浓度升高的现象。目前,我们对W 油田微生物多样性、SRB 代谢活性的认识有限,对微生物在该油田环境中的生长繁殖和次生H2S 问题进行研究具有重要价值。
1 材料与方法
1.1 材料
样品来源。海上高温W 油田A 区块(油藏温度:75~130 ℃)产出井A2、A3、A5 采出液和缓冲罐、过滤器、下岸口等地面管线流程节点。
试剂与实验设备。Veriti Fast PCR 仪(Applied Biosystems,美国)、SPINeasyTM水样基因组DNA 提取试剂盒(MP Biomedicals,美国)、PCR 反应混合物(大连宝生物工程有限公司,中国)、Illumina 测序平台(北京奥维森基因科技有限公司,中国)、硫酸盐还原菌测试瓶(北京华兴世纪仪器有限公司,中国)、离子色谱仪ICS-6000(Thermo Fisher,美国)。
1.2 方法
采集样品。取25 L 塑料桶,用95%酒精消毒3遍,开启取样阀,让油田水样流出10 min;将油水样品装满单桶,尽可能排尽空气,迅速将桶口密封,拧紧盖子,运抵实验室。
离子参数检测。将样品在14 000 r/min 的转速下离心5 min,取上清液过0.22 μm 硝酸纤维素滤膜,回收滤液,注入样品定量环,用淋洗液将样品溶液带入分析柱中,待测离子由于在柱子上的保留特性不同而分离开来,以保留时间进行定性,以峰高或峰面积进行定量,测定样品中的离子含量。
微生物菌体收集。对于水相部分,采用离心法(14 000 r/min,5 min)收集微生物菌体;对于油相部分,与异辛烷混合溶解后,将所得单一相进行离心(14 000 r/min,15 min)以获取沉淀;将上层液过0.22 μm 硝酸纤维素滤膜,收取菌体。
样品DNA 提取。将菌液置于离心管内,14 000 r/min 离心10 min;将沉淀用1 mL Lysis 缓冲液冲洗,再用0.6 mL Lysis 缓冲液重悬,加入适量玻璃珠研磨1 min,再加入终质量浓度为10 mg/mL 的溶菌酶,37 ℃反应1 h;最后加入120 μL 20%的SDS,65℃反应1 h;后续提取操作步骤参照DNA 提取试剂盒说明书进行。
微生物群落组成分析。采用正向引物(5’-GTGYCAGCMGCCGCGGTA-3’)、反向引物(5’-CCCCGYCAATTCMTTTRAGT-3’)对样品DNA 进行16S rRNA 扩增[4],反应体系(去离子水12 μL,2×PCR 反应混合物10 μL,正、反向引物各1 μL,DNA为1 μL),反应程序(预变性94 ℃,2 min;32 个循环:变性94 ℃,40 s;退火55 ℃,40 s;延伸72 ℃,1 min;终延伸72 ℃,15 min);PCR 产物送至北京奥维森基因科技有限公司,在“科”“属”水平上着重分析SRB 群落的组成多样性及其相对丰度情况。
SRB 数量测定。采用最大可能计数法(most probable number,MPN)测定样品中SRB 的数量,参照行业标准SY/T 0532—2012《油田注入水细菌分析方法绝迹稀释法》,每个待测样品设置10 个稀释梯度(100~10-9),每个稀释度设置3 个平行样。接种后的测试瓶置于培养箱中,75 ℃恒温培养30 d,然后根据测试瓶的变黑(产生H2S)情况,查询MPN 表以确定SRB 数量。
2 结果与分析
2.1 样品离子参数分析
获得W 油田产出井(A2、A3、A5)采出液和地面流程节点(缓冲罐、过滤器、下岸口)样品的离子参数信息,结果见表1。由表1 可知,产出井(A2、A3、A5)样品的SO42-平均质量浓度为204.8 mg/L,地面三处节点样品的SO42-平均质量浓度为202.0 mg/L,说明从产出端到地面管线流程中,SO42-维持在较高的浓度水平上,具备产生H2S 的物质基础。
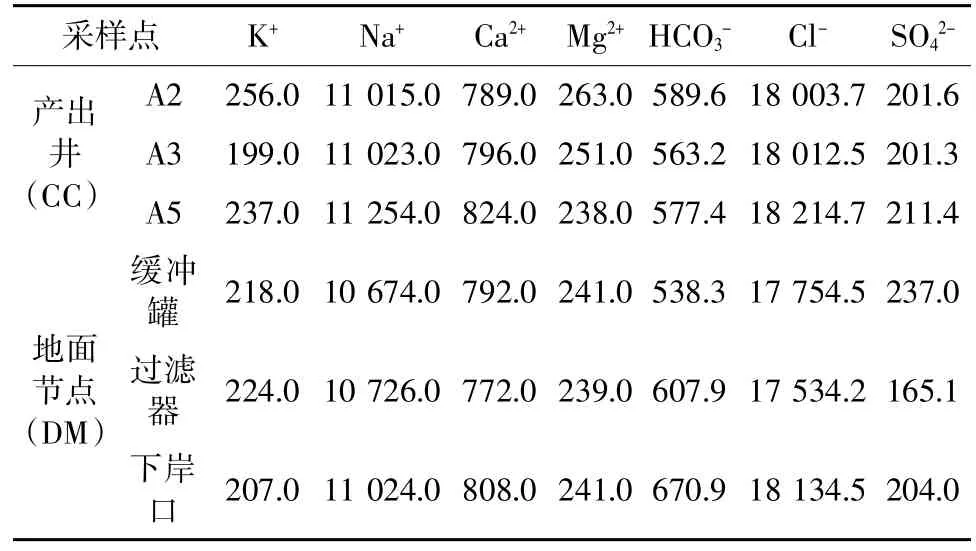
表1 样品离子参数 单位(mg/L)
2.2 SRB 数量测定
在采用MPN 法计数的第30 天,获得W 油田产出井(A2、A3、A5)采出液和地面流程节点(缓冲罐、过滤器、下岸口)样品中的SRB 数量,结果见表2。产出井采样点的SRB 数量为102~103个/mL,地面管线流程中的SRB 数量升高,达到104~106个/mL,呈现出空间差异性。

表2 样品SRB 数量测定 单位(个/mL)
2.3 SRB 群落组成分析
选择测序所得有效序列,与核糖体RNA 数据库进行比对,获得样品微生物的菌种注释信息。基于菌种注释信息和有效序列的丰度,对样品SRB 的多样性与相对丰度情况进行分析。如图1 所示,产出井(CC)中的SRB 共有12 种,在样品微生物总量中占比26.32%,其中Desulfonauticus 和Desulfovibrio 占比最高,分别为11.59%和11.46%。地面流程(DM)中的SRB 共有19 种,在样品微生物总量中占比54.57%,其中Desulfacinum 和Thermovirga 占比最高,分别为10.16%和15.20%。
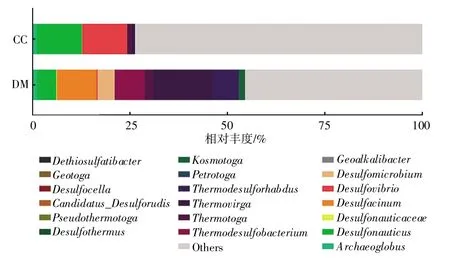
图1 SRB 丰度分布
图2 揭示了该高温油田中嗜热型SRB 的相对丰度,产出井(CC)样品中包含5 种嗜热型SRB,分别为Archaeoglobus、Thermodesulfobacterium、Thermotoga、Thermovirga 和Thermodesulforhabdus,在样品微生物总量中占比3.14%。与产出井相比,地面流程(DM)中新增了Desulfothermus 和Pseudothermotoga 两种嗜热SRB,共计7 种。这些嗜热SRB 在样品微生物总量中占比33.08%,其中Thermodesulfobacterium、Thermotoga、Thermovirga 及Thermodesulforhabdus 增幅显著,占比由0.08%、1.14%、0.82%、0.01%分别增加至7.72%、2.17%、15.20%、6.72%。
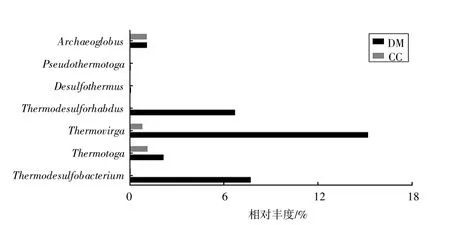
图2 耐温嗜热型SRB 丰度对比
如图3 所示,地面流程组(DM)样品的Chao1 指数、Observed species 值和PD whole tree 值均高于产出井(CC)样品,表明地面流程组样品的菌种丰富程度(菌种总数)高于产出井,而地面流程组样品的Shannon 指数值低于产出井,意味着产出井的微生物多样性更高,具有更大的发现新菌种的潜力。

图3 产出井与地面流程组样品微生物多样性对比
3 结论
W 油田采样位点处的SRB 数量较高,MPN 计数法结果显示,产出井采样点的SRB 数量为102~103个/mL,地面管线流程中的SRB 数量升高,达到104~106个/mL,呈现出空间差异性。高通量测序结果表明,W 油田水样中的SRB 群落组成存在差异,在各个采样位点中,均发现了高丰度的SRB,其为优势微生物类群,产出井样品中SRB 的相对丰度为26.32%,管线流程中SRB 的相对丰度上升至54.57%,且耐热菌种的占比增幅显著。
4 讨论
本研究运用高通量测序技术解析南海W 油田产出井和地面管线流程中的微生物多样性及SRB群落组成。研究结果为深入了解该高温油藏的微生物多样性提供了重要的数据支撑,也加深了人们对酸败的海上油田环境中SRB 群落组成及空间异质性的认识。
然而,不同油田储层的物理化学性质差异较大,导致采出水的水质、微生物群落组成差别也很大。同时,化学品的大量使用导致油气储层和开采系统的微生物群落结构发生改变,使得生物系统不稳定,难以预测。因此,有必要在更长的时间尺度上开展对该油田内源微生物多样性的动态变化监测。
油藏内130 ℃的高温并不能完全杀死SRB,这些微生物细胞可能会以芽孢休眠体的形式存在,在油藏内不具有产生H2S 的代谢活性[5]。但随着采出液的运移,井筒环境温度逐渐降低,SRB 恢复代谢活性并开始生长繁殖,逐渐成为优势微生物种群,且多数为耐温嗜热型菌种(图2)。图中,Thermotoga 是嗜热厌氧菌,能够还原单质硫、硫代硫酸盐[6];Thermodesulfobacterium,热脱硫杆菌,为嗜热菌,将单质硫、硫酸盐作为电子受体[7];Thermovirga 能够还原单质硫, 但无法还原硫代硫酸盐[8];Pseudothermotoga 以单质硫、硫代硫酸盐为电子受体[9]。另外,本研究还发现了除常见SRB 类群以外的其他产硫化氢微生物Deferribacteraceae 为嗜热菌,可利用单质硫作为电子受体[10]。上述这些硫/硫酸盐还原微生物对该高温油田次生硫化氢的贡献值得研究。
