罗汉果渣发酵料替代部分日粮对富凤麻鸡大肠微生物群落多样性的影响
2023-11-02滕少花肖正中周晓情吴柱月冯显钤周俊华黄丽王启芝王自豪
滕少花 肖正中 周晓情 吴柱月 冯显钤 周俊华 黄丽 王启芝 王自豪




DOI:10.3969/j.issn.2095-1191.2023.06.008
摘要:【目的】探索羅汉果渣发酵料替代部分日粮对富凤麻鸡大肠微生物群落多样性的影响,为罗汉果渣发酵料在鸡养殖生产中的应用提供参考依据。【方法】选定60日龄的富凤麻鸡(母鸡)20羽,随机分成4组,使用罗汉果渣发酵料分别替代3%、6%、9%日粮,以全日粮为对照(CK),进行为期97 d的饲养试验。饲喂结束后,采集鸡大肠内容物,基于Illumina高通量测序技术探究3种替代日粮比例对富凤麻鸡大肠微生物群落多样性的影响。【结果】不同比例替代日粮处理的富凤麻鸡大肠微生物群落的Chao1指数排序为CK>替代9%>替代3%>替代6%,Shannon指数排序为CK>替代9%>替代3%=替代6%,Simpson指数排序为CK=替代9%>替代3%=替代6%。经Wilcoxon检验,各试验组与CK的Chao1指数无显著差异(P>0.05,下同),表明罗汉果渣发酵料替代日粮处理对富凤麻鸡大肠细菌群落物种的丰富度均无影响。替代3%日粮的富凤麻鸡大肠微生物群落的Shannon指数显著低于CK(P<0.05,下同),其他试验组的Shannon指数与CK无显著差异;替代3%和6%日粮处理大肠微生物群落的Simpson指数显著低于CK,而替代9%日粮的Simpson指数与CK无显著差异。门分类水平上共注释出29个细菌门,其中拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是4组试验中的绝对优势菌门,拟杆菌门的相对丰度排序为替代9%>CK>替代3%>替代6%,厚壁菌门的相对丰度排序为替代6%>替代3%>CK>替代9%,变形菌门的相对丰度排序为替代3%>替代6%>CK>替代9%。其中,替代3%日粮处理的大肠微生物群落变形菌门相对丰度显著高于CK,替代9%日粮处理的变形菌门相对丰度显著低于CK,而替代6%日粮处理的变形菌门相对丰度与CK无显著差异。属分类水平上,变形菌属(Proteus)的相对丰度在4组试验中有显著差异,其相对丰度排序为替代6%>替代3%>CK>替代9%,其中,替代9%日粮处理的变形菌属相对丰度显著低于CK,而替代3%和6%日粮处理与CK无显著差异。【结论】基于物种丰富度、罗汉果渣的营养成分及变形菌门的丰度对富凤麻鸡大肠微生物群落影响的保守评估,罗汉果渣发酵料替代日粮的最佳替代比例为6%。
关键词:富凤麻鸡;罗汉果渣;肠道菌群;微生物多样性
中图分类号:S831.5 文献标志码:A 文章编号:2095-1191(2023)06-1667-09
Effects of fermented Siraitia grosvenorii residue replacing part of diet on large intestinal microbial community diversity of
Fufeng Ma chickens
TENG Shao-hua, XIAO Zheng-zhong*, ZHOU Xiao-qing, WU Zhu-yue, FENG Xian-qian, ZHOU Jun-hua, HUANG Li, WANG Qi-zhi, WANG Zi-hao
(Guangxi Vocational University of Agriculture,Nanning,Guangxi 530007,China)
Abstract:【Objective】The objective of this study was to explore the effects of fermented Siraitia grosvenorii residue replacing part of diet on large intestinal microbial community diversity of Fufeng Ma chickens, and to provide a reference basis for the application of fermented S. Grosvenorii residue in chicken breeding production. 【Method】Twenty 60-day-old Fufeng Ma chickens (hens) were selected and randomly divided into four groups. The diets of 3%, 6%, and 9% were replaced with fermented S. grosvenorii residue respectively. The whole diet (CK replacement) was used as the control group (CK) in a feeding trial for 97 d. After feeding, the contents of the chicken large intestine were collected, and the effects of three alternative dietary proportions on the diversity of the large intestine microbial community in Fufeng Ma chickens were explored based on Illumina high-throughput sequencing technology. 【Result】The Chao1 index of the large intestinal microbial community of Fufeng Ma chickens treated with different proportions of alternative diets was ranked as CK>replacing 9%>replacing 3%>replacing 6%, the Shannon index was ranked as CK>replacing 9%>replacing 3%=repla-cing 6%, and the Simpson index was ranked as CK=replacing 9%>replacing 3%=replacing 6%. Wilcoxon test showed that there was no significant difference in the Chao1 index between the test groups and CK (P>0.05, the same below), indicating that the treatment of fermented S. grosvenorii residue replacing diet had no effect on the species richness of large intestinal microbial community in Fufeng Ma chickens. The Shannon index of the large intestinal microbial community of Fufeng Ma chickens replacing 3% of the diet was significantly lower than CK (P<0.05, the same below), and there was no significant difference in the Shannon index between the other test groups and CK. The Simpson index of the large intestinal microbial community in the treatment of replacing 3% and 6% diets was significantly lower than CK, while the Simpson index of replacing 9% diets was not significantly different from CK. At the phylum level, a total of 29 bacterial phyla were annotated, among which Bacteroidetes, Firmicutes, and Proteobacteria were the absolute dominant phyla in the four groups of experiments. The relative abundance of Bacteroidetes was ranked as replacing 9%>CK>replacing 3%>replacing 6%, Firmicutes was ranked as replacing 6%>replacing 3%>CK>replacing 9%, and Proteobacteria was ranked as replacing 3%>replacing 6%>CK>replacing 9%. Among them, the relative abundance of Proteobacteria in the large intestinal microbial community was significantly higher than CK in the treatment of replacing 3% of the diet, while the relative abundance of Proteobacteria in the treatment of replacing 9% of the diet was significantly lower than CK. However, there was no significant difference in the relative abundance of Proteobacteria between the treatment of replacing 6% of the diet and CK. At the level of genus classification, there were significant differences in the relative abundance of Proteus genus among the four groups of experiments, with a relative abundance ranking of replacing 6%>replacing 3%>CK>replacing 9%. Among them, the abundance of Proteus genus in the treatment of replacing 9% diet was significantly lower than CK, while there was no significant difference between the treatment of replacing 3% and 6% diet and CK. 【Conclusion】Based on the conservative assessment of the effects of species richness, nutrient composition of S. grosvenorii residue and the abundance of Proteobacteria on the large intestinal microbial community in Fufeng Ma chickens, the optimal replacement proportion of fermented S. grosvenorii residue to diet is 6%.
Key words: Fufeng Ma chicken; Siraitia grosvenorii residue; intestinal microflora; microbial diversity
Foundation items: Guangxi Key Research and Development Project (Guike AB20297012); Guangxi Science and Technology Base and Talent Special Project (Guike AD21238004)
0 引言
【研究意义】由于罗汉果(Siraitia grosvenorii)提取物及其制剂具有很高临床治疗价值,众多研究者热衷于罗汉果甜苷成分和黄酮的功能研究。然而,罗汉果活性成分提取或加工成制剂、含片、饮料后的罗汉果渣却没有得到更充分的利用。根据《广西罗汉果优势特色产业集群建设方案(2020—2022年)》,2022年广西罗汉果产量达27.42万t,可利用罗汉果渣达21.94万t。罗汉果渣的主要营养成分包含8.94%粗蛋白质、89.54%干物质、22.48%粗纤维、0.99%粗脂肪、73.20%酸性洗涤纤维、88.35%中性洗涤纤维、1.30%粗灰分、0.22%磷及0.25%钙;其粗蛋白含量与象草相当,高于甘蔗尾叶和玉米秸秆,粗脂肪含量比甘蔗尾叶、玉米秸秆和象草低65%左右,中性洗涤纤维含量是甘蔗尾叶、玉米秸秆和象草的1.18倍以上,酸性洗涤纤维含量则是甘蔗尾叶、玉米秸秆和象草的1.6倍以上。可见,罗汉果渣非常适合作为非粮饲料资源予以开发(王启芝等,2018)。肠道微生物对畜禽的生产性能、健康和饲粮的消化吸收等均具有重要意义,日粮、基因型及养殖环境等也影响肠道微生物的群落结构和功能特性。因此,研究日粮成分组成、养殖环境和饲养方式等对畜禽肠道微生物的影响,对进一步调控肠道微生物及提高畜禽生产具有重要意义。【前人研究进展】日粮的成分组成对家禽肠道微生物的影响目前已有许多报道。采食不含纤维日粮的肠道微生物中含有比较低的产丁酸菌(Faecalibacterium prausnitzii属和Roseburia spp.);而来自产丁酸菌的丁酸盐有利于结肠黏膜屏障功能的完整性(Benus et al.,2010)。提高日粮中粗蛋白含量可能会增加产气荚膜梭菌的数量,而产气荚膜梭菌β毒素可导致动物和人致命的出血性肠炎(Delphine et al.,2013;张嵩等,2018)。富含n-3多不饱和脂肪酸的饮食可显著提高小鼠肠道内乳酸菌和双歧杆菌等益生菌的含量;n-3多不饱和脂肪酸可能通过影响肠道菌群间接影响基因的合成从而达到减肥的目的(乔立君等,2014)。高油脂低碳水化合物日粮相比于低油脂可显著提高断奶猪仔盲肠和结肠中大肠杆菌的数量,同时降低乳酸杆菌和双歧杆菌的数量;降低日粮中碳水化合物与植物性脂肪能值比对肠道微生物菌群及代谢物更有利(于文雅等,2015)。刘梦芸等(2016)报道,游离的中链脂肪酸因与禽畜胃肠道内的细菌病原体细胞膜具有相同的极性,可跨膜进入病原体细胞,其在细胞内的酸化及其降解形成的饱和脂肪酸(由6~12个碳原子构成)可阻断病原体的DNA复制,从而起到抑制病原菌及调节肠道微生态的作用。发酵底物更多及发酵时间更长可能是碳水化物中的可溶性纤维增加鸡肠道细菌的数量和多样性的主要原因;机械刺激肠道、增加排空速度、减少肠道发酵时间及降低病原菌黏附肠道是不溶性纤维降低或增加病原菌的原因;过量的不可溶性纤维可能会机械损伤肠道完整性及影响营养物质分配,导致病原菌增加(张嵩等,2018)。以上研究表明,日粮中的碳水化合物、蛋白质和脂肪均对家禽肠道微生物产生影响。【本研究切入点】至今,有关日粮中非粮饲料资源的添加对鸡肠道微生物群落结构特征及消化功能的影响已有较多报道(孙艳发等,2016;张倩雲,2021),而鲜见以罗汉果渣为营养来源替代部分日粮对鸡肠道微生物多样性影响的研究报道。【拟解决的关键问题】以富凤麻鸡的大肠内容物细菌菌落的DNA为研究对象,利用高通量测序技术(Next generation sequencing)对细菌菌落16S rRNA扩增子的V3~V4可变区进行测序,通过生物信息学方法分析菌落的物种组成及相对丰度差异,探索罗汉果渣发酵料替代部分日粮对鸡肠道微生物多样性的影响,同时评估罗汉果渣发酵料替代日粮的最佳比例,为罗汉果渣发酵料在鸡养殖生产中的应用提供参考依据。
1 材料与方法
1. 1 罗汉果渣发酵料制备
罗汉果渣购自桂林同盛生态养殖有限公司。将罗汉果渣进行粉碎后,添加由江西宜春強微生物科技有限公司生产的增香青贮微贮剂,充分混合后装罐压实,经35 d发酵后使用。
1. 2 试验设计
于广西畜牧研究所实验鸡场选定遗传背景相近、体况良好的自繁60日龄的富凤麻鸡(母鸡)20羽,随机分成4组,每组5羽。其中,3个试验组分别以罗汉果渣发酵料替代日粮的比例,依次为3%、6%和9%,全日粮试验组为对照(CK)。试验为期97 d,其中,预饲期7 d,正式期90 d。
1. 3 饲养管理
鸡采食日粮原料组成和营养水平见表1。试验鸡群自由饮水、自由采食,其他管理按鸡场正常生产管理进行。
1. 4 样品采集及DNA提取
将各组试验鸡静脉放血处死,5%新洁尔灭消毒液浸泡5 min全身消毒,无菌操作,剖开腹腔,玻璃棒刮取大肠肠壁内容物迅速放入经过灭菌的离心管内,液氮速冻,-80 ℃冰箱保存。采用CTAB(十六烷基三甲基溴化铵)法对各样本的鸡大肠内容物进行细菌菌群的DNA进行提取,并通过琼脂糖凝胶电泳检测DNA提取的质量,同时采用Qubit(Invitrogen,美国)对DNA进行定量。
1. 5 16S rDNA扩增子测序及多样性分析
根据细菌16S rRNA扩增V3和V4区设计相应引物,正向引物341F:5'-CCTACGGGNGGCWGCAG-3',反向引物805R:5'-GACTACHVGGGTATCTAA TCC-3',并在引物上添加测序通用接头和样本特异性Barcode序列,进而对该区域进行PCR扩增。扩增程序:98 ℃预变性30 s;98 ℃ 10 s;54 ℃ 30 s;72 ℃ 45 s,进行35个循环;72 ℃延伸10 min。PCR扩增产物通过2.0%琼脂糖凝膠电泳进行检测,并对目标片段进行回收,回收采用AMPure XT beads回收试剂盒。对纯化后的PCR产物使用Agilent 2100生物分析仪(Agilent,美国)和Illumina(Kapa Biosciences,Woburn,MA,美国)的文库定量试剂盒进行评估,合格的文库浓度在2 nmol/L以上。将合格的各上机测序文库(Index序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,经NaOH变性为单链进行上机测序。使用NovaSeq 6000测序仪进行2×250 bp的双端测序,相应试剂为NovaSeq 6000 SP Reagent Kit(500 cycles)。
通过对Reads拼接、过滤、操作分类单元(Operational taxonomic unit,OTU)聚类,并与SILVA(Release 132)和NT-16S数据库进行序列比对,获得分类学上物种注释。根据物种注释的结果,选取每组样本在门和属水平上相对丰度排名靠前的物种进行比较分析。计算OTUs的α多样性指数,比较样品间的差异并进行统计学检验。其中,多组间差异采用Kruskal Wallis秩和检验,两组间差异采用Wilcoxon秩和检验。测序与生物信息学分析委托杭州联川生物技术股份有限公司完成。
2 结果与分析
2. 1 富凤麻鸡大肠微生物群落OTU分析
对原始数据进行双端拼接、质量控制及嵌合体过滤后,从全日粮及替代3%、6%和9%日粮处理组的总DNA中获得的平均有效序列数目分别为71765、76980、75088和66750条。4个试验组总共获得长度为400~500 bp的序列为2478189条,占所有序列的99.86%。采用Vsearch算法按照97%的序列相似度将有效序列聚类成为同一OTU(Blaxter et al.,2005),全日粮及替代3%、6%和9%日粮试验组分别获得3686、3087、3228和3472个OTUs,特有的OTUs分别为2222、1612、1742和2121个,共有OTUs 609个(图1)。
由图2可知,替代0%、3%、6%和9%日粮试验组的OTUs稀释曲线均随测序数据量的增大而趋于平坦,表明样本的高通量测序数据量合理,测序数据量足够反映样品中物种的组成特征,继续增加测序通量只会产生少量的新OTUs。
2. 2 富凤麻鸡大肠微生物群落的α多样性分析
从表2可知,全日粮及替代3%、6%和9%日粮处理的Goods coverage指数均达100%,说明测序深度能全面反映样品的细菌多样性。Chao1指数表征群落物种丰富度,Shannon和Simpson指数反映群落结构多样性。不同比例替代日粮处理的富凤麻鸡大肠微生物群落的Chao1指数排序为CK>替代9%>替代3%>替代6%,Shannon指数的排序为CK>替代9%>替代3%=替代6%,Simpson指数的排序为CK=替代9%>替代3%=替代6%。各替代组与CK的Chao1指数无显著差异(P>0.05,下同);替代3%日粮处理的Shannon指数显著低于CK(P<0.05,下同),其他试验组的Shannon指数与CK均无显著差异;替代3%和6%日粮处理的Simpson指数显著低于CK,而替代9%日粮处理的Simpson指数与CK无显著差异。因此,罗汉果渣发酵料替代3%、6%和9%日粮对鸡大肠细菌菌落物种的丰富度无影响,替代3%和6%日粮均降低鸡大肠细菌菌落的多样性,替代日粮比例达9%不影响鸡大肠细菌菌落的多样性。
2. 3 罗汉果渣发酵料替代部分日粮对富凤麻鸡大肠细菌门分类水平的影响
如表3所示,富凤麻鸡大肠微生物群落的所有OTUs共注释出29个细菌门。其中,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的相对丰度之和在全日粮及替代3%、6%和9%日粮处理中的占比分别为82.87%、88.77%、86.23%和81.26%,是绝对优势菌门。对多组间的每一菌门的相对丰度进行差异分析及Kruskal Wallis秩和检验,拟杆菌门、变形菌门和酸杆菌门(Acidobacteria)的相对丰度在4组处理中有显著差异。其中,不同比例替代日粮处理的富凤麻鸡大肠微生物群落的拟杆菌门相对丰度均值排序为替代9%>CK>替代3%>替代6%,变形菌门相对丰度均值排序为替代3%>替代6%>CK>替代9%,酸杆菌门相对丰度均值排序为替代6%>替代3%>CK>替代9%。对替代组与CK两组间菌门的相对丰度进行差异分析并经Wilcoxon秩和检验,各替代组中拟杆菌门和酸杆菌门与CK均无显著差异;替代3%日粮处理的变形菌门相对丰度显著高于CK,替代9%日粮处理的变形菌门相对丰度显著低于CK,而替代6%日粮处理的变形菌门相对丰度与CK无显著差异。说明变形菌门是引起替代组与CK菌落多样性改变的主要细菌门。
2. 4 罗汉果渣发酵料替代部分日粮对富凤麻鸡大肠细菌属分类水平的影响
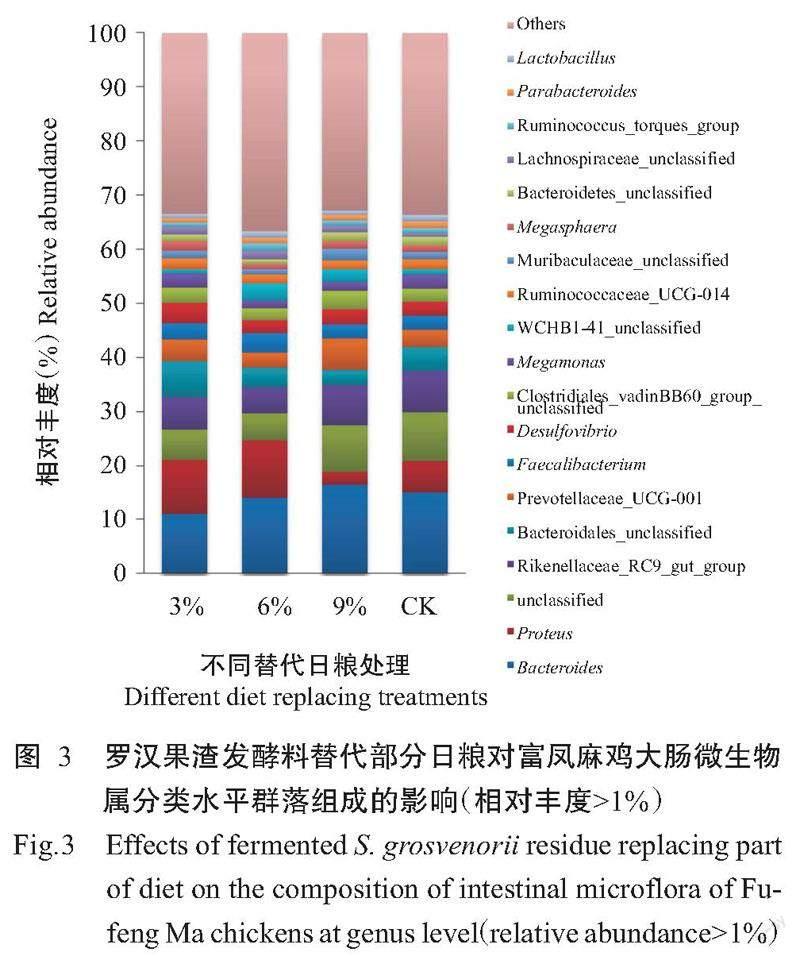
富凤麻鸡大肠微生物群落的所有OTUs共注释出509个属。相对丰度均值前50的菌属如表4所示,相对丰度均值>1%的18个菌属隶属于4个门(图3)。其中,拟杆菌属(Bacteroides)、理研菌科RC9肠道菌(Rikenellaceae_RC9_gut_group)、拟杆菌目未知菌属(Bacteroidales_unclassified)、普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)、Muribaculaceae_unclassified、拟杆菌门未知菌属(Bacteroidetes_unclassified)和副拟杆菌属(Parabacteroides)隶属于拟杆菌门;变形杆菌属(Proteus)和脱硫弧菌属(Desulfovibrio)隶属于变形菌门;粪杆菌属(Faecalibacterium)、梭菌目未知菌属(Clostridiales_vadinBB60_group_unclassified)、巨单胞菌属(Megamonas)、瘤胃菌科UCG-014(Ruminococcaceae_UCG-014)、巨球形菌属(Megasphaera)、毛螺菌科未知菌属(Lachnospiraceae_unclassified)、瘤胃球菌属(Ruminococcus]_torques_ group)、乳酸杆菌属(Lactobacillus)隶属于厚壁菌门;WCHB1-41_unclassified隶属于kiritimatiellaeota门。对相对丰度均值>1%的菌属进行相对丰度的多组间差异分析并经Kruskal Wallis秩和检验,仅变形杆菌属的相对丰度在4个处理中有显著差异。变形杆菌属在不同比例替代日粮处理中的相对丰度均值排序为替代6%>替代3%>CK>替代9%。对两组间的变形杆菌属的相对丰度进行差异分析并进行Wilcoxon检验,替代9%日粮处理显著低于CK,而替代3%和9%日粮处理与CK无显著差异。说明变形杆菌属是引起替代组与CK菌落多样性改变的主要菌属。
3 讨论
鸡消化道微生物是由大量的革兰氏阳性菌组成,以拟杆菌门、厚壁菌门和变形菌门为优势菌门(王晶等,2020)。Wei等(2013)对公共数据库中3184个鸡(肉仔鸡、蛋鸡)肠道微生物的16S rRNA序列进行分析发现,厚壁菌门(70%)、拟杆菌门(12.3%)和变形菌门(9.3%)的丰度约占全部序列的90%以上,为鸡肠道中的优势菌门;梭菌属、瘤胃球菌属、乳酸杆菌属和拟杆菌属为优势菌属。本研究中,拟杆菌门、厚壁菌门、变形菌门的相对丰度之和在全日粮及替代3%、6%和9%日粮处理组的占比分别为82.87%、88.77%、86.23%和81.26%,是各处理中的优势菌门;梭菌属、瘤胃菌属、乳酸杆菌属和拟杆菌属也位列于相对丰度>1%的菌属中,与上述文献报道的鸡肠道优势菌比较一致。结合替代组的Chao1指数与CK无显著差异的结果来评价,用罗汉果渣发酵料替代3%、6%和9%的日粮并不改变鸡肠道菌落的物种组成。动物的消化系统对营养物质消化和吸收的能力部分依赖于肠道的微生物群落的分布(物种丰富度)和总量(丰度);肠道微生物群落的物种丰富度决定了肠道代谢过程的范围,微生物的相对丰度决定了肠道代谢过程的程度(王金全等,2005)。添加罗汉果渣发酵料的日粮,其主要营养成分并不改变,仅在营养成分的含量上有改变。以添加罗汉果渣发酵料的日粮作为最终代谢底物,鸡消化系统所依赖的肠道微生物物种组成的稳定保证了肠道代谢范围的一致,其中原因可能是日粮中添加3%、6%和9%的罗汉果渣发酵料不改变富凤麻鸡大肠微生物群落的物种组成。
相比于甘蔗尾叶、玉米秸秆和象草的营养成分,罗汉果渣略高的粗蛋白质含量、低65%左右的粗脂肪含量、高于1.18倍以上的中性洗涤纤维和高于1.6倍以上的酸性洗涤纤维含量是本研究中评估影响富凤麻鸡肠道菌落多样性的重要因素。粗蛋白可能会增加产气荚膜梭菌的丰度。产气荚膜梭菌(Clostridium perfringens)又称魏氏梭菌(Clostridium welchii),隶属于厚壁菌门中的梭菌属。本研究在种分类水平上未检测(或注释)到产气荚膜梭菌,仅发现产气荚膜梭菌所隶属的梭菌属和厚壁菌门在替代组和CK中并无显著差异,可能与本研究中仅采用16S rRNA扩增子的V3和V4可变区序列对物种进行比对与注释有关。因此,本研究并不能在种的水平上评估罗汉果渣略高的粗蛋白质含量是否对产气荚膜梭菌的丰度产生影响。脂肪含量的高低可能对肠道内的乳酸杆菌、大肠杆菌和双歧杆菌产生影响。本研究中,乳酸杆菌的相对丰度>1%,其相对丰度在替代组和CK中无显著差异。大肠杆菌的相对丰度极低,且其在各试验组中的相对丰度差异不显著。双歧杆菌是一种具有改善营养元素代谢、抗腐败菌和致病菌、维持肠道平衡和预防肠道疾病的益生菌,具有重要生物学功能(贾子堂和李艳霞,2014)。本研究中,双歧杆菌虽然相对丰度排名在50名外,但其相对丰度在4个不同比例替代日粮处理中有显著差异,其相对丰度排序为全日粮>替代9%>替代3%>替代6%。其中,替代3%日粮处理与CK无显著差异,替代6%和9%日粮处理显著低于CK。试验组中的替代3%日粮处理可能是因为添加比例过低,因此未对双歧杆菌产生影響。替代6%和9%日粮处理的双歧杆菌属相对丰度均显著低于CK,表明6%和9%的替代比例会抑制双歧杆菌的丰度,可能是罗汉果渣粗脂肪含量远低于其他非粮饲料资源所引起。纤维可能对肠道产丁酸菌产生影响。本研究中,产丁酸菌Faecalibacterium prausnitzii和Roseburia spp.的相对丰度极低,且在各处理中无显著差异,表明日粮中添加3%、6%和9%的罗汉果渣均不影响产丁酸菌的丰度。因此,罗汉果渣中含量高于其他非粮饲料资源的中性洗涤纤维及酸性洗涤纤维并不影响富凤麻鸡肠道中的产丁酸菌。
变形菌门是本研究中唯一引起差异的优势菌门。其中,替代3%日粮处理的变形菌门相对丰度(22.26%)显著高于CK(14.55%),替代9%日粮处理(10.94%)显著低于CK,而替代6%日粮处理(21.65%)与CK无显著差异。随着罗汉果渣替代比例的递增,变形菌门的相对丰度值递减,说明罗汉果渣添加比例的增加会抑制变形菌门的增长。罗汉果提取物的抑菌作用已有报道。何怡(2020)对黔产罗汉果的抗炎抑菌研究中发现5个极性罗汉果提取物体内体外均有不同程度的抗炎抑菌作用,其中对大肠杆菌抑制作用最为显著;对于粪肠球菌,罗汉果提取物中只有水、甲醇、乙醇和正丁醇提取物对其具有抑制作用;对于铜绿假单胞杆菌、金黄色葡萄球菌和变形杆菌有3个极性提取物有抑菌活性。罗汉果渣也能抑制变形菌门的增长,可能与罗汉果活性成分提取不完全,果渣中仍残留有少量的药效活性成分有关。
有关肠道变形菌门丰度的高低对宿主的影响仅在人体的研究中有过报道。人肠道菌群中的4个主要菌门(厚壁菌门、拟杆菌门、变形菌门和放线菌门)中,变形菌门最不稳定(Faith et al.,2013)。作为一线应答者,变形菌门对饮食等环境因素反应敏感(Shin et al.,2015)。临床上认为肠道中变形菌门的扩张可反映肠道微生物群落结构的不稳定,且这种不稳定结构可在非疾病状态(新生儿期和胃旁路手术后)和疾病状态下(代谢紊乱和肠道炎症中)观察到(Morgan et al.,2012;Fei and Zhao,2013;Liou et al.,2013;Jakobsson et al.,2014)。目前有关肠道变形菌门丰度的高低对鸡肠道的影响的研究尚未见有报道。罗汉果渣抑制变形菌门的增长是否对鸡的生长性能、免疫或疾病发生产生影响尚需验证。基于保守的评估,6%的替代比例不改变富凤麻鸡大肠中变形菌门的丰度,是3个比例中的最佳添加比例。
4 结论
用罗汉果渣发酵料替代3%、6%和9%的日粮饲喂富凤麻鸡,不影响鸡大肠细菌群落的物种丰富度。3%和6%的替代比例降低鸡大肠细菌群落的多样性,而9%的替代比例对鸡大肠细菌群落多样性无影响。6%的替代比例降低鸡大肠中益生菌双歧杆菌的丰度,但对变形菌门的丰度无影响。基于物种丰富度、罗汉果渣的营养成分及变形菌门的丰度对富凤麻鸡大肠微生物群落影响的保守评估,罗汉果渣发酵料替代日粮的最佳替代比例为6%。
参考文献:
何怡. 2020. 黔产罗汉果抗炎抑菌谱效关系研究[D]. 贵阳:贵州大学. [He Y. 2020. Study on anti-inflammatory and bacteriostatic spectrum-effect relationship of Siraitia grosvenorii in Guizhou[D]. Guiyang:Guizhou University.]
贾子堂,李艳霞. 2014. 双歧杆菌功能与应用的研究进展[J]. 当代畜禽养殖业,(10):6-8. [Jia Z T,Li Y X. 2014. Advance in the function and application of Bifidobacterium[J]. Modern Animal Husbandry,(10):6-8.] doi:10.14070/j.cnki.15-1150.2014.10.051.
刘梦芸,赵豪斌,邓伶俐,赵敏洁,张辉,冯凤琴. 2016. 中链脂肪酸在鸡养殖中的应用研究进展[J]. 中国家禽,38(15):43-47. [Liu M Y,Zhao H B,Deng L L,Zhao M J,Zhang H,Feng F Q. 2016. Application of medium-chain fatty acids in chicken breeding[J]. China Poultry,38(15):43-47.] doi:10.16372/j.issn.1004-6364.2016.15.009.
乔立君,郑征,马文慧,芦庭秀,盖晓英,葛银林. 2014. 多不饱和脂肪酸对大鼠肠道菌群及脂肪代谢相关基因的影响[J]. 食品科学,35(17):231-235. [Qiao L J,Zheng Z,Ma W H,Lu T X,Gai X Y,Ge Y L. 2014. Effect of PUFA-containing diet on gut microbiota and fat metabolism-related genes in rats[J]. Food Science,35(17):231-235.] doi:10.7506/spkx1002-6630-201417044.
孫艳发,李焰,张敏,张茂,李虹仪,许卫华,黄其春,卢永恒,庄翔玲,范伯全. 2017. 日粮添加茶籽饼粕对肉鸡脂肪代谢、免疫功能和肠道微生物的影响[J]. 饲料研究,(3):1-5. [Sun Y F,Li Y,Zhang M,Zhang M,Li H Y,Xu W H,Huang Q C,Lu Y H,Zhuang X L,Fan B Q. 2017. Effects of adding tea seed cake cypress to diet on fat metabolism, immune function and intestinal microorganisms in broilers[J]. Feed Research,(3):1-5.] doi:10. 13557/j.cnki.issn1002-2813.2017.03.001.
王金全,蔡辉益,周岩华,刘国华,张姝,印遇龙. 2005. 小麦日粮非淀粉多糖和木聚糖酶对肉仔鸡肠道微生物区系的影响[J]. 畜牧兽医学报,36(10):1014-1020. [Wang J Q,Cai H Y,Zhou Y H,Liu G H,Zhang S,Yin Y L. 2005. Effects of wheat NSP and xylanase on intestinal microbial population and microbial diversity in broilers[J]. Acta Veterinaria et Zootechnica Sinica,36(10):1014-1020.] doi:10.3321/j.issn:0366-6964.2005.10.007.
王晶,戴东,武书庚,张海军,齐广海. 2020. 鸡肠道微生物演替与早期定植的研究进展[J]. 生物技术通报,36(2):1-8. [Wang J,Dai D,Wu S G,Zhang H J,Qi G H. 2020. Advances in successional development and early establishment of the chicken intestinal microbiota[J]. Biotechnology Bulletin,36(2):1-8.] doi:10.13560/j.cnki.biotech.bull.1985.2019-1197.
王启芝,黄光云,梁琪妹,周俊华,黄丽霞,黄香,周志扬,罗鲜青,孙俊丽,唐承明,李绍波,何仁春. 2018. 广西17种非粮饲料资源营养价值监测[J]. 粮食与饲料工业,(4):47-50. [Wang Q Z,Huang G Y,Liang Q M,Zhou J H,Huang L X,Huang X,Zhou Z Y,Luo X Q,Sun J L,Tang C M,Li S B,He R C. 2018. Nutritional value monitoring of 17 kinds of non-grain feed resources in Guangxi[J]. Cereal & Feed Industry,(4):47-50.] doi:10.7633/j.issn.1003-6202.2018.04.012.
于文雅,孙泽威,刘飞飞,孙会,王富贵. 2015. 日粮碳水化合物与油脂能值比对断奶仔猪肠道微生物的影响[J]. 中国畜牧杂志,51(17):35-38. [Yu W Y,Sun Z W,Liu F F,Sun H,Wang F G. 2015. Influence of diet ary ratio of CEV to FEV on intestinal microbial flora of weaned pigs[J]. Chinese Journal of Animal Science,51(17):35-38.] doi:10.3969/j.issn.0258-7033.2015.17.008.
张倩雲. 2021. 早期日粮添加大豆浓缩蛋白对肉鸡生产性能、氨基酸表观消化率、肠道发育和肠道微生物及其代谢产物的影响[D]. 南宁:广西大学. [Zhang Q Y. 2021. Effects of soy protein concentrate in starter phase diet on growth performance, apparent digestibility of amino acids, intestinal development, intestinal microorganisms and metabolites of broilers[D]. Nanning:Guangxi University.]
张嵩,罗正,程军波. 2018. 日粮因素对肉鸡肠道菌群的影响研究进展[J]. 中国家禽,40(19):49-52. [Zhang S,Luo Z,Cheng J B. 2018. Effects of dietary compositions on intestinal microflora in broiler chicken[J]. China Poultry,40(19):49-52.] doi:10.16372/j.issn.1004-6364.2018. 19.011.
Benus R F J,van der Werf T S,Welling G W,Judd P A,Taylor M A,Harmsen H J M,Whelan K. 2010. Association between Faecalibacterium prausnitzii and dietary fibre in colonic fermentation in healthy human sujects[J]. British Journal of Nutrition,104(5):693-700. doi:10.1017/S000 7114510001030.
Blaxter M,Mann J,Chapman T,Tomas F,Whitton C,Floyd R,Abebe E. 2005. Defining operational taxonomic units using DNA barcode data[J]. Philosophical transactions of the Royal Society of London,360(1462):1935-1943. doi:10.1098/rstb.2005.1725.
Delphine A,Marianne W,Michel P,Katharina D,Stephan C. 2013. Clostridium perfringens beta-toxin induces necrostatin-inhibitable, calpain-dependent necrosis in primary porcine endothelial cells[J]. PLoS One,8(5):e64644. doi:10.1371/journal.pone.0064644.
Faith J J,Lelwala-Guruge J,Charbonneau M,Subramanian S,Seedorf H,Goodman A L,Clemente J C,Knight R,Heath A C,Leibel R L,Rosenbaum M,Gordon J I. 2013. The long-term stability of the human gut microbiota[J]. Science, 341(6141):1237439. doi:10.1126/science. 1237439.
Fei N,Zhao L P. 2013. An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice[J]. The ISME Journal,7:880-884. doi:10.1038/ismej.2012.153.
Jakobsson H E,Abrahamsson T R,Jenmalm M C,Harris K,Quince C,Jernberg C,Björkstén B,Engstrand L,Andersson A F. 2014. Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by caesarean section[J]. Gut,63(4):559-566. doi:10.1136/gutjnl-2012-303249.
Liou A P,Paziuk M,Luevano J M Jr,Machineni S,Turnbaugh P J,Kaplan L M. 2013. Conserved shifts in the gut microbiota due to gastric bypass reduce host weight and adiposity[J]. Science Translational Medicine,5(178):178ra41. doi:10.1126/scitranslmed.3005687.
Morgan X C,Tickle T L,Sokol H,Gevers D,Devaney K L,Ward D V,Reyes J A,Shah S A,Leleiko N,Snapper S B,Bousvaros A,Korzenik J,Sands B E,Xavier R J,Huttenhower C. 2012. Dysfunction of the intestinal microbiome in inflammatory bowel disease and treatment[J]. Genome Biology,13(9):R79. doi:10.1186/gb-2012-13-9-r79.
Shin N R,Whon T W,Bae J W. 2015. Proteobacteria: Microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology,33(9):496-503. doi:10.1016/j.tibtech. 2015.06.011.
Wei S,Morrison M,Yu Z. 2013. Bacterial census of poultry intestinal microbiome[J]. Poultry Science,92(3):671-683. doi:10.3382/ps.2012-02822.
(責任编辑 邓慧灵)
收稿日期:2022-06-08
基金项目:广西重点研发计划项目(桂科AB20297012);广西科技基地和人才专项(桂科AD21238004)
通讯作者:肖正中(1985-),https://orcid.org/0000-0002-0929-8734,高级畜牧师,主要从事畜禽生态养殖与动物营养研究工作,E-mail:269449090@qq.com
第一作者:滕少花(1969-),https://orcid.org/0000-0003-4553-9619,研究员,主要从事南方牧草选育与生态治理研究工作,E-mail:tsh088@126.com
