广西壮瑶药瘤果紫玉盘SCoT-PCR反应体系建立及引物筛选
2023-11-02张尚文杨天为黄诗宇李婷高曼熔何龙飞张向军
张尚文 杨天为 黄诗宇 李婷 高曼熔 何龙飞 张向军




DOI:10.3969/j.issn.2095-1191.2023.06.006
摘要:【目的】建立瘤果紫玉盤SCoT-PCR最佳反应体系,并筛选出适宜的SCoT引物,为瘤果紫玉盘种质鉴定分类、亲缘关系分析和遗传多样性分析提供理论参考。【方法】以广西河池、百色、柳州、南宁4份瘤果紫玉盘野生种质为试材,通过单因素试验和正交试验对瘤果紫玉盘SCoT-PCR反应体系的DNA模板用量、引物用量和Mix预混液用量3个因素进行优化,并使用优化后最佳反应体系进行SCoT引物筛选。最后将SCoT-PCR最佳反应体系和筛选出的引物用于瘤果紫玉盘种质的遗传多样性分析。【结果】单因素试验结果显示,DNA模板用量为40~70 ng,引物(10 μmoL/L)用量为1.0~1.4 μL,Mix预混液用量为9.0~12.0 μL范围内扩增效果较好,通过L16(43)正交试验确定瘤果紫玉盘的SCoT-PCR最佳反应体系20.0 μL:DNA模板(40 ng/μL)1.0 μL,引物(10 μmoL/L)1.2 μL,Mix预混液10.0 μL,7.8 μL ddH2O。利用最佳反应体系筛选出26条适用于瘤果紫玉盘的SCoT引物,并确定了各引物最适的退火温度。26条SCoT引物在4份瘤果紫玉盘材料中共扩增出305个基因位点,其中多态性位点204个,多态性比率为66.89%,平均每条引物扩增出11.7个基因位点,有8.7个多态性位点。4份瘤果紫玉盘种质的平均等位基因数(Na)为1.7377,平均有效等位基因数(Ne)为1.5344,Nei’s基因多样性指数(H′)为0.3053,Shannon指数(I)为0.4449。4份瘤果紫玉盘间的遗传相似系数为0.5443~0.6492,遗传距离为0.4320~0.6083,说明4份瘤果紫玉盘种质间存在较大的遗传变异,遗传多样性水平较高。【结论】建立的SCoT-PCR最佳反应体系和筛选出的26条SCoT标记引物扩增效果较好,可用于瘤果紫玉盘种质资源的鉴定分类、亲缘关系分析和遗传多样性分析。
关键词:瘤果紫玉盘;SCoT-PCR;反应体系优化;引物筛选;遗传多样性
中图分类号:S567.19 文献标志码: A 文章编号:2095-1191(2023)06-1646-10
Establishment of SCoT-PCR reaction system and primer
screening of Guangxi Zhuang-Yao medicine Uvaria kweichowensis
ZHANG Shang-wen1, YANG Tian-wei1, HUANG Shi-yu1, LI Ting1, GAO Man-rong1,2,
HE Long-fei2, ZHANG Xiang-jun1*
(1Biotechnology Research Institute,Guangxi Academy of Agricultural Science,Nanning,Guangxi 530007,China;
2College of Agriculture,Guangxi University,Nanning,Guangxi 530004,China)
Abstract:【Objective】The purpose of the study was to establish the optimal SCoT-PCR reaction system for Uvaria kweichowensis, and to screen out the suitable SCoT primers, so as to provide theoretical references for germplasm identification and classification, genetic relationship analysis and genetic diversity analysis of U. kweichowensis. 【Method】Four wild germplasms of U. kweichowensis in Hechi, Baise, Liuzhou and Nanning of Guangxi were used as test materials, and the three factors of the SCoT-PCR reaction system of U. kweichowensis, namely, DNA template dosage, primer dosage and Mix premix dosage were optimized by single factor test and orthogonal test, and the optimized SCoT-PCR reaction system was used for SCoT primer screening. The optimal SCoT-PCR reaction system and screened primers were used to analyze the genetic diversity of U. kweichowensis germplasm. 【Result】The results of single factor test showed that the amplification effect was better at the dosages of 40-70 ng of DNA template, 1.0-1.4 μL of primer (10 μmoL/L), and 9.0-12.0 μL of Mix premix. The optimal SCoT-PCR reaction system (20.0 μL) for U. kichowensis was determined by L16(43) orthogonal test: 1.0 μL of DNA template (40 ng/μL), 1.2 μL of primer (10 μmoL/L), 10.0 μL of Mix premix, and 7.8 μL of ddH2O. The 26 SCoT primers suitable for U. kweichowensis were screened using the optimal reaction system, and the optimal annealing temperature of each primer was determined. A total of 305 gene loci were amplified by 26 SCoT primers in four U. kweichowensis materials, of which 204 were polymorphic loci, wit a polymorphism rate of 66.89%. On average,11.7 gene loci were amplified by each primer, among which there were 8.7 polymorphic loci. The average allele number (Na) of the four U. kweichowensis germplasms was 1.7377, the average effective number of alleles (Ne) was 1.5344, the Nei’s gene diversity index (H') was 0.3053, and Shannon index (I) was 0.4449. The genetic similarity coefficients among the four U. kweichowensis ranged from 0.5443 to 0.6492, and the genetic distances ranged from 0.4320 to 0.6083, indicating that there was a large genetic variation among the four U. kweichowensis germplasms, and the level of genetic diversity was high. 【Conclusion】The established SCoT-PCR optimal reaction system and the screened 26 SCoT marker primers have good amplification effects, which can be used for germplasm identification and classification, genetic relationship analysis, and genetic diversity analysis of germplasm resources of U. kweichowensis.
Key words: Uvaria kweichowensis; SCoT-PCR; reaction system optimization; primer screening; genetic diversity
Foundation items: National Modern Agricultural Industrial Technology System (CARS-21);Guangxi Key Research and Development Plan Project (Guike 21220042);Guangxi Characteristic Crop Test Station Project (Gui TS2022002);Innovation Project in Key Areas of Guangxi Soil and Water Conservation Society (202009001)
0 引言
【研究意義】瘤果紫玉盘(Uvaria kweichowensis)为番荔枝科紫玉盘属植物,是一种攀援灌木,主要分布于我国贵州、广西等地,生长于海拔1000 m的地区,其味微甘性温,具消炎止痛、活血通经的功效。瘤果紫玉盘已被列入广西壮药(广西壮族自治区食品药品监督管理局,2018)和瑶药(广西壮族自治区药品监督管理局,2022)。瘤果紫玉盘植物中含有黄酮、多氧取代环己烯、番荔枝内酯、生物碱等成分,在抗氧化、抗肿瘤、抗炎症等方面具有重要作用(许琼明等,2006,2007)。民间常用瘤果紫玉盘叶煮沸作茶饮用,对高尿酸症、肝癌、肝腹水和前列腺疾病有较明显的作用,同时对风湿和类风湿有一定的疗效。虽然瘤果紫玉盘具有非常高的药用价值,但不同地区的瘤果紫玉盘种质中有效成分含量区别较大。分子标记广泛应用于物种种质资源研究,能揭示不同个体或群体之间的遗传变异情况,在物种的遗传多样性分析、种质鉴定、育种研究等方面具有重要意义。SCoT是一种能扩增到与性状相关的目的基因片段的分子标记,其具有稳定性强、重复性好、多态性丰富、操作快捷简便、成本较低等优点,非常适用于植物遗传特性方面的研究(龙治坚等,2015)。因此,建立广西壮瑶药瘤果紫玉盘SCoT-PCR最佳反应体系,并筛选适宜的引物,对瘤果紫玉盘种质鉴定分类、亲缘关系分析和遗传多样性分析具有重要意义。【前人研究进展】目前,瘤果紫玉盘尚未进行人工引种栽培,野生种质资源稀少,有关种质资源的研究鲜见报道,育种研究停滞不前,阻碍了瘤果紫玉盘潜在药用价值的研究与开发。据《中国植物志》记载,瘤果紫玉盘在我国分布面积狭小,已知分布点少于10个,生境明显退化,成熟个体数非常少。因此,瘤果紫玉盘野生种质资源的保护与有效利用是当前重要的工作。SCoT分子标记已广泛应用于拳卷地钱(谢凤凤等,2018)、葛根(尚小红等,2019)、血叶兰(郑涛等,2020)、铁皮石斛(邵征绩等,2021)等药用植物中。研究发现,SCoT分子标记的扩增条带稳定且多态性高,能有效对种质资源进行遗传多样性评价(龙治坚等,2015)。高效准确获取种质资源SCoT分子标记信息的前提是稳定可靠的SCoT-PCR反应体系,该体系受到DNA模板量、引物浓度、dNTPs浓度、Taq DNA聚合酶量等因素的影响,且各因素对PCR反应体系的影响程度在不同物种中存在明显差异(陈喆等,2015;戚华沙等,2022)。因此,目前已有较多研究通过正交试验进行SCoT反应体系优化,以期获得更稳定的SCoT分子标记信息。如对DNA模板、Mg2+、dNTPs、Taq DNA聚合酶和引物5个因素进行正交试验(陈喆等,2015;袁柳娇等,2017);对DNA模板、引物和Mix预混液3种因素进行正交试验(袁王俊等,2015;耿睿曼等,2021),其中Mix预混液为Mg2+、dNTPs、Taq DNA聚合酶的混合液,其优点是将3种因素混合后能减少试验操作步骤,能有效减小添加Mg2+、dNTPs和Taq DNA聚合酶的操作误差,且提高了试验效率,扩增结果也更稳定。通常反应体系优化的研究方法主要是单因素试验和正交试验(李娜等,2014; 邵征绩等,2021)。采用单因素试验对各影响因素进行优化,能分析单个影响因素的最优范围,快速确定单一因素的最佳用量,但PCR反应受到各个影响因素的相互作用,仅凭单因素试验无法分析多因素的影响结果,而正交试验能综合分析多因素之间相互作用的影响,从而弥补单因素试验的缺陷(刘新梅等,2022)。因此,通过单因素试验确定适宜的条件范围后,再进行正交试验综合分析,从而获得更准确可靠的结果。Collard和Mackill(2009)公布的36条SCoT引物具有较好的通用性,已在多种植物中获得验证和应用(袁王俊等,2015;席秀利等,2018;尚小红等,2019)。【本研究切入点】目前鲜见有关瘤果紫玉盘种质资源SCoT-PCR反应体系建立及引物筛选的研究报道。【拟解决的关键问题】通过单因素试验和正交试验对SCoT-PCR反应体系的DNA模板用量、引物用量和Mix预混液用量进行优化,建立适用于瘤果紫玉盘的SCoT-PCR最佳反应体系,并利用该体系进行SCoT引物筛选,确定各引物的退火温度,最后利用筛选获得的SCoT引物对瘤果紫玉盘种质进行遗传多样性分析,为瘤果紫玉盘种质鉴定分类和亲缘关系分析提供理论参考。
1 材料与方法
1. 1 试验材料
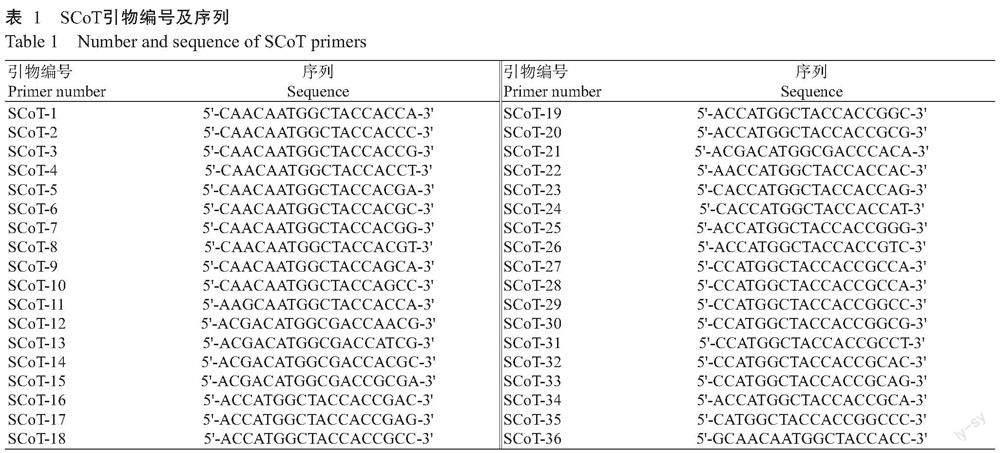
供试材料为瘤果紫玉盘,分别采集于广西河池、百色、柳州和南宁4个分布地居群,经广西中医药研究院黄云峰副研究员鉴定为瘤果紫玉盘(Uvaria kweichowensis)。在4个分布地居群中随机挑选一株生长健康,外观无明显差异的植株。SCoT分子标记引物参考Collard和Mackill(2009)公布的SCoT-1~ SCoT-36(表1),委托生工生物工程(上海)股份有限公司合成。2×Taq PCR MasterMix(500 μmoL/L dNTPs,3 μmoL/L MgCl2,0.1 U/μL Taq DNA聚合酶)(以下简称Mix预混液)购自北京索莱宝科技有限公司。主要仪器设备:TProfessional梯度PCR仪(Biometra,德国)、UVI FireReader凝胶成像系统(UVItec Cambridge,英国)和DYY-6D型电泳仪(北京市六一仪器厂)。
1. 2 试验方法
1. 2. 1 基因组DNA提取 采用改良CTAB法提取4份广西不同地区瘤果紫玉盘叶片DNA(Yi et al.,2018),通过NanoDrop One超微量分光光度計测定DNA纯度及浓度,并通过0.8%琼脂糖凝胶电泳检测。检测合格的DNA置于-20 ℃冰箱冷冻保存。
1. 2. 2 单因素试验设计 选用预扩增效果较好的SCoT-29引物对DNA模板用量、引物用量、Mix预混液用量进行单因素试验。扩增程序:94 ℃ 3 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,进行35个循环;72 ℃延伸5 min。SCoT初始反应体系20.0 μL:1.0 μL DNA模板(50 ng/μL),1.0 μL引物(10 μmoL/L),10.0 μL Mix预混液,ddH2O补足至20.0 μL。单一因素设6个水平梯度,其中DNA模板用量设20、30、40、50、60和70 ng;引物用量设0.4、0.6、0.8、1.0、1.2和1.4 μL;Mix预混液用量设7.0、8.0、9.0、10.0、11.0和12.0 μL。按照浓度梯度改变变量因素进行加样,其他影响因素为初始条件。
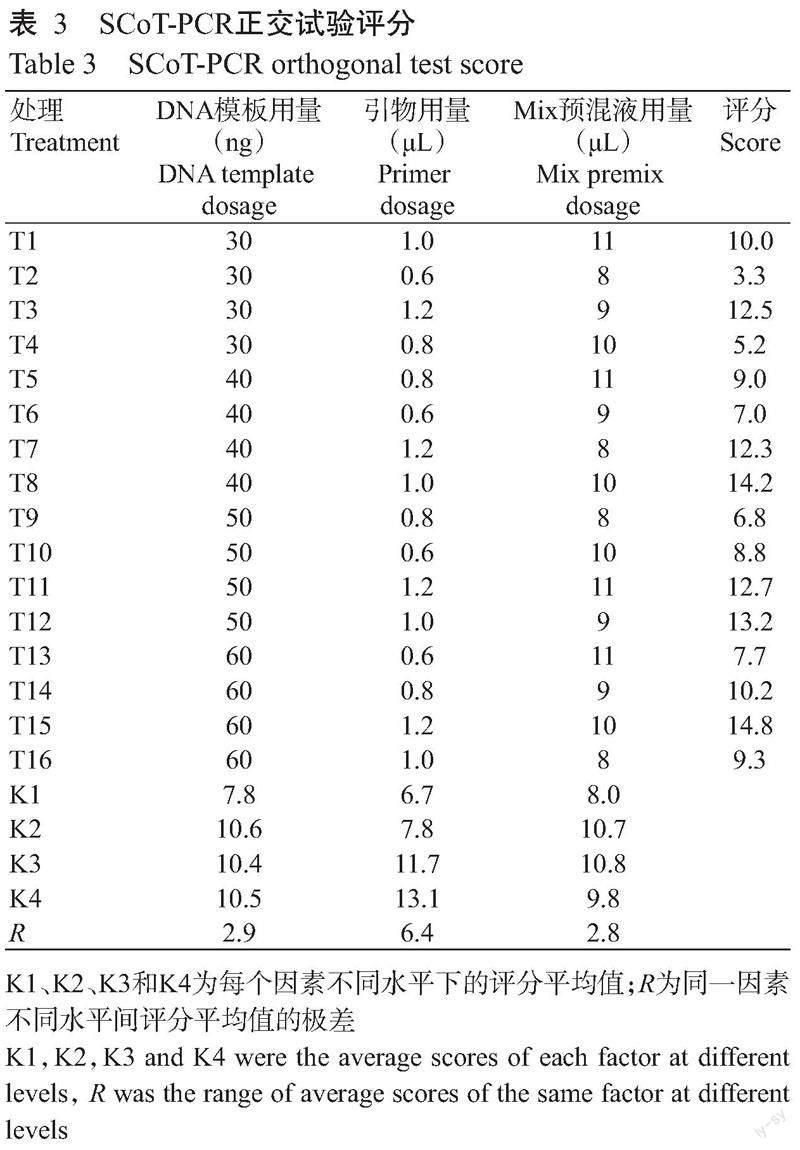
1. 2. 3 SCoT-PCR正交试验 通过L16(43)正交试验(表2)对DNA模板用量、引物用量和Mix预混液用量3个影响因素进行优化,共16个处理(T1-T16)。PCR扩增程序与单因素试验一致,扩增产物采用1.0%琼脂糖凝胶电泳检测(40~60 min),在凝胶成像系统下观察扩增结果,并参考尚小红等(2018)的直观分析法进行评分,满分为16分,分数越高表示扩增质量越好。Ki表示第i水平的评分平均值,反映各水平的扩增效果,R表示同一因素不同处理水平评分平均值的极差,反映各因素对扩增结果的影响程度,根据评分结果最终确定瘤果紫玉盘SCoT-PCR的最佳反应体系。
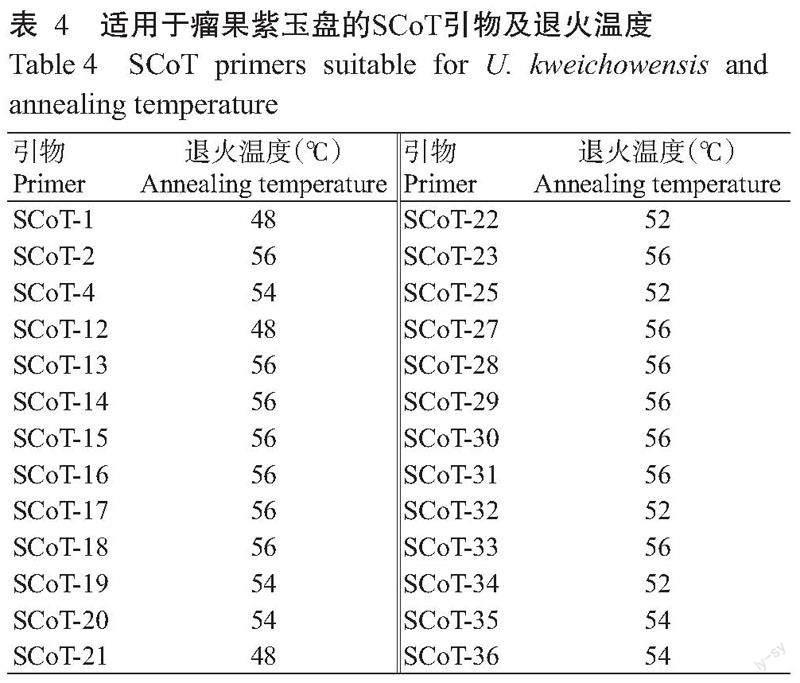
1. 2. 4 SCoT引物筛选及退火温度优化 以广西河池地区的瘤果紫玉盘DNA为模板,通过SCoT-PCR最佳反应体系对36条SCoT引物进行筛选,并通过设置退火温度梯度(48、50、52、54、56和58 ℃)进行复筛,选择背景清晰、明亮、条带数多的引物作为瘤果紫玉盘SCoT分子标记的候选引物。
1. 2. 5 最佳反应体系及引物验证 利用SCoT-PCR最佳反应体系及SCoT候选引物对4份广西不同地区的瘤果紫玉盘种质进行PCR扩增,通过1.2%琼脂糖凝胶电泳检测扩增结果,以验证该体系和候选引物的可行性和稳定性。
1. 2. 6 SCoT引物多态性分析 根据扩增条带的位置转化为0、1矩阵,即在相同迁移率下同一位点的DNA扩增条带的有无分别记为“1”和“0”,并对SCoT引物进行多态性分析。
1. 3 统计分析
使用SPSS 22.0进行正交试验设计,通过Excel 2021计算每因素各水平评分的平均值Ki和同一因素不同水平间评分平均值的极差(R)。基于4份瘤果紫玉盘种质的分子标记数据,利用Popgene 32进行遗传多样性指标、遗传相似系数和遗传距离计算。
2 结果与分析
2. 1 基因组DNA提取及检测结果
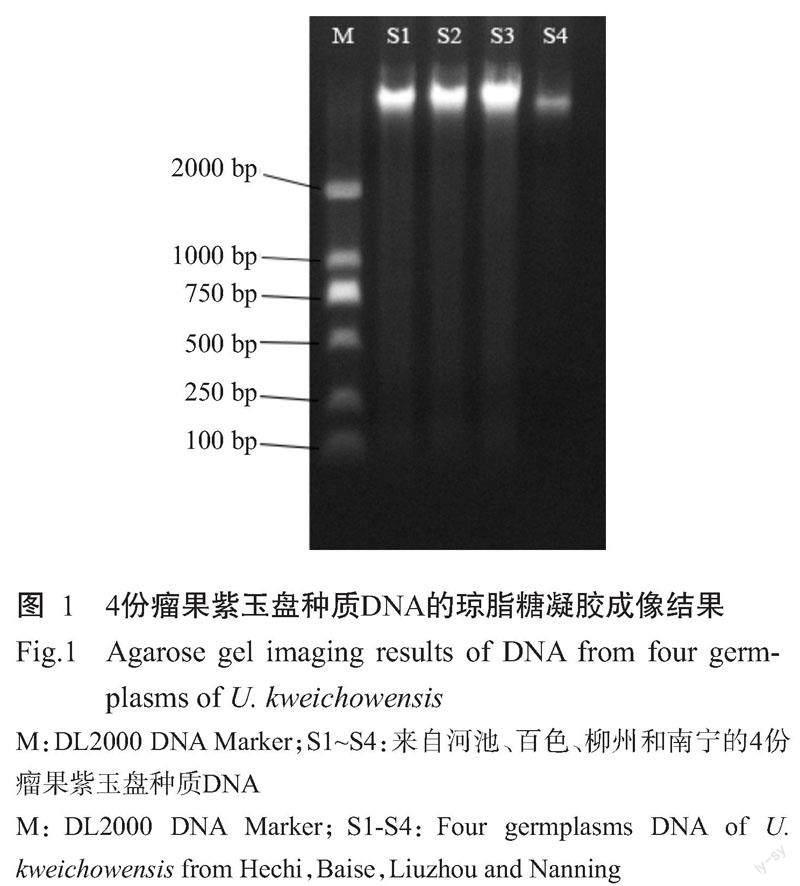
4份瘤果紫玉盘种质DNA的电泳检测结果(图1)显示,条带清晰明亮,无拖带和污染现象。DNA纯度和浓度检测结果显示,OD260/OD280为1.8~2.0,OD260/OD230为2.0~2.2,4份瘤果紫玉盘种质DNA(S1~S4)浓度均较高,分别为310.1、298.3、353.6和132.8 ng/μL,质量较好,满足单因素试验和正交试验的DNA模板要求。
2. 2 单因素试验结果
采用SCoT-29引物和广西河池地区瘤果紫玉盘种质DNA进行单因素试验,结果(图2)显示,不同用量的DNA模板、引物、Mix预混液对PCR扩增效果均有不同程度地影响,其中,不同引物用量的PCR扩增效果差异较大,不同DNA模板和Mix预混液用量的PCR扩增效果差异较小。根据条带的数量、明暗度、背景清晰度判断扩增效果,DNA用量为20 ng时,有部分条带缺失或模糊,而用量为30~70 ng时,随着用量增加,部分条带会更弥散,故选择30~60 ng作为正交试验梯度。引物(10 μmoL/L)用量为0.4 μL时,缺失和模糊的条带较多,用量为0.6和0.8 μL时,虽然扩增条带数量多,但少部分条带略模糊,用量1.0~1.4 μL均能扩增到丰富、清晰的条带,而用量为1.0 μL时,扩增效果最佳,用量为1.2和1.4 μL时,扩增效果基本一致,说明当用量大于1.2 μL,扩增效果并不会明显提升,故选择0.6~1.2 μL作为正交试验的梯度。Mix预混液用量为7.0 μL时,扩增条带有缺失且较模糊,用量为9.0 μL时扩增条带最多,但少部分条带较模糊,用量为10.0和11.0 μL时扩增效果基本一致,用量为12.0 μL时,部分条带亮度略微减弱,故选择8.0~11.0 μL作为正交试验梯度。
2. 3 正交试验结果
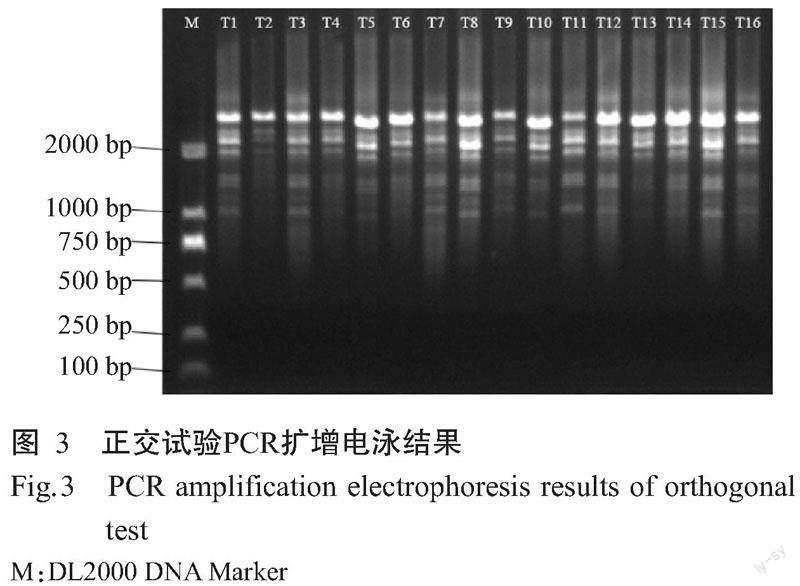
各处理的PCR扩增结果(图3)显示,16个处理均能有效扩增出条带,不同处理间的条带清晰度和数量存在一定差异,评分结果如表3所示。通过Ki值可确定每个因素的最佳条件:DNA模板40 ng,引物1.2 μL,Mix预混液10.0 μL。由R可知,引物用量对扩增反应的影响最大,其次为DNA模板用量和Mix预混液用量。最终确立SCoT-PCR的最佳反应体系20.0 μL:1.0 μL DNA模板(40 ng/μL),1.2 μL引物(10 μmoL/L),10.0 μL Mix预混液,7.8 μL ddH2O。
2. 4 引物筛选结果
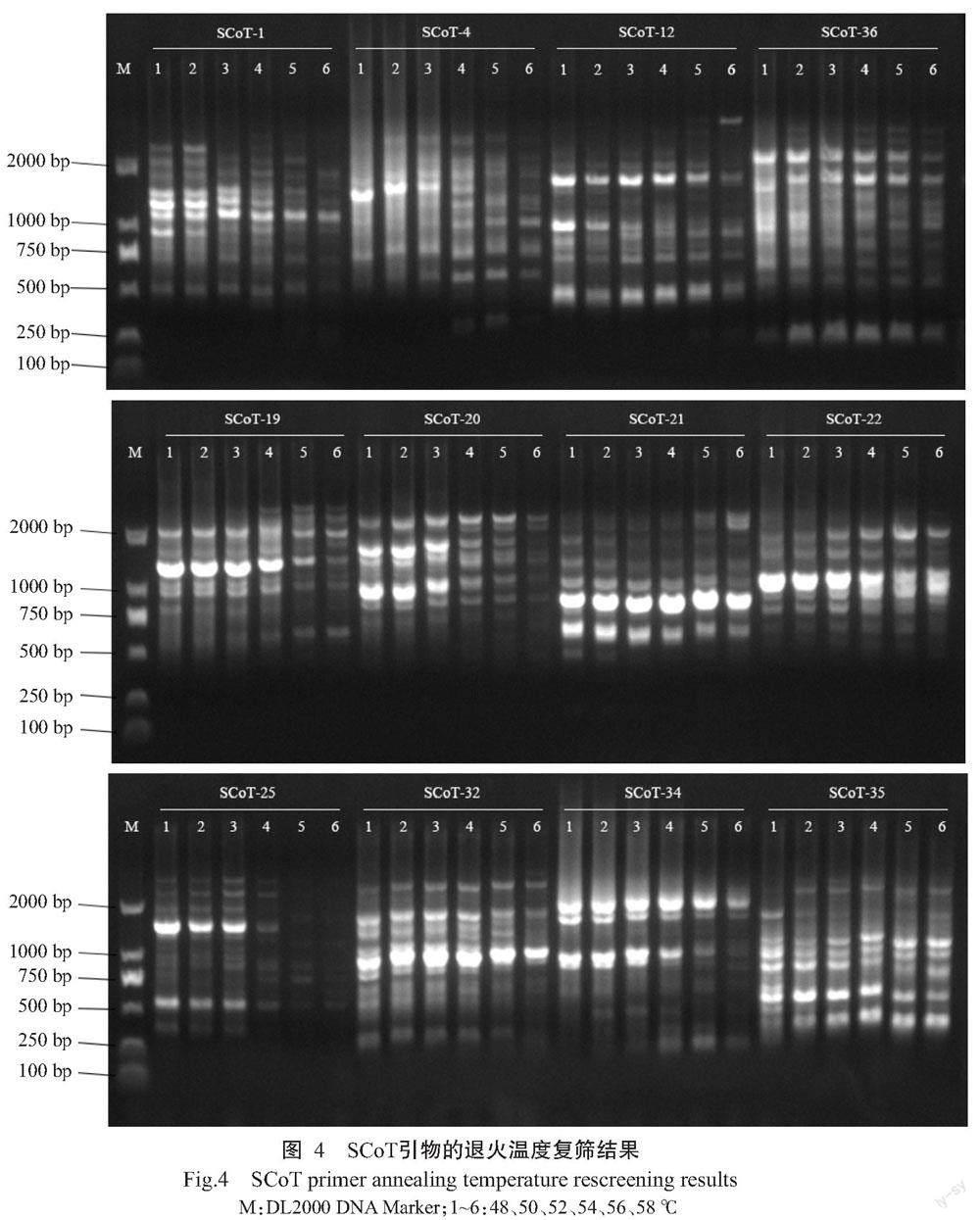
使用优化后的最佳反应体系对广西河池地区的瘤果紫玉盘DNA模板在退火温度56 ℃下进行36条SCoT引物的初步筛选,初筛后通过设置退火温度梯度(48、50、52、54、56和58 ℃)进行复筛,挑选2次筛选结果中多态性丰富、背景清晰、条带明亮的引物作为瘤果紫玉盘SCoT分子标记的候选引物,部分退火温度复筛结果如图4所示。最终筛选出适用于瘤果紫玉盘的26条SCoT引物及相应退火温度(表4),适用于瘤果紫玉盘SCoT引物的退火温度为48~56 ℃。
2. 5 SCoT-PCR最佳反应体系和候选引物验证结果
利用表型差异较大的4份瘤果紫玉盘种质对SCoT-PCR最优反应体系和候选引物进行验证,以检验反应体系和候选引物的可行性和稳定性,部分结果如图5所示。候选引物从4份瘤果紫玉盘种质DNA中均能扩增出背景清晰、特异性好、多态性丰富的条带,说明该体系结果稳定可靠,可用于瘤果紫玉盘种质遗传多样性分析。
2. 6 遗传多样性分析结果
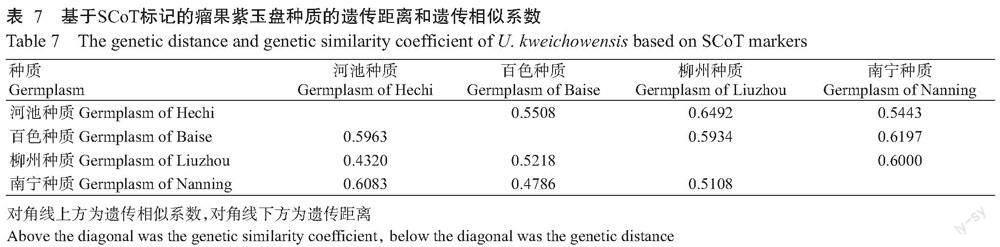
由表5可知,26条SCoT引物从4份瘤果紫玉盘种质材料中共扩增出305个位点,其中多态性位点204个,多态性比率为66.89%,平均每条引物扩增出11.7个位点,其中有8.7个多态性位点。SCoT-12引物的多态性比率最高,为100.00%,SCoT-22引物的多态性比率最低,为40.00%。由表6可知,4份瘤果紫玉盘种质的平均等位基因数(Na)为1.7377,平均有效等位基因数(Ne)为1.5344,Nei’s基因多样性指数(H′)为0.3053,Shannon指数(I)为0.4449。由表7可知,4份瘤果紫玉盘种质间的遗传相似系数为0.5443~0.6492,遗传距离为0.4320~0.6083,其中柳州种质与河池种质的遗传相似系数最大,为0.6492,遗传距离最近,为0.4320,南宁种质与河池种质的遗传相似系数最小,为0.5443,遗传距离最远,为0.6083。以上结果说明4份瘤果紫玉盘种质间存在较大的遗传变异,遗传多样性水平较高。
3 讨论
瘤果紫玉盘是一种珍稀濒危的药用植物,具有极高的药用价值,开展瘤果紫玉盘遗传特性方面的研究能为其种质资源的收集保护、高效利用提供理论指导。SCoT是一种能快速揭示物种遗传结构的分子标记,对物种鉴定和亲缘关系分析具有重要意义,而SCoT反应体系优化是在SCoT分子标记扩增的基础上,分析SCoT-PCR反应体系中各影响因素的配比组成对扩增效果产生直接的影响(娄永峰等,2021),只有确定稳定可靠的SCoT-PCR反应体系才能用于后续的种质遗传特性研究。
本研究通过单因素试验比较3个因素梯度的扩增效果,结果发现不同引物用量的PCR扩增效果差异较大,不同DNA模板用量和Mix预混液用量的PCR扩增效果差异较小,而正交试验结果中3个因素的影响程度大小排序为引物用量>DNA模板用量>Mix预混液用量,说明单因素试验结果与正交试验结果基本一致。该结果与前人研究结果存在差异,如在铁皮石斛SCoT-PCR反应体系优化研究中发现,引物用量的影响程度最大,DNA模板用量的影响程度最小(邵征绩等,2021);在陈山红心杉SCoT-PCR反应体系优化中研究中发现,Mix预混液用量的影响程度最大,DNA模板用量的影响程度最小(娄永峰等,2021),说明SCoT-PCR反应体系中各因素的影响程度会因植物材料不同而有所差异,故获得的最佳反应体系条件也不相同。
SCoT分子标记是Collard和Mackill (2009)提出的一种基于单引物扩增反应的新型分子标记方法,公布的36条SCoT引物在多种植物中具有通用性(王俏君等,2018),如王玉等(2014)、尚小红等(2018)分别从36条SCoT引物中筛选出20条适用于玫瑰的SCoT引物和35条适用于葛根的SCoT引物,可用于遗传多样性分析。在引物的筛选过程中,退火温度直接影响到引物与DNA模板的特异性结合和扩增条带的清晰程度,同一引物和DNA模板在不同退火温度下产生的扩增结果存在显著差异(江常胜等,2022)。本研究利用优化后SCoT-PCR最佳反应体系进行引物初筛,并通过退火温度梯度复筛最终确定26条引物及其相应退火温度,26条SCoT引物退火温度为48~56 ℃,与席秀利等(2018)的研究结果相比,发现同一引物在不同植物中的最佳退火温度并不相同,说明同一SCoT引物应用于不同植物材料时还需重新进行最佳退火温度的筛选。
本研究SCoT引物多态性分析结果显示,26条SCoT引物的多态性比率为40.00%~100.00%,平均多态性率达66.89%,26条SCoT引物在4份瘤果紫玉盘种质中均能扩增出清晰条带,多态性较高,其遗传多样性分析结果显示,4份瘤果紫玉盘种质间存在较大的遗传变异,说明不同地理位置分布的种质具有较高的遗传多样性,而有关居群的遗传背景还需进一步研究。上述结果表明,优化后的SCoT-PCR最佳反應体系和筛选获得的26条SCoT可有效用于瘤果紫玉盘的遗传多样性分析。
4 结论
通过对DNA模板用量、引物用量、Mix预混液用量进行单因素试验和正交试验,最终确立适用于瘤果紫玉盘的SCoT-PCR最佳反应体系20.0 μL DNA模板(40 ng/μL)1.0 μL,引物(10 μmoL/L)1.2 μL,Mix预混液10.0 μL,ddH2O 7.8 μL。建立的SCoT-PCR最优反应体系和筛选出的26条SCoT引物可用于瘤果紫玉盘种质资源的鉴定分类、亲缘关系分析、遗传多样性分析。
参考文献:
陈喆,冯尚国,王振,何仁锋,姜梦莹,王慧中. 2015. 温郁金SCoT-PCR反应体系的正交优化[J]. 北方园艺,(12):84-90. [Chen Z,Feng S G,Wang Z,He R F,Jiang M Y,Wang H Z. 2015. Orthogonal optimization of start codon targeted polymorphism system in Curcuma wenyujin Y. H. Chen et C. Ling[J]. Northern Horticulture,(12):84-90.] doi:10.11937/bfyy.201512023.
耿睿曼,韩有志,刘志红,王林,解庆. 2021. 沙棘SCoT-PCR反应体系的优化及引物筛选[J]. 分子植物育种,19(6):1940-1946. [Geng R M,Han Y Z,Liu Z H,Wang L,Xie Q. 2021. Optimization of SCoT PCR reaction system and selection of primers for Hippophae rhamnoides[J]. Molecular Plant Breeding,19(6):1940-1946.] doi:10.13271/j.mpb.019.001940.
广西壮族自治区食品药品监督管理局. 2018. 广西壮族自治区壮药质量标准(第三卷)[M]. 南宁:广西科学技术出版社:224-226. [Guangxi Zhuang Autonomous Region Food and Drug Administration. 2018. Zhuang medicine quality standard of Guangxi Zhuang Autonomous Region(Volume III)[M]. Nanning:Guangxi Science and Technology Publishing House:224-226.]
广西壮族自治区药品监督管理局. 2022. 广西壮族自治区瑶药材质量标准(第二卷)[M]. 南宁:广西壮族自治区药品监督管理局:164. [Guangxi Zhuang Autonomous Region Drug Administration. 2022. Yao medicine quality standard of Guangxi Zhuang Autonomous Region (Volu-me II)[M]. Nanning:Guangxi Zhuang Autonomous Region Drug Administration:164.]
江常胜,朱洪海,钟永丽,刘明晓,东方. 2022. 正交试验与单因子双重试验法优化玉米PCR反应体系[J]. 智慧农业导刊,2(21):14-17. [Jiang C S,Zhu H H,Zhong Y L,Liu M X,Dong F. 2022. Optimization of PCR reaction system of corn by orthogonal test and single factor double test[J]. Journal of Smart Agriculture,2(21):14-17.]doi:10.20028/j.zhnydk.2022.21.005.
李娜,张存旭,崔晓燕,蒋鸿刚,郭乐,刘伟. 2014. 栓皮栎ISSR反应体系的建立[J]. 北方园艺,(13):93-97. [Li N,Zhang C X,Cui X Y,Jiang H G,Guo L,Liu W. 2014. Establishment of ISSR reaction system in Quercus variabilis[J]. Northern Horticulture(13):93-97.]
刘新梅,梁慧珍,许兰杰,余永亮,杨红旗,谭政委,董薇,李磊,肖爱利. 2022. 红花SCoT-PCR反应体系的建立与优化[J]. 分子植物育种,20(3):895-901. [Liu X M,Liang H Z,Xu L J,Yu Y L,Yang H Q,Tan Z W,Dong W,Li L,Xiao A L. 2022. Establishment and optimization of SCoT-PCR amplification system in safflower[J]. Molecular Plant Breeding,20(3):895-901.] doi:10.13271/j.mpb.020.000895.
龙治坚,范理璋,徐刚,胡尚连,韩国辉. 2015. SCoT分子标记在植物研究中的应用进展[J]. 植物遗传资源学报,16(2):336-343. [Long Z J,Fan L Z,Xu G,Hu S L,Han G H. 2015. Application advance of SCoT molecular markers in plants[J]. Journal of Plant Genetic Resources,16(2):336-343.] doi:10.13430/j.cnki.jpgr.2015.02.019.
婁永峰,宋晓琛,冷春晖,陈兴彬,朱新传,肖复明. 2021. 陈山红心杉SCoT反应体系建立及引物筛选[J]. 南方林业科学,49(4):1-4. [Lou Y F,Song X C,Leng C H,Chen X B,Zhu X C,Xiao F M. 2021. Establishment and optimization of SCoT-PCR reaction system and selection of primers for red-heart Cunninghamia lanceolata[J]. South China Forestry Science,49(4):1-4.] doi:10.16259/j.cnki.36-1342/s.2021.04.001.
戚华沙,谢秋霞,林基忠,陈加利,王春梅,郑道君,王健. 2022. 海南油茶SCoT反应体系建立与多态性引物筛选[J/OL]. 分子植物育种. https://kns.cnki.net/kcms/detail/46.1068.S.20221009.1031.018.html. [Qi H S,Xie Q X,Lin J Z,Chen J L,Wang C M,Zheng D J,Wang J. 2022. Establishment of SCoT reaction system and screening of polymorphic primers for tea-oil Camellia resource in Hainan[J/OL]. Molecular Plant Breeding. https://kns.cnki.net/kcms/detail/46.1068.S.20221009.1031.018.html.]
尚小红,严华兵,曹升,肖亮,王艳,欧昆鹏. 2019. 广西地方葛根种质资源遗传多样性的SCoT分析[J]. 核农学报,33(7):1311-1317. [Shang X H,Yan H B,Cao S,Xiao L,Wang Y,Ou K P. 2019. Genetic diversity analysis of pue-raria in Guangxi based on SCoT markers[J]. Journal of Nuclear Agricultural Sciences,33(7):1311-1317.] doi:10.11869/j.issn.100-8551.2019.07.1311.
尚小红,严华兵,曹升,张尚文,谢向誉,王艳,欧昆鹏. 2018. 葛根SCoT-PCR反应体系优化及引物筛选[J]. 南方农业学报,49(1):1-7. [Shang X H,Yan H B,Cao S,Zhang S W,Xie X Y,Wang Y,Ou K P. 2018. Optimization of SCoT-PCR reaction system and primer selection for Puera-ria DC.[J]. Journal of Southern Agriculture,49(1):1-7.] doi:10.3969/j.issm.2095-1191.2018.01.01.
邵征绩,张璐,郑升,陈小军,刘华华,邝曦,龙治坚,韩国辉. 2021. 铁皮石斛SCoT-PCR反应体系的建立及其初步应用[J]. 分子植物育种,19(5):1606-1613. [Shao Z J,Zhang L,Zheng S,Chen X J,Liu H H,Kuang X,Long Z J,Han G H. 2021. Establishment and preliminary application of SCoT-PCR system of Dendrobium officinale Kimura et Migo[J]. Molecular Plant Breeding,19(5):1606-1613.] doi:10.13271/j.mpb.019.001606.
王俏君,李瑞,欧晓梅,何雪,李想,李名扬,眭顺照. 2018. 彩叶芋SCoT反应体系的建立与优化[J]. 分子植物育种,16(17):5675-5682. [Wang Q J,Li R,Ou X M,He X,Li X,Li M Y,Sui S Z. 2018. Optimization and establishment of scot reaction system in Caladium bicolor[J]. Molecular Plant Breeding,16(17):5675-5682.] doi:10. 13271/j.mpb.016.005675
王玉,赵兰勇,申宏伟,齐宇,石良红,吴迪. 2014. 玫瑰SCoT-PCR反应体系优化及引物筛选[J]. 北方园艺,(23):91-96. [Wang Y,Zhao L Y,Shen H W,Qi Y,Shi L H,Wu D. 2014. Optimization for SCoT-PCR system and primer selection of Rosa rugosa[J]. Northern Horticulture,(23):91-96.]
席秀利,黄海波,楼步青,詹若挺,王浩涵. 2018. SCoT分子标记对茶枝柑及近缘种遗传多态性分析[J]. 中草药,49(10):2426-2431. [Xi X L,Huang H B,Lou B Q,Zhan R T,Wang H H. 2018. Genetic polymorphism analysis of Citrus reticulata Blanco cv. Chachiensis tanaka and its relatives by SCoT molecular marker[J]. Chinese Traditional and Herbal Drugs,49(10):2426-2431.] doi: 10.75011.issn.0253-2670.2018.10.026
谢凤凤,李鹏,黎理,朱华,尚小红,李平凤. 2018. 广西产拳卷地钱DNA的SCoT-PCR引物筛选及反应体系优化[J]. 中国药房,29(10):1309-1312. [Xie F F,Li P,Li L,Zhu H,Shang X H,Li P F. 2018. SCoT-PCR primer selection and reaction system optimization of DNA of Marchantia convoluta in Guangxi[J]. China Pharmacy,29(10):1309-1312.] doi:10.6039/.issn.1001-0408.2018.10.04.
许琼明,刘艳丽,赵葆华,徐丽珍,杨世林,陈韶华. 2007. 瘤果紫玉盘中的酰胺类化学成分[J]. 药学学报,(4):405-407. [Xu Q M,Liu Y L,Zhao B H,Xu L Z,Yang S L,Chen S H. 2007. Amides from the stems of Uvaria kweichowensis[J]. Acta Pharmaceutica Sinica,(4):405-407.] doi:10.16438/j.0513-4870.2007.04.012.
許琼明,石峰,徐丽珍,杨世林,李国强. 2006. 瘤果紫玉盘叶中的黄酮类成分[J]. 沈阳药科大学学报,23(5):277-279. [Xu Q M,Shi F,Xu L Z,Yang S L,Li G Q. 2006. Studies on flavonoids in the leaves of Uvaria kweichowen-sis[J]. Journal of Shenyang Pharmaceutical University,23(5):277-279.] doi:10.3969/j.issn.1006-2858.2006. 05.005.
袁柳娇,余如凤,钟军弟,刘锴栋,黎海利,袁长春,陈燕. 2017. 红树植物木榄SCoT-PCR体系优化及遗传多样性分析[J]. 基因组学与应用生物学,36(1):352-361. [Yuan L J,Yu R F,Zhong J D,Liu K D,Li H L,Yuan C C,Chen Y. 2017. System optimization of SCoT-PCR and genetic diversity analysis of a mangrove plant:Bruguiera gymnorrhiza[J]. Genomics and Applied Biology,36(1):352-361.] doi: 10.13417/j.gab.036.000352.
袁王俊,马寅峰,董美芳,韩远记,张维瑞,尚富德. 2015. 桂花SCoT标记体系的建立及其在遗传多样性分析中的应用[J]. 园艺学报,42(3):569-575. [Yuan W J,Ma Y F,Dong M F,Han Y J,Zhang W R,Shang F D. 2015. Establishment and genetic diversity analysis of SCoT molecular marker system for Osmanthus fragrans[J]. Acta Horticulturae Sinica,42(3):569-575.] doi:10.16420/j.issn.0513-353x.2014-0575.
郑涛,蔡坤秀,杨俊杰,卢永春,陈振东,翁文. 2020. 基于SCoT标记血叶兰资源的亲缘关系分析[J]. 中草药,51(15):4011-4018. [Zheng T,Cai K X,Yang J J,Lu Y C,Chen Z D,Weng W. 2020. Relationship analysis for Ludisia discolor germplasm resources based on SCoT molecular marker[J]. Chinese Traditional and Herbal Drugs,51(15):4011-4018.] doi:10.7501j.issn.0253-2670.2020. 15.021.
Collard B C Y,Mackill D J. 2009. Start codon targeted (Scot) polymorphism:A simple,novel DNA marker technique for generating gene-targeted markers in plants[J]. Plant Molecular Biology Reporter,27(1):86-93. doi:10. 1007/s11105-008-0060-5.
Yi S,Jin W T,Yuan Y,Fang Y H. 2018. An optimized CTAB method for genomic DNA extraction from freshly-picked pinnae of fern,Adiantum capillus-veneris L.[J]. Bio-Protocol,8(13):e2906. doi:10.21769/BioProtoc.2906.
(責任编辑 陈 燕)
收稿日期:2022-12-01
基金项目:国家现代农业产业技术体系建设专项(CARS-21);广西重点研发计划项目(桂科AB21220042);广西特色作物试验站项目(桂TS2022002);广西水土保持学会重点领域创新项目(202009001)
通讯作者:张向军(1975-),https://orcid.org/0000-0002-2391-7423,副研究员,主要从事中药材栽培与选育研究工作,E-mail:158586707 @qq.com
第一作者:张尚文(1980-),https://orcid.org/0000-0002-8290-2950,主要从事特色药用植物种质资源开发与遗传改良研究工作,E-mail:63838114@qq.com
