胰腺神经内分泌肿瘤的非手术诊疗进展
2023-11-02张梓桐詹峰
张梓桐,詹峰
(1.南京医科大学无锡医学中心宜兴分中心,江苏 宜兴 214200;2.南京医科大学第一临床医学院,江苏 南京 210000;3.江苏省宜兴市人民医院 肝胆胰外科,江苏 宜兴 214200)
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,pNET)是一种起源于胰腺胰岛细胞的恶性肿瘤,是常见的神经内分泌肿瘤(neuroendocrine tumors,NET)类型。pNET在所有原发性胰腺肿瘤中仅占3%[1],但是随着诊断检验技术的进步,近年来诊断为pNET的人数明显增加。目前主要通过影像学辅助病理学来完成pNET的诊断。手术切除依然是目前根治肿瘤的唯一方式,其他常用的治疗方法包括化疗、肽受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)、免疫+靶向药物,但是治疗效果依然不如人意,因此亟需开发出更多新型治疗方式来提高患者的生存时间以及生存质量。本文将围绕pNET近年来诊断和非手术治疗方面的研究进展作一综述。
1 分 期
关于pNET的分期,现国际上有ENETS和AJCC 2017年第八版分期[2-3]。但是两种分期方法在临床上均出现了各种问题。对于ENETS分期:⑴ I期的风险比(hazard ratio,HR)和Ⅱ期相似,甚至在一些研究中还略高于Ⅱ期[4]。⑵ Rindi及其团队[5]指出,ENETS分类标准下的ⅢB患者的HR低于ⅢA(I期作为参考:ⅢA的HR为108.2,而IIIB阶段的HR为40.5)。在AJCC分期中Ⅲ期被定义为腹腔干或肠系膜上动脉肿瘤(不能切除的肿瘤)不伴有远处转移。然而,与胰腺癌相反,pNET往往不伴有腹腔或肠系膜血管的侵犯。Rindi等[5]使用多中心数据库分析显示,只有5.3%(48/903)患有AJCC Ⅲ期pNET。在大型单中心数据库分析中,只有4%(18/425)的pNET患者有AJCC Ⅲ期肿瘤。综合以上两种分期方式的不足之处,学者[2]提出了改良分期标准(mENETS)从而更加适应临床实践(表1)。
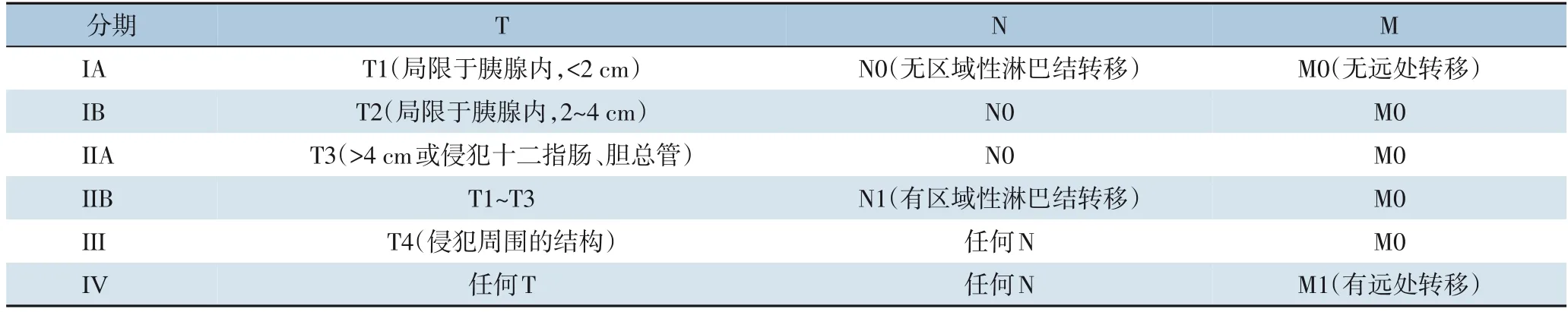
表1 mENETS分期Table 1 mENETS staging
2 诊 断
2.1 临床诊断
80%~90%的pNET患者早期无明显症状。出现明显不适选择就医时肿瘤多已经发生转移[6]。因此,早期诊断具有重要的意义。pNET分为功能性肿瘤(functional pancreatic neuroendocrine neoplasms,F-pNET)和非功能性肿瘤(non-functional pancreatic neuroendocrine neoplasms,NF-pNET)[3]。对于F-pNET,激素的分泌有助于早期诊断。NF-pNET患者多无症状,临床发现较晚,因此预后通常比F-pNET要差,表2列举了功能性F-pNET的临床诊断标准[3,7]。

表2 F-pNET诊断标准Table 2 Diagnostic standard ofF-pNETs
2.2 实验室诊断
生物标志物在肿瘤早期诊断中具有重要意义。嗜铬粒蛋白(chromogranin A,CgA)由神经元和神经内分泌细胞分泌,可用于诊断、判断预后以及术后复发监测。高浓度CgA常预示着不良预后,更高的复发率和肝转移率[3,8]。其敏感度和特异度分别为60%~100%和70%~100%[8]。然而肝硬化、胰腺炎和使用质子泵抑制剂后[9]可出现CgA的假阳性。因此不能仅靠CgA来诊断pNET[8]。神经元特异性烯醇化酶(neuron-specific enolase,NSE)是另一种生物标志物,虽然敏感度较低,但是CgA/NSE基线的抬高通常预示着较低的分化程度和更短的无进展生存期,可以作为治疗效果的预测指标[9]。此外,死亡结构域相关蛋白(death domain associate protein,DAXX)浓度的增加和哺乳动物雷帕霉素靶蛋白(mammalian target of repamycin,mTOR)通路的活跃也可能提示pNET的发生[10]。
一种mRNA基因组生物标志物(NETest)在pNET的诊断和预测治疗效果方面展现出较大的潜力[11],其准确度(96%~97%)远高于CgA,还可以避免CgA的假阳性。
2.3 影像学诊断
常用的影像学诊断方法有计算机断层扫描(computed tomography,CT)、磁共振(magnetic resonance image,MRI)、常规体表超声、超声内镜(endoscopic ultrasonography,EUS)、正电子发射计算机断层显像技术(positron emission tomography/computed tomography,PET/CT)[12]。
pNET诊断的首选影像学检查是增强CT扫描,可发现富血供病灶。虽然CT对pNET的诊断准确率可以达到80%,但是对弥散性的微小病灶,敏感度仍较差[8]。
MRI对体积较小肿瘤(直径<2 cm)的检出敏感度最高并且对pNET的淋巴结转移有一定预测价值。当联合使用肝胆特异对比剂可进一步提高对肝脏转移灶的检出率[13]。MRI典型影像学特征为胰管受到挤压变形而呈现“绕道征”[14]。
常规经体表超声检查不易发现pNET原发灶,但是对转移灶的诊断敏感度和特异度较高[15]。
EUS检查对较小肿瘤的诊断准确性较高[13]可以检测到直径0.5 cm的微小病灶,EUS对pNET检测的敏感度约为87%~97%,特异度约为98%[15]。EUS引导下的细针穿刺(EUS-FNA)可以获得病理学样本,为肿瘤的诊断提供直接证据。还可以详细评估肿瘤深度和其与周围组织的毗邻关系以及是否存在淋巴结转移[15],为能否手术及方案的选择提供指导。但是考虑到肿瘤的高度异质性,不同部位肿瘤细胞的分级会有不同,因此需要多次穿刺评估分级[16]。EUS还可以用于功能性pNET的治疗,可以通过局部注射细胞毒性药物来达到控制激素分泌过剩而出现的症状。
PET/CT:生长抑素受体(SSTR)家族有5大类,分别标序为1~5[17]。pNET高度表达SSTR2和SSTR5,这些受体可以特异性地以生长抑素肽类似物(DOTATOC/DOTATATE)为靶标,该类似物可以螯合到PET/CT的放射性同位素(如68Ga)上进行成像诊断,或者螯合到发射β射线的放射性同位素177Lu上用于治疗。目前用于放射性核素显像的放射性核素主要有68Ga-DOTA-TATE和18F-FDG。⑴68Ga-DOTA-TATE:大约有80%的pNET表面高度表达SSTR[18],68Ga-DOTA-TATE 对于生长抑素类似物(somatostatin analogue,SSA)受体具有高度亲和性,因此可以通过SSTR显像(somatostatin receptor imaging,SRI)显像,有较高的准确度。68Ga标记四氮杂环十二烷四乙酸肽类物质可用于未知原发性pNET检测,转移性pNET和pNET分期/再分期[19-20]。⑵18F-FDG:主要用于G3级的pNET,胰腺神经内分泌癌(pNEC),[68Ga]Ga-DOTA-SSA阴性的CT病变(有些pNET细胞表面不或者较少表达SSTR),以及快速进展的病例[20]。
2.4 病理学诊断
病理学诊断中Ki-67与核分裂象两项指标最具有参考价值,表3是世界卫生组织2017/2019版本关于pNET的分级。然而,Ki-67值和核分裂象不会总保持一致,此类情况一般采用分级较高的结果[21]。
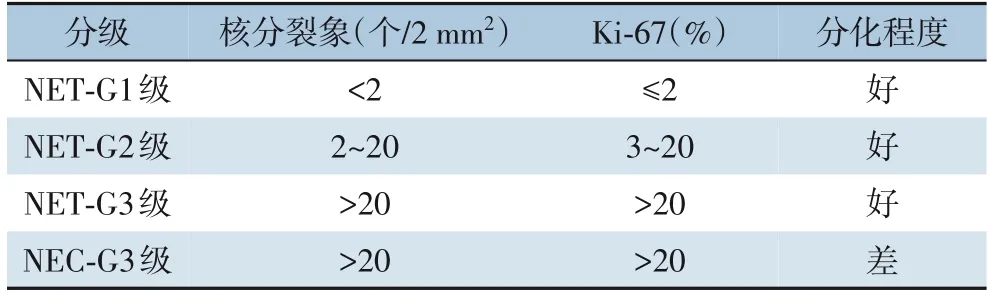
表3 世界卫生组织2017/2019版本分级Table 3 Classification of WHO 2017/2019 version
3 非手术治疗
3.1 分子靶向治疗
靶向治疗具有针对性强、对其他细胞伤害性小的特点。在pNET细胞中,血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR),血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)等表达上调,从而促进肿瘤生长。
舒尼替尼(sunitinib)和依维莫司(everolimus)分别是目前唯一被FDA和EMA批准用于治疗pNET的TKI和mTOR抑制剂。通常被用于SSTR阳性G1和G2级pNET继SSAs之后的二线治疗方案。两者对于G3级的pNET治疗有效性还需进一步验证,但通常不建议用于pNEC的治疗[22]。肿瘤细胞对于依维莫司耐药性的产生是限制其疗效的重要原因。有研究指出(NCT02294006)二甲双胍和SSAs可以克服耐药性的产生,联合使用或许可以提高治疗效果。
此外,索凡替尼(surufatinib)[23]已在国内注册用于pNET、胰外NET治疗。其对于甲状腺癌、胆管癌等一些其他实体瘤的作用仍在研究阶段。作为一种多靶点的药物,索凡替尼可以作用于VEGFR1、2、3,成纤维细胞生长因子受体1(fibroblast growth factor receptor,FGFR)和集落刺激因子1受体(colony stimulating factor-1 receptor,CSF-1R),这些赋予了其抗血管生成和抗肿瘤免疫逃逸的双重作用,有一项安慰剂作为对照的研究[24]表明,对于G2级以上的患者,索凡替尼可以延长无进展生存5.4个月。此外,一项针对进展期不可切除的胰外NET的双盲、多中心Ⅲ期临床试验(NCT02588170)[25]表明,在之前接受两种或两种以下全身治疗的患者中,接受索凡替尼和安慰剂治疗的患者中位无进展生存期分别是9.2个月vs.3.8个月。表4列举了一些临床上用于pNET的靶向药物[26]。

表4 临床上用于pNET的靶向药物Table 4 Targeted drugs clinically used for pNETs
目前,MET受体和CD47受到较多的关注[2]。MET原癌基因可导致PI3K和RAS/MEK通路的活化从而促进肿瘤增殖,CD47分子则和肿瘤细胞的免疫逃逸有关[22]。卡博替尼是一种治疗甲状腺髓样癌的多受体酪氨酸激酶抑制剂,可以选择性优先作用于MET受体;CD47阻断剂也被证明可以促进淋巴细胞对肿瘤的杀伤。抗CD47单抗和抗CD20药物利妥昔单抗已被证明可有效抑制非霍奇金淋巴瘤[27]。
受体介导的放射性核素治疗如PRRT通过使用[177Lu]177Lu-DOTATATE来达到局部治疗的效果。PRRT针对SSTR阳性的pNET患者,推荐用于G1、G2、G3级pNET继SSAs和化疗之后的三线治疗方案[11]。但是PRRT和依维莫司,舒尼替尼的治疗顺序选择存在较大争议,需要具体结合临床做出选择。此外,目前有初步实验证据表明,PRRT联合CAPTEM可以提高对肿瘤的疗效[28]。
3.2 生长抑素类似物(somatostatin analogues,SSAs)
SSAs的抗分泌作用可以用于治疗功能性pNET产生的激素综合征,SSAs联合PRRT可用于治疗PRRT之后出现的激素紊乱症状的控制[11];而抗增殖作用则可用于抑制肿瘤生长。SSAs是G1/G2、Ki-67<10%、生长抑素受体(SSTR)阳性和生长缓慢的pNET患者的一线治疗方案[11]。多数pNET患者体内都检测到SSTR的过表达,目前SSAs药物[29]如奥曲肽(octreotide)和兰瑞肽(lanreotide)已被用于进展期pNET的治疗[20]。
此外,为了进一步研究SSAs对Ki-67≥10%的pNET是否也发挥抗肿瘤效果,一项多中心回顾性研究[30]分析了Ki-67为10%~35%的高分化pNET接受一线长效SSAs治疗效果。他们观察到SSAs依然表现出了较高的抗增殖活性,但在具有高级别(G3)和肝肿瘤负荷>25%的pNET中效果有限。
此外,需要注意肿瘤细胞对生长抑素类似物耐药性的问题,一旦出现,将大大降低患者无进展生存期[31]。一些临床前研究观察到DNA甲基转移酶抑制剂和组蛋白去乙酰酶抑制剂可以上调pNET细胞系中SSTR2的表达,这可能是克服SSAs耐药性的一种选择,但临床研究缺乏进展需要进一步验证[32]。
3.3 免疫治疗
当下最常用的免疫检查点抑制剂(checkpoint inhibitor,CPI)靶点有细胞程序化死亡-配体1(programmed cell death-ligand 1,PD-L1),细胞程序化死亡受体1(programmed cell death 1,PD1)以及细胞毒性T淋巴细胞相关蛋白(CTLA-4)的抗体[33-34]。在高度分化且伴有肝转移的pNET细胞中,常会发现PD-L1的高度表达,表明PD-L1的表达可以有效帮助肿瘤细胞逃避免疫系统的调控[35]。
目前有关免疫治疗的联合治疗手段有3种:⑴ CPI的单药治疗;⑵ CPI的双重治疗;⑶ CPI和细胞毒治疗(CTX)的联合治疗。对于G1、G2级的肿瘤,一般CPI的单药治疗就可以得到理想的效果,但是对于晚期的pNET,第三种治疗方式效果最佳,但是不能忽视细胞毒性所带来的副作用[36]。表5和表6分别列举了处于临床试验阶段的单药治疗和CPI联合药物治疗方案。
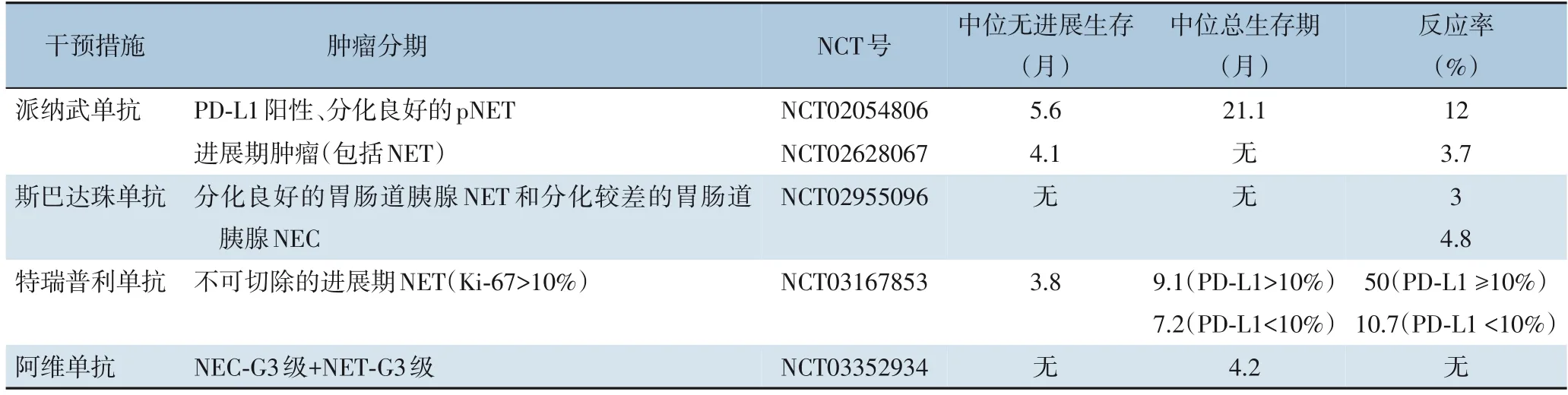
表5 处于临床试验阶段的单药治疗方案Table 5 Ongoing clinical trials of monotherapy

表6 处于临床试验阶段的CPI联合药物治疗方案Table 6 Ongoing clinical trails of CPIs combined with other drugs
抗血管生成药物通过抑制各种血管生成异常增生免疫过程来增强抗肿瘤免疫力[37]。因此,当与免疫治疗相结合时,抗血管生成药物可能产生更好的临床结果。此外,VEGFR家族中VEGFR2和VEGFR3分别与PD-1和PD-L1存在关联,这也是两类药物联合治疗的生物学基础。表7是一些处于临床试验阶段的ICIs+抗血管生成药物联合治疗方案[37]。

表7 处于临床试验阶段的CPI +抗血管生成药物联合治疗方案Table 7 Ongoing clinical trials of CPIs combined with antiangiogenic drugs
3.4 CAR-T治疗
鉴于SSTRs特异性表达于pNET细胞膜表面以及SSAs和放射性标记的SSAs在晚期pNET治疗中的效果,Mandriani及其团队[38]培育了直接靶向SSTRs的CAR-T细胞,包括与SSTR2和SSTR5有高度亲和力的两分子SSA奥曲肽以及共刺激分子CD28。他们将CAR-T细胞与过表达SSTR 1-5不同人NEN细胞系,即BON1,QGP1和CM共孵育。结果显示分别有58%、53%和42%的肿瘤细胞死亡。同时还评估了皮下移植抗SSRT的CAR-T在两种不同SSTR阳性pNET细胞系(BON1和CM)的小鼠治疗效果。小鼠被随机接受磷酸盐缓冲盐水,UTD T细胞,或抗SSTR的CAR-T细胞尾静脉注射。与用UTD T细胞或PBS处理的动物相比,抗SSTR的CAR-T细胞处理的小鼠显示肿瘤生长的减少[36]。
此外,积极寻找新的CAR-T细胞的作用靶点可以提高对pNET的杀伤作用[36]。为了达到这一目的,Feng及其团队[39]分离出一种可以选择性靶向CDH17—一个广泛存在于胃肠道和胰腺NET细胞膜表面的黏附蛋白的纳米抗体VHH1,其可以通过CDH17依赖的方式来实现对肿瘤细胞的杀伤。通过向NET小鼠体内注射含有CD28和4-1BB共刺激结构域的CDH17 CAR-T细胞,小鼠体内的肿瘤细胞明显减少,42 d后观察到了肿瘤的完全清除。值得一提的是,CDH17 CAR-T细胞并不杀伤表达CDH17的正常小肠细胞,这可能与CDH17仅定位于正常肠上皮细胞之间的紧密连接处无法被T细胞识别有关。
3.5 表观遗传药物
目前已上市的表观遗传药物主要分为两大类:组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)和DNA甲基转移酶抑制剂(DNA methyl transferase inhibitor,DNMTi),其中DNMTi包括:阿扎胞苷,地西他滨和瓜达西他滨,它们通过促进抑癌基因的表达从而使肿瘤细胞双链DNA断裂造成细胞凋亡。在体外试验中,阿扎胞苷对NET细胞系BON1,H727和CNDT2.5造成剂量依赖性的杀伤作用,地西他滨则使QGP1细胞体积缩小[40]。此外,体外研究[41]显示HDACi如曲古抑菌素A、丁酸钠、丙戊酸和恩替诺特对pNET细胞系呈现出剂量依赖性抑制细胞生长。一些研究胃肠道胰腺NET中的HDACi以及与mTOR抑制剂(依维莫司/埃米罗莫司)或抗PD-L1免疫疗法组合的其他临床试验正在进行。
对于上文所述对PRRT和SSAs治疗不敏感的患者,有研究[40]显示可能是由于siRNA对于SSTR表达的“沉默”作用有关,SSTR相关基因上游CpG岛的甲基化或许可以提高SSTR蛋白的表达从而为PRRT和SSAs治疗提供靶点,提高患者对治疗的敏感性。已有研究[42]表明,给予NET细胞系DNMTi药物5-氮杂-2-脱氧胞苷和HDACi可以明显提高SSTR的表达。
3.6 病毒疗法/溶瘤病毒
作为一种新兴的治疗方法,病毒疗法通过使用基因编辑的病毒靶向肿瘤细胞,在不对周围正常细胞造成杀伤的同时杀灭肿瘤细胞。一种溶瘤腺病毒Ad5(CgA-E1A-miR122)可以靶向pNET细胞从而在细胞体内繁殖并最终杀灭肿瘤细胞。为了提高病毒作用效率,Leja及其团队[43]将Phe-Trp-Lys-Thr环结合模体整合到Ad5纤维顶球中形成的Ad5fkFWKT可以靶向SSTR阳性pNET细胞。此外,一些DNA病毒如GLV-1 h68可以依赖于牛痘病毒从而达到杀灭肿瘤的效果[44]。
3.7 化疗
化疗对高级别、低分化、无法手术切除的肿瘤有着显著的作用。以铂类为主的化疗对于Ki-67>55%的患者有更好效果,对于化疗不敏感的患者可进行手术治疗。
对于G1、G2级pNET,推荐使用替莫唑胺单药或卡培他滨+替莫唑胺(CAPTEM方案)[24-45];亦可尝试以链脲霉素为基础的联合化疗方案[34]。对于G3级pNET,可尝试替莫唑胺联合铂类作为一线治疗方案[45]。此外,卡培他滨+替莫唑胺治疗Ki-67指数在10%~40%之间患者的效果最为理想[6]。对于伴有肝脏或者其他远处转移的pNECs而言,建议采用顺铂/卡铂+依托泊苷作为一线治疗方案[4,22]。
对于SSTR阴性的患者,由于SSAs和[177Lu]177Lu-DOTATATE治疗效果不佳,因此无论肿瘤分期,都推荐和G3级pNET一样的CAPTEM化疗方案联合依维莫司和舒尼替尼作为一线治疗方案[24]。
此外,不同G3级pNET患者对于基于铂类的化疗反应性存在较大差别。有研究发现,Rb基因缺失和K-ras基因突变的患者对于化疗的反应性明显增高,或许可以作为一种化疗疗效的预测因子[46]。同时,研究观察到替莫唑胺耐药性与PI3K/Akt/mTOR途径的激活有关,抑制PI3K/Akt/mTOR途径可以增强替莫唑胺对肿瘤细胞的杀灭作用[47]。
为了提高疗效,临床上通常会对联合两种或以上的方法进行治疗,以下是一些处于试验阶段的联合治疗方法[37](表8)。

表8 处于试验阶段的联合治疗方法Table 8 Ongoing clinical trials of combination therapy
4 总 结
目前对于pNET患者的治疗,可用于选择的治疗药物仍然较少,同时随着肿瘤细胞对一些药物耐药性的产生,如何选择有效的治疗措施也是一大难题。目前研究的主要方向主要有:⑴ 如何选择现有的药物进行联合治疗从而发挥药物的协同作用,降低肿瘤细胞对药物的耐药性同时尽可能减少药物联合所带来的毒性作用;⑵ 选择新的肿瘤治疗靶点开发新药物;⑶ 选择高敏感度的生物标志物来预测疗效并合理制定个性化治疗方案。这些问题的解决都需要未来医学工作者的不懈努力。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:张梓桐主要负责资料收集和论文的撰写;詹峰主要负责对论文内容修改和审校。
