胰腺神经内分泌肿瘤临床特征分析:附111例报告
2023-11-02刘娅贾妍黄伊林王婕王涵玥史宇薪陈廷寅彭杰
刘娅,贾妍,黄伊林,王婕,王涵玥,史宇薪,陈廷寅,彭杰
(中南大学湘雅医院 1.消化内科 2.网络信息中心,湖南 长沙 410008)
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,pNETs)作为第二常见的胰腺肿瘤,占所有胰腺肿瘤的10%[1-2]。pNETs可在各个年龄段发病,在我国发病率也呈逐年增长趋势。近年来CT和MRI等影像技术的进步,pNETs检出率也呈上升趋势[3-4]。随着对疾病认识的不断深入,2017年第8版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)肿瘤分期标准将pNETs分为I、Ⅱ、Ⅲ、Ⅳ期[5-6],根据有丝分裂指数或Ki-67指数WHO病理分类标准将其分为G1、G2、G3和NEC 4级[7]。pNETs可分为功能性pNETs(F-pNETs)和非功能性pNETs(NF-pNETs),F-pNETs具有分泌功能并释放过量激素,从而引起特定的内分泌综合征[8]。而NF-pNETs为隐匿起病的分化较差的肿瘤,多在筛查时发现或压迫邻近器官,初诊时多出现淋巴结/肝转移,预后差,不可切除比例高,5年生存率30%~40%[9]。pNETs具有高度异质性,故而不同临床分期的患者临床病理特征、治疗方式均不同,预后也存在较大差异[10]。pNETs治疗首选手术,对于F-pNETs多行手术治疗以控制症状,而NF-pNETs越来越多地采取非手术治疗。同时研究[11]表明,直径<2 cm的NF-pNETs适用于非手术治疗的主动监测。这就要求对pNETs精确诊断和分级。目前关于pNETs临床特征、CT表现和超声内镜(endoscopic ultrasonography,EUS)表现与pNETs分期、分级之间的关系报道较少,因此,本研究通过回顾性分析pNETs患者的临床资料,分析CT及EUS的基本特征,并探讨其与预后的相关性,为临床诊疗提供参考。
1 资料与方法
1.1 研究对象
本研究为回顾性研究,收集2016年1月1日—2023年5月1日中南大学湘雅医院确诊为pNETs患者的临床资料。纳入标准:⑴ 经手术切除或活检(穿刺或切检)病理确诊;⑵ 临床资料及病理资料完整;⑶ 术前在我院行CT及EUS检查,且图像质量符合诊断标准。排除标准:⑴ 其他部位神经内分泌肿瘤;⑵ 手术后或其他治疗后复发患者;⑶ 合并其他肿瘤患者;⑷ 混合性神经内分泌-非神经内分泌肿瘤。
1.2 研究内容
本研究收集pNETs患者的临床资料包括年龄、性别、肿瘤有无功能、WHO分级、AJCC分期、免疫组化标志物、肿瘤标志物,记录每例患者的病理资料。肿瘤定义为HE染色切片可见的典型神经内分泌肿瘤特征。CT表现包括肿瘤大小、部位、病灶形态、病灶边界、有无囊性变/坏死、远处转移及淋巴结转移。EUS表现包括回声强度、内部血流信号等。
1.3 分期分级标准
临床分期采用AJCC肿瘤分期标准对pNETs进行TNM分期,均由术前腹部CT平扫增强、MRI、PET-CT等影像学资料明确肿瘤[12]。综合分期分为I期(T1N0M0)、Ⅱ期(T2/T3N0M0)、Ⅲ期(T4N0M0/任何TN1M0)、Ⅳ期(任何T任何NM1)[5]。本研究将I、Ⅱ期划分为早中期,将Ⅲ、Ⅳ期划分为中晚期。病理分级采用WHO分类标准分为G1级(核分裂象数<2/mm2或Ki-67<3%)、G2级(核分裂象数:2~20/mm2或Ki-67:3%~20%)、G3级(分化程度高分化,核分裂象数>20/mm2或Ki-67>20%)、NEC(分化程度低分化,核分裂象数>20/mm2或Ki-67>20%)[7]。本文将G1、G2级划分为低级别组,G3级、NEC划分为高级别组。
1.4 检查方式
采用 Siemens Somatom Definition FLASH CT扫描仪,患者取仰卧位,均行常规平扫+双期增强平扫,扫描参数:管电压120 kV,管电流210 mA,层厚2 mm,层间距2 mm,螺距0.969,准直1.25 mm。采用高压注射器经肘正中静脉注射非离子对比剂碘海醇80 mL,注射速度为2.5~3.0 mL/s,分别于注射对比剂30 s和60 s行动脉期及静脉期扫描。采用GF-UE 260型EUS行超声内镜,于胃内、十二指肠内对胰腺头颈部、体尾部进行扫描,频率采用7.5/12 MHz。
1.5 图像分析
由2位中级及以上职称的腹部影像学/消化内镜诊断医师(未告知病理及其他检验检查结果)独立分析CT影像/EUS结果,意见不一致时由两位医师协商确定。分析内容包括:⑴ 肿块大小:测量病灶的长径和短径,当病灶为多发时取最大病灶分析并测量;⑵ 肿块部位:胰头颈、胰体尾及多发/弥漫;⑶ 肿块形态;规则/不规则;⑷ 肿块边界:清楚/不清楚;⑸ 囊变/坏死;⑹ 侵犯血管/胰周组织;⑺ 转移:淋巴转移/远处转移;⑻ 超声回声强度及内部血流信号。
1.6 统计学处理
采用SPSS 27.0进行统计学分析。服从正态分布的计量资料采用均数±标准差(±s)表示,组间比较采用独立样本t检验或方差分析;计数资料采用绝对值和百分比表示,采用χ2检验或Fisher确切概率检验进行组间比较分析。采用Kaplan-Meier法进行生存分析,Log-rank检验进行生存时间比较,Cox回归模型进行单因素及多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 pNETs患者的临床特征
本研究共纳入111例患者,男性53例,女性58例,平均年龄为(50.54±13.38)岁,按照病理分级,G1级40例(36.0%)、G2级33例(29.7%)、G3级9例(8.1%)、NEC 11例(10.0%)及因活检组织较少等原因未分级的患者为18例(16.2%)。其中50例(45.0%)患者为F-pNETs,主要表现为出现Whipple三联征、卓-艾综合征等激素改变症状。61例(55.0%)患者为体检时发现、出现压迫等症状的NF-pNETs。与NF-pNETs组比较,F-pNETs组女性发病率更高,为37例,病理分级低,病灶长径小,边界相对清楚,多以手术治疗为主(均P<0.05);而年龄组成、病灶位置两组之间差异无统计学意义(均P>0.05)(表1)。

表1 111例pNETs患者临床病理特征Table 1 Clinicopathologic characteristics of 111 patients with pNETs
2.2 pNETs不同AJCC分期的临床特征分析
根据AJCC分期,本研究分为早中期组和中晚期组,其中早中期组60例(54.1%),中晚期组51例(45.9%)。与早中期相比,中晚期患者男性占比更高,肿瘤以非功能性为主,病理分级NEC、G3级占比更高,手术根治性治疗机会少(均P<0.05)。Syn、Ki-67、CgA作为pNETs特征性免疫标志物阳性率高,但两组差异无统计学意义(P>0.05)。而在中晚期患者神经元特异性烯醇化酶(neuron specific enolase,NSE)阳性为20例(39.2%)、CA19-9阳性16例(31.4%)及CEA阳性9例(17.6%),与早中期患者相比阳性率明显升高差异有统计学意义(均P<0.05)(表2)。

表2 pNETs临床特征与AJCC分期的关系[n(%)]Table 2 Relationship between clinical features of pNETs and AJCC stage [n (%)]
2.3 pNETs不同病理分级CT特征分析
排除未分级pNETs患者(18例),共有93例患者纳入分析,其中低级别组73例(65.8%),高级别组20例(34.2%)。pNETs病灶长径<2 cm 38例(40.9%),2~4 cm 32例(34.4%),>4 cm 23例(24.7%),病灶主要以单个肿块分布于胰头颈/胰体尾部,多发/弥漫较少见仅5例,且两组在肿块长径和病灶分布位置差异无统计学意义(均P>0.05)。与低级别组比较,高级别组更易出现病灶形态不规则、边界欠清,并且并发淋巴结和远处转移,两组差异有统计学意义(均P<0.05)。而病灶囊性/坏死样改变、侵犯周围组织/血管的发生率,两组差异无统计学意义(均P>0.05)(表3)。
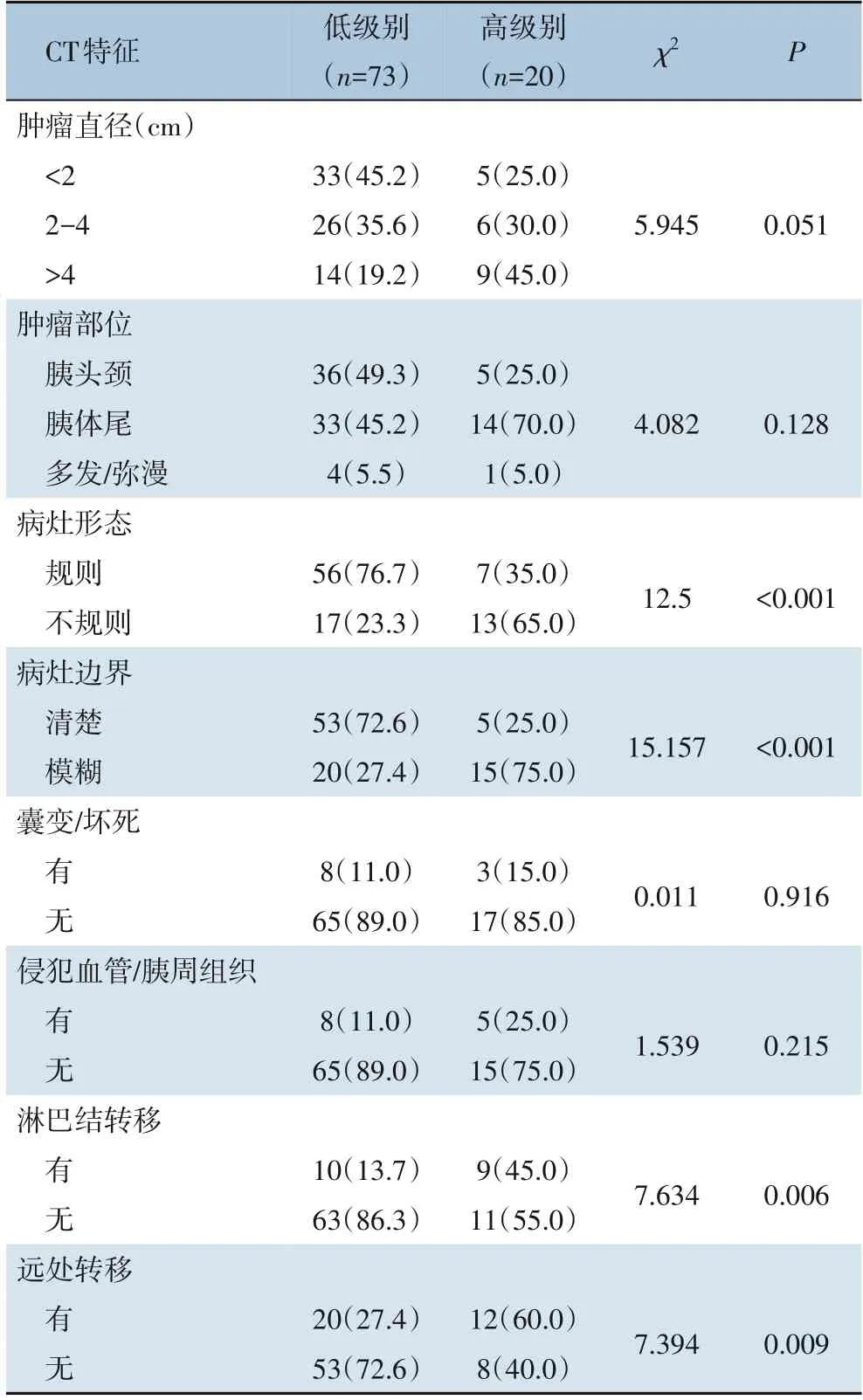
表3 CT特征与病理分级的关系[n(%)]Table 3 Relationship between CT features and pathological grade [n (%)]
2.4 pNETs不同病理分级EUS特征分析
行EUS的pNETs患者共24例,排除未分级pNETs患者(7例),共17例纳入分析。据不同病理分期分为低级别组14例和高级别组3例,其中高级别组病灶长径3例均>4 cm,而低级别组病灶长径多为2~4 cm(50%),差异具有统计学意义(P<0.05),对于肿瘤分布部位、病灶形态、边界、病灶内部回声强弱及血流信号强弱两组差异无统计学意义(均P>0.05)(表4)。据统计EUS检出率为21/24(87.5%),总体检出率略高于CT。共有20例患者行EUS-FNA,活检的阳性率为85.0%(17/20),对不同大小病灶的阳性率与CT的检出率相近。

表4 EUS特征与病理分级的关系[n(%)]Table 4 Relationship between EUS features and pathological grade [n (%)]
2.5 pNETs患者生存分析及预后相关因素分析
中位随访时间为37个月,回访率为78.37%。共87例患者纳入,其中G1期和G2期患者因存活率高于50%无法评估中位生存时间,高级别组患者中位生存时间为21个月。对纳入pNETs患者的临床特征及影像学表现行预后相关因素分析,Cox单因素分析发现,有无功能、年龄、病灶部位、病灶形态、NSE阳性、治疗方式、AJCC分期为影响pNETs患者死亡的危险因素(均P<0.05),而性别、病灶囊性变/坏死、病灶部位与患者预后无关(均P>0.05)。为了进一步分析预后的独立危险因素,将单因素分析筛选出的变量纳入多因素Cox回归模型,结果显示,治疗方式(手术vs.非手术:HR=0.232,95%CI=0.056~0.969,P=0.045)、病灶形态(不规则vs.规则:HR=7.038,95%CI=2.028~24.427,P=0.002)、NSE(阳性vs.阴性:HR=3.584,95%CI=1.029~12.481,P=0.045)为患者预后的独立危险因素(表5)。

表5 pNETs患者预后的Cox多因素分析Table 5 Cox multivariate analysis of prognostic factors in pNETs patients
3 讨 论
神经内分泌肿瘤以pNETs最常见,占胰腺肿瘤的10%,近年其发病率增长迅速[13-14]。pNETs是起源于神经内分泌细胞和肽能神经元的异质性肿瘤[15-16]。根据有无分泌激素的能力,pNETs可分为有功能的F-pNETs和无功能的NF-pNETs[11,17]。pNETs临床表现多样,可为病灶小的良性、生长缓慢且预后良好的惰性肿瘤,亦可表现为强侵袭性、广泛转移的恶性病变。既往研究[2]发现,NF-pNETs占总病变的50%~85%,本研究发现其占55%。NF-pNETs多无特异性症状,起病隐匿,随着影像学技术水平的提高,体检意识的增强,对于NF-pNETs(特别是<2 cm)的检出率明显增加[18]。
F-pNETs分泌特异性激素,随后出现相关症状,故而发现多早于NF-pNETs,并且肿瘤体积相对较小,肿瘤边界清楚,WHO分级以G1、G2等低级别为主,这与本研究结果一致,可能是由于NF-pNETs多隐匿起病,通常在疾病晚期因占位效应或转移相关症状就诊,导致病灶体积相对较大,疾病进展进而病灶边界模糊,WHO分级以高级别为主,从而恶变率高,预后欠佳[7,19-20]。本研究发现pNETs患者男女比例约为1∶1,女性患F-pNETs比例高于男性,这与既往研究结果男女发病率相似不一致,但在pNETs临床特征分析中发现,男性患者处于疾病中晚期概率更大,且既往研究也提示男性手术预后更差,术后复发及相应并发症的发生率更高[21-22]。
与既往研究一致的是,不同病理分级的pNETs在胰头、胰体、胰尾的发病率基本相当,且大多数为散发或孤立性病灶,与pNETs患者的临床预后无关[6,23]。约10%的pNETs与遗传综合征相关,主要由于MEN1、VHL、NF1和TSC2基因突变,表现为多发性病灶,且通常累及胰腺外器官[24]。在外周血生物标志物中,NSE在高分化组患者中明显升高,且其基线水平与pNETs患者预后相关,有助于在患者的诊断和随访中提供参考价值[13,25]。
在众多影像学检查中,CT和EUS对pNETs的诊断和分期至关重要[26-27]。根据不同WHO分级分析pNETs患者CT影像学特征,提示病灶形态不规则、边界欠清、淋巴结/远处转移具有区分低级别病灶和高级别病灶的潜力,这与Kim等[28]研究结果一致。同时在本研究多因素回归分析中,发现CT提示的病灶形态是影响患者预后的独立危险因素,这是由于病灶形态与病理分级相关,多提示肿瘤恶性程度高,向邻近组织浸润、侵犯,从而影响患者预后[23]。同时本研究针对不同病理分期分析pNETs的EUS特征,高级别组期患者肿瘤长径大于低级别组,余特征差异没有统计学意义。在本研究中CT对pNETs的检出率(85.6%)稍低于EUS(87.5%),与EUS-FNA的检出率相近,且随着病灶长径的增大,三者检出率明显升高。Sugimoto等[29]研究表明EUS对pNETs检出率特别是小病灶(<2 cm)明显高于CT,本研究与其结果不一致,考虑与样本量少,存在Ⅱ类错误有关。
随着靶向治疗和化疗等治疗方式的不断进展,治疗pNETs方式依据不同的病理分级、临床分期、功能状态而不同[30]。对于可切除高级别病灶,推荐手术切除和铂类化疗联合或不联合放疗,而可切除的低级别病灶的首选治疗方法是手术切除。对于检查发现的小pNETs(<1 cm),可考虑进行观察。如果低级别病灶出现局部复发或转移,推荐手术切除和靶向分子治疗(依维莫司或舒尼替尼)。如果高级别病灶存在转移,推荐铂类化疗[31]。诚然手术是pNETs治疗的首选方法,但低级别病灶与高级别病灶具有不同的生物侵袭性,因而常常有不同的治疗方式而被区别开来。本研究也提示NF-pNETs非手术治疗率明显高于F-pNETs患者,同时早中期患者也多采取手术根治治疗,且是否行手术治疗影响患者的预后,但尚缺乏各手术方式、治疗方式与预后之间的关系的研究[32]。
总之,pNETs是具有恶变潜能的、高度异质性的消化系统肿瘤。F-pNETs多以激素相关性症状为主诉表现,NF-pNETs临床表现多缺乏特异性。EUS检出率略高于CT,病灶形态不规则、边界欠清、转移有区分不同病理分级或临床分期的潜能。同时病灶不规则、选择非手术治疗、NSE阳性往往提示预后欠佳,但仍需进一步完善手术方式、化疗、靶向治疗等治疗方式对预后的影响,为临床诊疗提供参考。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:刘娅:研究设计,数据收集,数据分析,论文撰写;贾妍:数据收集,数据分析,论文评审;黄伊林:数据解释,论文评审,数据分析;王婕:数据收集,数据分析,论文编辑;王涵玥:数据分析,论文评审与编辑;史宇薪:论文编辑,实验验证;陈廷寅:实验设计,数据收集,论文撰写与评审;彭杰:实验设计,资金支持,监督,论文评审与编辑。
