基于LC-MS分析及网络药理学研究探讨多花黄精改善炎性疲劳的效应机制
2023-11-02刘涛嵇晶王令充程建明
刘涛, 嵇晶,2, 王令充,程建明,2
(1. 南京中医药大学药学院,江苏 南京 210023;2. 江苏省经典名方工程中心,江苏 南京 210023)
疲劳是连续性的体力劳动或脑力劳动后机体内所发生的一系列复杂生理生化变化过程。疲劳发生的机制复杂,目前尚不明确。现有观点认为,疲劳的发生是神经系统、免疫系统以及内分泌系统等多因素共同参与的结果[1]。疲劳发展过程中,免疫系统异常激活,体内多种炎症因子水平显著升高,并作用于中枢神经系统,诱导机体产生疲劳样症状[2]。研究表明炎症是导致慢性疲劳综合症的一个因素,慢性疲劳综合症是一种炎性有关的疲劳疾病。炎性疲劳(Inflammatory fatigue),也称炎症相关性疲劳,是指在有明显炎症相关的疾病中很常见,并伴有包括运动不耐受和运动后不适,疼痛的各种表现以及情感障碍等一系列其他症状的疲劳[3]。
黄精作为我国传统中药之一,是有名的药食同源物品[4],具有历史悠久的药用记载和确切的临床疗效。其味甘、性平,归脾、肺、肾经,具补气养阴、健脾、润肺、养胃补肾之功效,用于脾胃气虚,体倦乏力,胃阴不足,口干食少,肺虚燥咳,劳嗽咳血,精血不足,腰膝酸软,须发早白,内热消渴。长期以来,黄精被中医视为“长生不老药和延年益寿药”,临床和民间常将其用于疲劳及衰老相关疾病预治中[5-6]。多花黄精是药用黄精中的一个重要品种,因其分布范围广,种植量大,品质高而被研究领域与行业专家所重视,目前已被作为主要原料开发成各类型的大健康产品[7-8]。现代植物化学与药理学研究揭示多花黄精富含多糖、皂苷、甾体、黄酮等多种活性成分[9],具有抗疲劳、增强免疫力、降血糖、抗肿瘤、抗菌、抗氧化、抗炎等多种药理活性[10],但其发挥作用的物质基础与作用机理仍未彻底揭示。
网络药理学融合了生物信息学和药理学的方法,可系统地阐释中药及其化合物与疾病的相互关系,探究成分发挥作用的生物学机制[11]。本研究对多花黄精的小分子成分进行LC-MS鉴定,并结合数据库进行其抗炎性疲劳的网络药理学研究,通过测定RAW264.7细胞活力、NO释放量及炎症因子IL-6和TNF-α分泌水平,研究多花黄精的抗炎作用。
1 材料
1.1 药物与试剂
多花黄精药材(安徽亳州,批号:20220507)购于亳州市博耀保健食品有限公司,经南京中医药大学严辉教授鉴定为多花黄精药材饮片;甲醇、甲酸均为色谱纯,德国Merck公司产品;DMEM培养基(批号:WH0023X061)、PBS(批号:WH0022A161)、胎牛血清(批号:SA220415)购于武汉普诺赛生物科技有限公司;MTT试剂(批号:EZ7890C413)购于赛国生物科技有限责任公司;无水二甲基亚砜(DMSO)(批号:20211014)购于国药集团化学试剂有限公司;IL-6、TNF-α ELISA(批号:202307)试剂盒购于南京翼飞雪生物科技有限公司;NO检测试剂盒(批号:110922230302)购于碧云天生物技术公司;AB-8大孔树脂(批号:20221205)购于杭州市星如仪器设备公司。
1.2 仪器与设备
Triple Q-TOF 5600型质谱仪,美国AB SCIEX公司;ODS-3色谱柱(5 μm,4.6 mm×250 mm),日本岛津公司。
2 方法
2.1 多花黄精的LC-MS检测
2.1.1 样品前处理 取多花黄精干燥饮片100 g,粉碎,过4目筛,在50 ℃下烘5 h,以料液比1∶15加水浸泡3 h,100 ℃下煮沸提取2次,将药液减压浓缩至50 mL(密度约为1.05)。缓慢向其中加入95%乙醇至乙醇总含量为70%,置于4 ℃下沉淀过夜,过滤,滤液经AB-8大孔吸附树脂处理后,冷冻干燥得多花黄精提取物AB-HJ。取所制多花黄精提取物0.5 g,加50%甲醇10 mL使其完全溶解,使用0.22 μm有机滤膜过滤后,采用LC-TOF-MS检测分析其所含小分子植化成分。
2.1.2 色谱条件 ODS-3色谱柱(5 μm,4.6 mm×250 mm);流动相为甲醇(A)-0.2%甲酸溶液(B);柱温箱温度为30 ℃;进样量为10 μL;梯度洗脱程序为:0~15 min,10%~25%A;15~25 min,25%~45%A;25~40 min,45%~65%A;40~60 min,65%~100%A;60~75 min,100%A。
2.1.3 质谱条件 雾化器电压(GS1)55 psi,辅助加热器电压(GS2) 55 psi;气帘气(Curtain gas)40 psi;辅助加热器湿度(TEM)600 ℃;负离子:喷雾电压(IS)-4 500 eV,去簇电压(DP)-100 eV、碰撞电压(CE)-10 eV;正离子:喷雾电压(IS)5 500 eV,去簇电压(DP)100 eV、碰撞电压(CE)10 eV;质量数扫描范围m/z50~1500。
2.1.4 定性分析 通过Peakview软件分析得到多花黄精提取物总离子流图,根据化合物分子量、二级碎片信息,和相关文献进行对比,进行成分的结构鉴定。
2.2 多花黄精抗炎性疲劳的网络药理学分析
2.2.1 获取多花黄精的作用靶点和炎性疲劳疾病靶点 在中药系统药理学分析平台TCMSP上检索LC-MS检测到的成分靶点,同时结合Swiss target平台 (http://www.swisstargetprediction.ch/predict.php)进行靶点补充。利用UniProt数据库(https://www.uniprot.org/)对所收集的靶点进行蛋白靶标的检索,在检索结果中将筛选结果限定为“reviewed”和“Human”,对蛋白靶标进行基因名称的转换,获取多花黄精各成分的作用靶点信息。
运用Gene Cards数据库(https://www.genecards.org)以“Inflammatory fatigue”为关键词进行检索,获取炎性疲劳的相关生物靶点。
2.2.2 交集靶点的获取与成分-靶点网络图的构建 将多花黄精各成分检索到的靶点进行去重后和炎性疲劳的疾病靶点导入到韦恩在线平台(https://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,其交集靶点即为多花黄精治疗炎性疲劳的潜在靶点。
将交集靶点整理至表格,将数据导入至Cytoscape软件绘制成分-靶点网络图,并利用“Network analyser”功能对网络进行拓扑分析。其中每个节点(node)代表药物、疾病、活性成分或靶点蛋白,边(edge)代表节点间的相互作用,节点的度值(degree)代表与该节点连接边的数目, 即在该网络中的重要程度。
2.2.3 PPI蛋白互作网络分析 利用String平台(https://string-db.org/)构建多花黄精与炎性疲劳交叠靶点的PPI网络图,选择物种为“Homo sapines”进行检索,并用Cytoscape软件进行网络图的优化。
2.2.4 共有靶点GO富集分析及KEGG通路富集分析 将多花黄精和炎性疲劳交叠靶点信息导入至Metascape数据库 (https://metascape. org/),对关键靶蛋白分别进行生物过程(Biological process,BP)、细胞组成(Cellular component,CC)、分子功能(Molecular function,MF)的GO功能富集分析及 KEGG 通路富集分析。
2.3 多花黄精对LPS诱导RAW264.7促炎的影响
2.3.1 细胞毒性实验 取对数生长期的RAW264.7细胞,按1×105mL-1接种于96孔板中(100 μL·孔-1),置于37 ℃、5%CO2的培养箱中培养24 h后弃原有培养液,加入不同质量浓度分别为(25~1 600 μg·mL-1)的多花黄精提取物AB-HJ,同时设置调零组、空白对照组和1 μg·mL-1的LPS刺激对照组,每组设6个复孔,培养24 h后弃去培养液,每孔加入配好的MTT溶液100 μL,避光继续培养4 h,弃去上清,每孔加入150 μL DMSO,37 ℃振荡10 min待结晶物溶解后,用酶标仪490 nm处测定吸光度。
2.3.2 NO分泌水平 取对数生长期的RAW264.7细胞,按1×105mL-1,接种于96孔板中(100 μL·孔-1),置于37 ℃、5%CO2的培养箱中培养24 h后弃原有培养液,设置空白对照组、LPS刺激对照组、质量浓度分别为100、200、400 μg·mL-1的多花黄精提取物AB-HJ给药组,每组设6个复孔,药物作用于细胞2 h后,LPS组和给药组分别加入1 μg·mL-1的LPS溶液,空白对照组加入等量的DMEM培养液,继续培养22 h后收集细胞上清液,使用NO试剂盒(Griess法)检测细胞NO释放量。
2.3.3 炎症因子IL-6和TNF-α水平 取对数生长期的RAW264.7细胞,按1×105mL-1,接种于24孔板中(500 μL·孔-1),置于37 ℃、5%CO2的培养箱中培养24 h后弃原有培养液,设置空白对照组、LPS阳性对照组、质量浓度分别为100、200、400 μg·mL-1的多花黄精提取物AB-HJ给药组,每组设6个复孔,药物作用于细胞2 h后,LPS组和给药组分别加入1 μg·mL-1的LPS,空白对照组加入等量的DMEM,继续培养22 h后收集细胞上清液,使用TNF-α和IL-6试剂盒(ELISA原理)检测其TNF-α和IL-6的含量。

3 结果
3.1 多花黄精LC-MS检测成分
采用LC-TOF-MS对多花黄精化学成分定性分析,得到正、负离子总离子流图(图1)。使用peakview软件,根据化合物的一级、二级质谱信息,结合相关文献,从多花黄精饮片中共检测出62个化学成分(表1~2),包括皂苷、黄酮及生物碱等类,进行网络药理学研究。
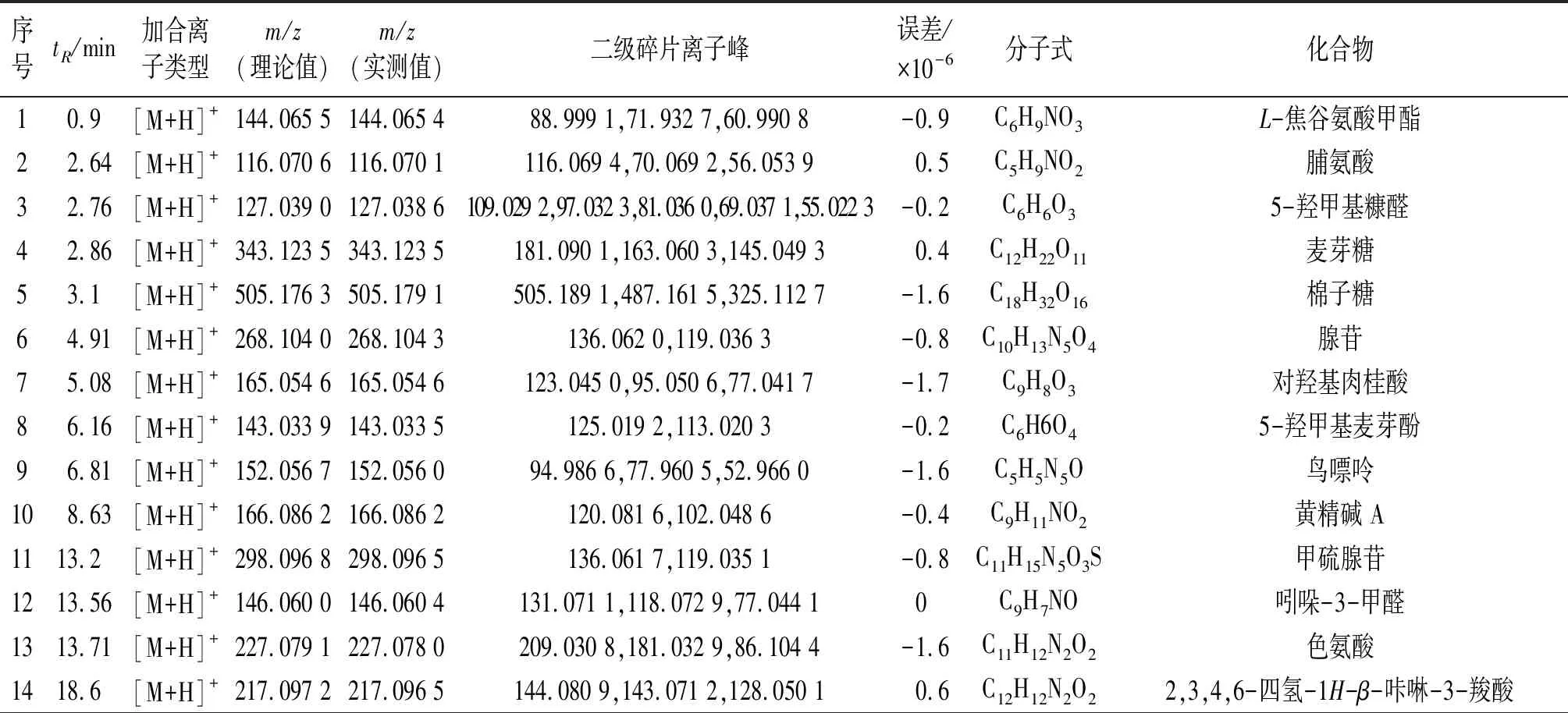
表1 LC-TOF-MS正离子模式下检测多花黄精小分子成分列表
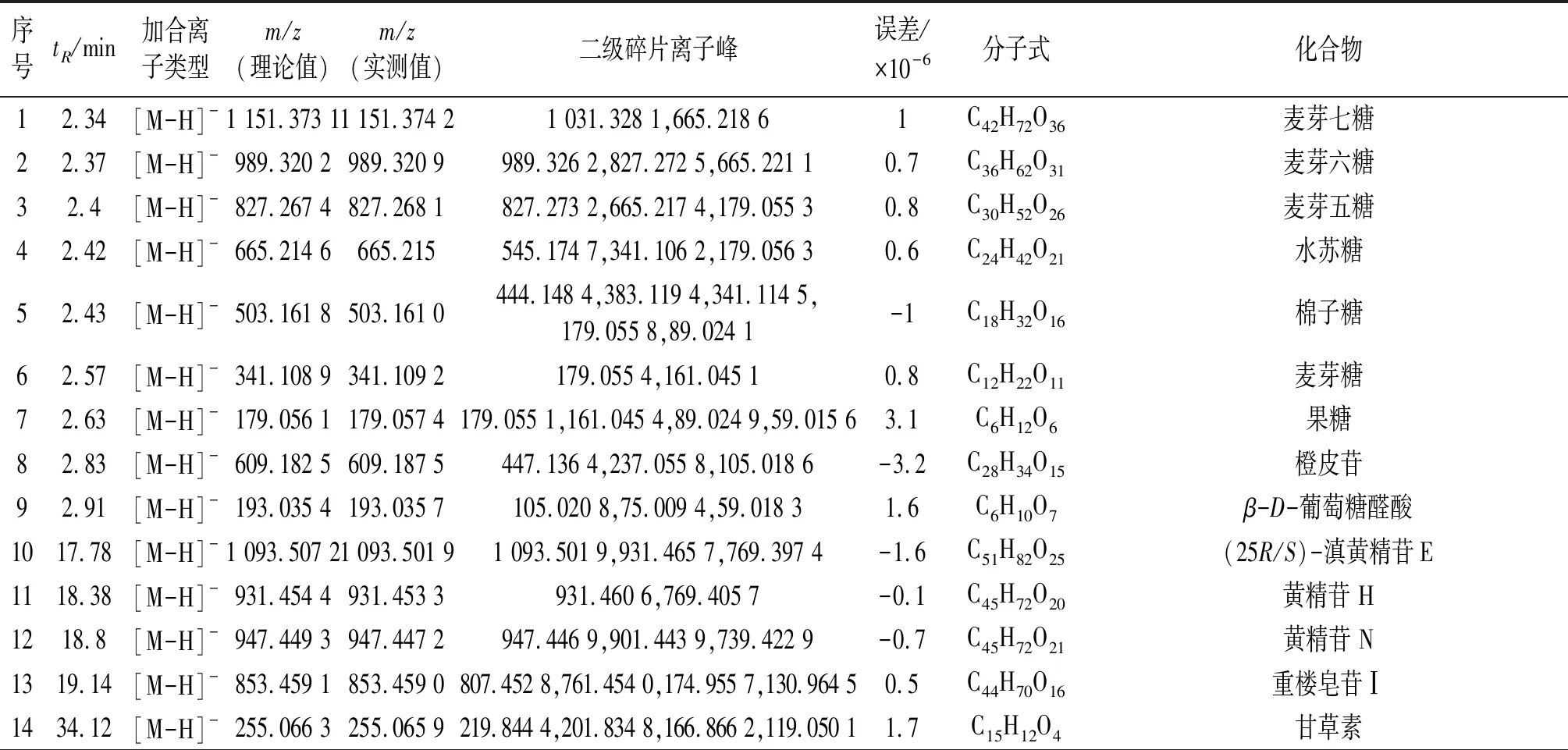
表2 LC-TOF-MS负离子模式下检测多花黄精小分子成分列表
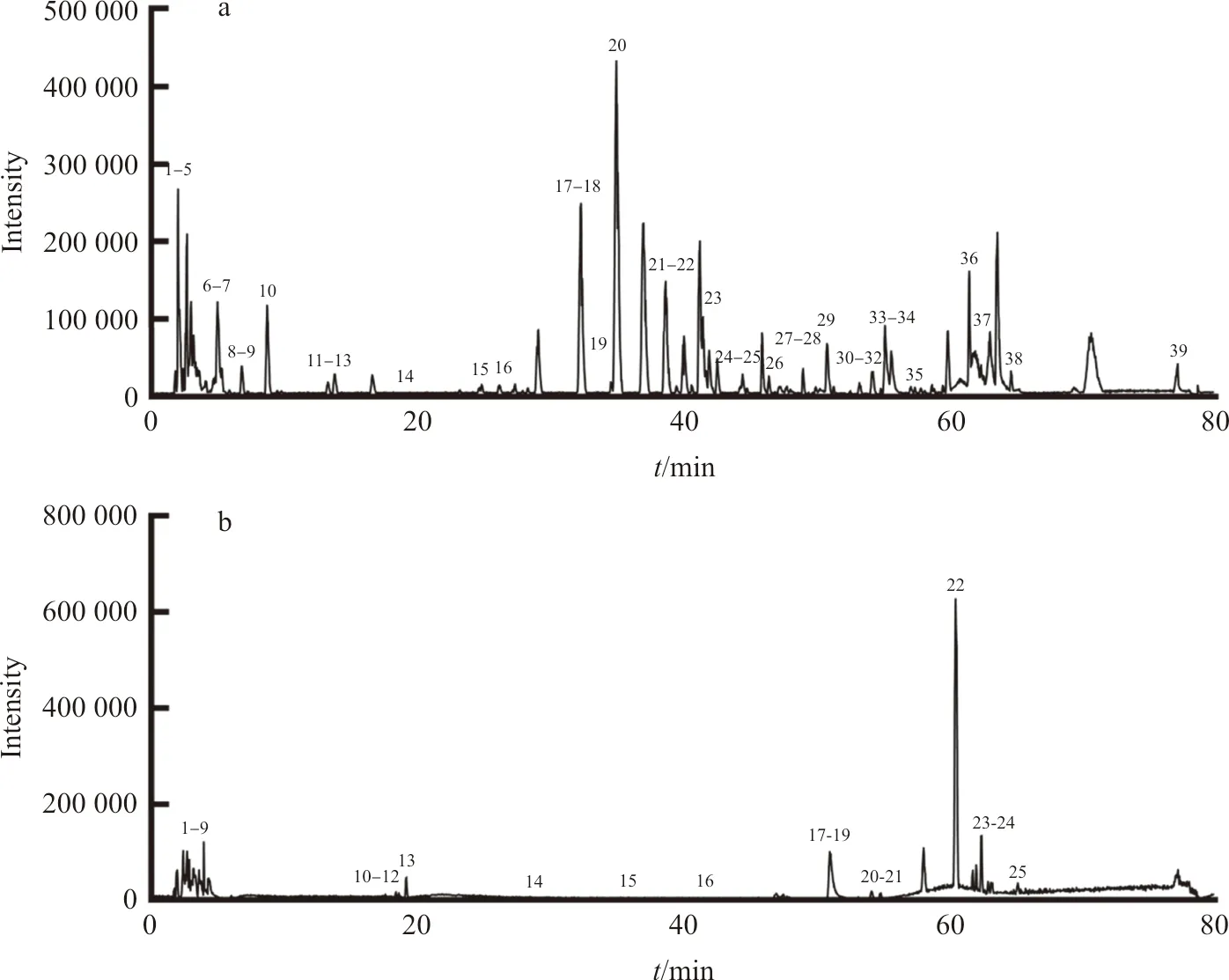
注:a.正离子模式;b.负离子模式
3.2 成分靶点的获取
通过TCMSP和Swiss Target平台收集上述各成分的有效靶点,去除无有效靶点的成分后,共得到552个有效靶点。
3.3 成分靶点与炎性疲劳的交集靶点的获取
使用Gene Cards数据库(筛选条件为Relevance score≥5)进行检索,共获取炎性疲劳的疾病靶点1 307个。使用Venny2.1在线绘图软件,输入多花黄精上述各成分作用靶点和炎性疲劳疾病靶点,从而获得多花黄精的成分作用靶点和炎性疲劳疾病靶点的交集靶点,绘制韦恩图(图2a),多花黄精的成分作用靶点和炎性疲劳疾病靶点的交集靶点有208个。
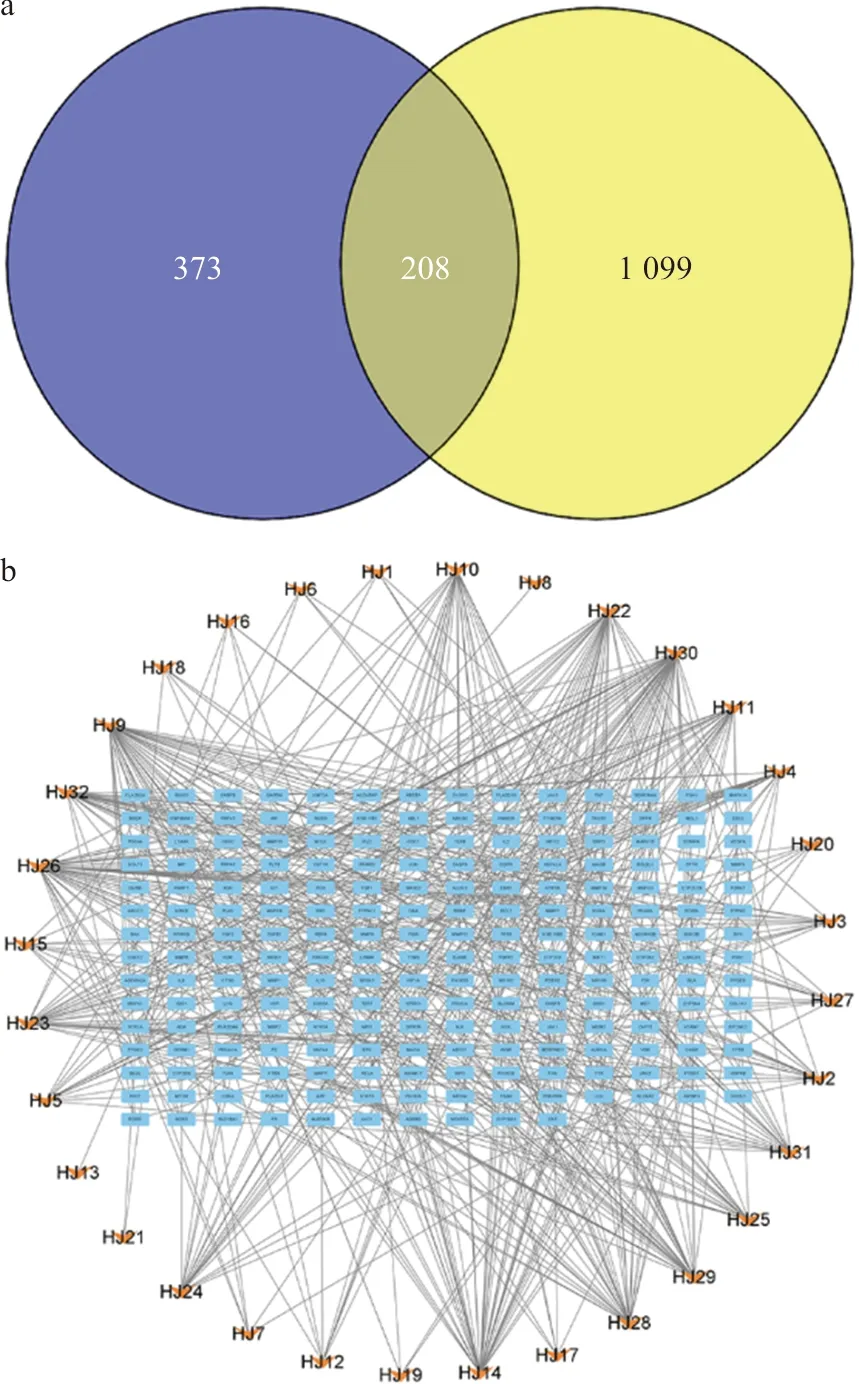
注: a.韦恩图;b.成分-交集靶点图
3.4 成分-靶点网络图
利用Cytoscape软件构建成分-靶点网络(图2b),该图由236个节点,589条边组成。通过分析网络,得到各节点度值,度值居前5位的分别是N-顺式阿魏酰酪胺衍生物,度值为48;β-谷甾醇,度值为44;11E-十八碳二烯酸,度值为40;β-D-葡萄糖醛酸,度值为35;甘草素,度值为34。多花黄精多个成分作用于多个靶点,体现多花黄精改善炎性疲劳的多靶点特征。
3.5 PPI蛋白互作网络分析
通过String平台进行分析,得到所有靶点的PPI蛋白互作网络图,其中节点为靶点蛋白,边为各蛋白间互作关系,选取度值排名前三十的靶点绘制PPI蛋白互作网络图(图3)。PPI网络图表明这些靶点是相互联系,且多方面协调作用改善炎性疲劳。节点连接边数越多的代表其在网络中越重要,通过网络拓扑学并结合文献分析,STAT3、MAPK3、AKT1、TP53、EGFR、CASP3、IL-6和TNF等靶点可能为多花黄精改善炎性疲劳的关键作用靶点。
3.6 共有靶点GO富集分析及KEGG通路富集分析
将药物-疾病交叠靶点导入Metascape数据库进行GO富集分析及KEGG通路富集分析。GO富集分析结果显示,208个交集靶点基因共涉及2 419条生物学过程(BP)、114条细胞学组分(CC)、235条分子生物学功能(MF)。按照P值分别取前10个条目绘制(图4a)。生物学过程(BP)主要涉及对激素的反应、细胞激活、防御反应调节、炎症反应和对外部刺激反应的正向调节等;细胞学组分(CC)主要涉及膜筏、膜微区、穴居、细胞质膜筏和晚期内质体等;分子生物学功能(MF)主要涉及蛋白激酶活性、磷酸转移酶活性、蛋白酪氨酸激酶活性、蛋白丝氨酸/苏氨酸激酶活性和核受体活性等。研究表明,脂多糖可以作用于宿主细胞细胞膜表面上的Toll样受体(TLR),进一步地激活相应的核因子κB(NF-κB)蛋白和丝裂原活化蛋白激酶(MAPK)信号通路,引起IL-1β、IL-6、TNF-α等炎症因子的释放,从而导致炎症反应,这和多花黄精中化学成分影响炎性疲劳的关键靶点相对应。
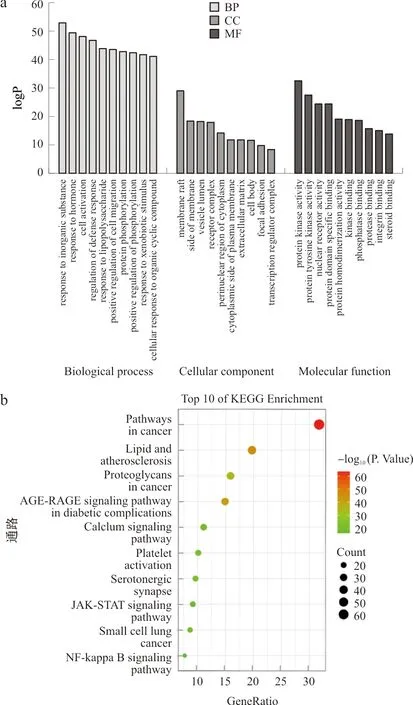
注:a.GO;b.KEGG
KEGG通路富集分析结果显示,208个交集靶点基因共涉及212条信号通路,按照P值分别取前10个条目绘制(图4b)。这些通路主要涉及癌症通路、血脂和动脉粥样硬化、糖尿病并发症中的AGE-RAGE信号通路、癌症中的蛋白聚糖、血小板活化、5-羟色胺能突触、钙信号通路、JAK-STAT信号通路和NF-κB通路等。
3.7 多花黄精缓解LPS诱导的RAW264.7细胞炎症
细胞毒性实验结果(图5)表明,多花黄精提取物浓度在25~1 600 μg·mL-1时对RAW264.7细胞活力无明显影响,考虑受试物浓度不宜过大,故在后续细胞实验中多花黄精提取物的浓度选择为100、200、400 μg·mL-1。
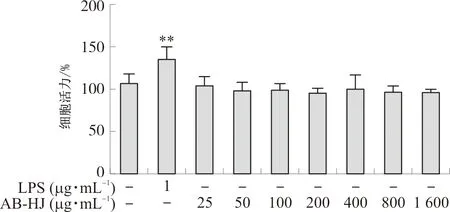
注:与对照组比较,
图6显示,多花黄精可降低促炎RAW264.7细胞中NO水平。与对照组比较,LPS诱导致使RAW264.7细胞中NO水平升高(P<0.01);而多花黄精提取物处理可降低NO水平(P<0.01),且具有一定的剂量依赖性。
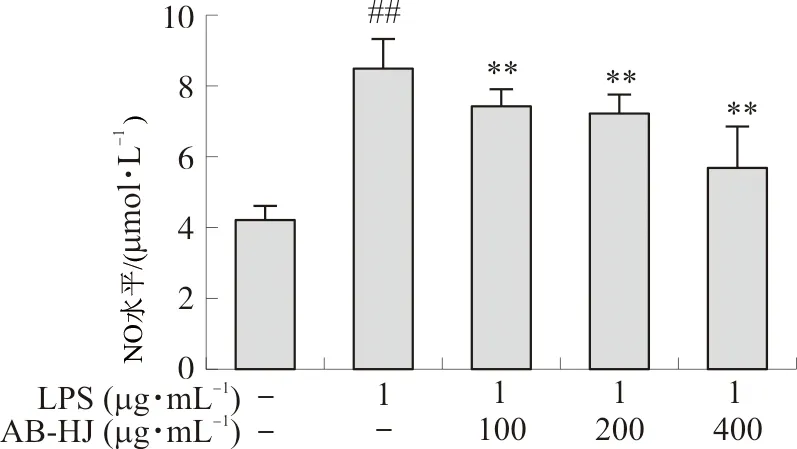
注:与对照组比较,##P<0.01;与LPS组比较,
图7a和图7b显示,多花黄精可抑制LPS诱导RAW264.7促炎细胞因子分泌。与空白组细胞相比,LPS组细胞中IL-6和TNF-α水平升高(P<0.01);与LPS组相比,多花黄精提取物各浓度组IL-6和TNF-α水平均降低(P<0.05,P<0.01),且具有一定的剂量依赖性。
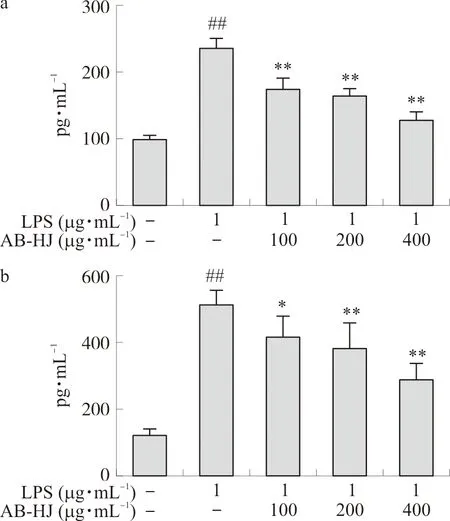
注:与对照组比较,##P<0.01;与LPS组比较,*P<0.05,**P<0.01。
4 讨论
本研究利用自行检测(LC-MS)成分开展多花黄精缓解炎性疲劳的网络药理学研究。由PPI获得关键靶点99个,其中富集程度较高的有STAT3、MAPK3、AKT1、JUN、TP53、EGFR、CASP3、IL-6、VEGFA、TNF等。慢性疲劳可能与细胞免疫和体液免疫以及机体代谢异常相关[12]。在巨噬细胞的炎症反应中,MAPK位于NF-κB的上游,抑制其磷酸化可以导致LPS诱导的RAW 264.7巨噬细胞中IκBα降解的减少,进而下调p65的激活[13],减少IL-6和TNF-α等促炎因子的释放,发挥抗炎作用[14]。
在KEGG富集的前十条通路中,多条通路与疲劳及炎症的发生发展有联系,研究证实5-羟色胺(5-HT)在中枢神经系统中参与疲劳的发生,5-羟色1B受体(5-HT1B)可通过自身受体调节5-HT的释放和异身受体调节Glu、GABA等神经递质的释放,进而影响神经元的兴奋性,在疲劳的调控中发挥重要作用[15]。JAK/STAT信号通路和NF-κB信号通路作为细胞因子信号通路之一,广泛参与各种疾病病理过程的调控,尤其是机体炎症反应的调控[16-17]。研究表明,IL-6、IFN、TNF-α等细胞因子可激活Janus激酶—信号传导子和转录激活子(JAK-STAT)信号通路,使STAT3发生磷酸化,加剧炎症反应[18]。同时磷酸化的STAT3还可以激活核转录因子NF-κB[19],促进TNF-α、IL-6、IL-1β等炎症因子的释放,促进炎症反应。
随后的体外实验表明,多花黄精提取物无细胞毒性,并可减少RAW264.7细胞NO释放及IL-6和TNF-α炎症因子的分泌,且具有一定的剂量依赖性。结合网络药理学的关键蛋白及通路分析,推测多花黄精提取物可能是通过抑制JAK-STAT及NF-κB信号通路发挥抗炎作用。
综上,多花黄精作为一种药食同源的植物,具有多种药效成分,多个作用靶点及多条通路的特征,可通过抑制巨噬细胞NO释放及IL-6和TNF-α等促炎因子的分泌发挥抗炎性疲劳作用,其机制可能是与抑制JAK-STAT及NF-κB信号通路有关,本研究为多花黄精的开发提供了一定依据。
