骨髓间充质干细胞移植治疗大鼠蛛网膜下腔出血后铁死亡的机制研究
2023-11-02田子玉杨宇航马艺瑞刘俊杰王一超李建民
田子玉, 杨宇航, 马艺瑞, 刘俊杰,2, 王一超, 李建民,2
(华北理工大学1临床医学院, 2附属医院神经外科, 河北 唐山 063000)
蛛网膜下腔出血(Subarachnoid hemorrhage,SAH)是脑卒中的一种重症亚型,病死率和致残率极高,预后不佳[1]。相关研究证明[2],SAH后的早期脑损伤与患者预后差密切相关,在SAH早期脑损伤中,铁死亡机制发挥重要作用,因此抗铁死亡治疗可作为SAH治疗的新靶点。铁死亡是一种铁依赖性非凋亡性的新型细胞损伤方式,主要特征表现在铁、脂质过氧化物含量的升高,谷胱甘肽(Glutathione,GSH)含量的降低[3]。此外,核转录E2相关因子2(Nuclear factor E2-related 2,Nrf2)/谷胱甘肽过氧化物酶4(Glutathioneperoxidase4,GPX4)信号通路是铁死亡激活的关键途径。Nrf2是推动GPX4基因转录[4-5]的重要因子,GPX4在调控铁死亡的过程中起着关键作用[6],Nrf2、GPX4在神经细胞发生铁死亡的过程中的表达水平及活性均降低,使细胞内脂质过氧化物的清除减少、聚集增多,从而加重了神经细胞的铁死亡。骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)移植能起到良好的神经保护和促进损伤修复作用。目前关于BMSCs移植治疗SAH后铁死亡机制的报道较少,故本实验基于Nrf2/GPX4通路观察BMSCs对大鼠SAH后铁死亡的治疗作用,以期为SAH的治疗提供理论依据。
1 材料与方法
1.1 实验动物选用Sprague-Dawley(SD)胚胎期3~5周龄雄性大鼠5只以及体重200~350 g的成年雌性大鼠100只,均购自北京维通利华实验动物科技有限公司,许可证编号为SCXK(京)2020-0004。饲养于华北理工大学动物实验中心,自由进食水,适应性喂养7 d。实验方案获得华北理工大学实验动物伦理委员会批准。
1.2 主要试剂与仪器Nrf2特异性抑制剂ML385(美国MedChemExpress公司,HY-100589);兔抗Nrf2多克隆抗体、兔抗GPX4多克隆抗体、普鲁士蓝染色试剂盒、组织铁含量检测试剂盒、丙二醛(Malondialdehyde,MDA)含量检测试剂盒、GSH含量检测试剂盒、GPX4活性检测试剂盒(北京索莱宝科技有限公司,货号:CLP0694、K003083P、G1428、BC4359、BC0021、BC1175、BC1194);鼠抗β-actin单克隆抗体(美国SANTA CRUZ公司,货号:sc-130345);IgG羊抗兔、IgG羊抗鼠单克隆抗体(美国KPL公司,货号:71-00-16、71-00-15);ECL显色试剂盒(北京博奥森生物技术有限公司,货号:C05-07004);OlympusBX53型光学显微镜(Olympus公司);Leica EG1150H型全自动石蜡包埋机、LeicaRM2235型切片机(LEICA公司)。
1.3 大鼠骨髓间充质干细胞原代分离与培养采用颈椎脱臼法处死3~5周龄SD雄性大鼠,分离大鼠的后肢胫骨和股骨,用1 mL注射器吸取添加了体积分数10%胎牛血清,1%青链霉素混合液的DMEM细胞培养基反复冲洗骨髓腔,1 000 r/min离心5 min后重悬于25 cm2培养瓶中,原代培养3 d后更换培养液,培养6~7 d后,细胞融合至80%~90%时用胰蛋白酶消化,按1∶3比例进行传代培养。传至第三代后,用流式细胞术鉴定细胞表型。
1.4 大鼠骨髓间充质干细胞的表型鉴定选择生长良好的第三代BMSCs,PBS轻轻冲洗3次后用0.25%胰蛋白酶对其进行消化,当细胞与瓶壁脱离时即终止消化;4℃离心(1 000 r/min)10 min,弃去上清;细胞用PBS洗涤3次,4℃离心(1 000 r/min)10 min;分别滴加荧光标记抗体PE-CD31,FITC-CD34,PE-CD44,PE-CD105,在室温下避光孵育30 min后,洗去多余抗体,加入200 μL PBS,用流式细胞仪进行检测分析。
1.5 动物模型的制备及干预参照Bederson等[7]的文献,通过血管穿刺法复制SAH大鼠模型。SD大鼠用1%戊巴比妥钠(50 mg/kg)通过腹腔注射进行麻醉,仰卧放置,在颈中央做切口,暴露出左侧颈内、外动脉及颈总动脉,并在颈外动脉的近心端做一切口。将一根锐化4-0手术缝合线的头端沿着颈外动脉的切口向颈内动脉方向轻轻逆行插入,在距离颈总动脉分叉18~19 mm处时有阻力感,需穿透动脉壁再送入5 mm深度,造成蛛网膜下腔出血。100只雌性SD大鼠中随机取出25只作为假手术组(Sham组)(不刺破大脑前动脉与大脑中动脉分支,仅在感到穿刺线受阻时退出)。剩余75只大鼠进行造模,造模成功判定标准:剥离脑部时肉眼可以见到极其显眼的血性液体散在分布在脑底基底池部位。75只大鼠均造模成功,随机分为蛛网膜下腔出血组(SAH组)、蛛网膜下腔出血+BMSCs移植组(BMSCs组)和蛛网膜下腔出血+BMSCs移植+Nrf2特异性抑制剂ML385干预组(ML385组),每组25只。造模成功后3 h,ML385组大鼠经尾静脉给予干细胞悬液2 mL,腹腔注射Nrf2特异性抑制剂ML385(30 mg/kg)[8];BMSCs组大鼠给予尾静脉注射干细胞悬液2 mL;Sham组和SAH组大鼠尾静脉注射对应等量生理盐水。
1.6 早期脑损伤指标的检测
1.6.1 神经功能学评分 参照Garcia等[9]的方法,对各组大鼠自主运动、四肢运动的对称性、前肢的伸展运动能力、攀爬能力、触须反应及四肢和躯体的本体感觉进行评价,得分越低,表明其神经系统功能损害越严重;得分越高,表明其神经系统功能损害程度越轻微。
1.6.2 脑组织含水量的测定 参照He等[10]的方法,麻醉后取出鼠脑,除去表面的血块和脑膜,将其分别放在一个锡箔上(已知该锡箔重量是a),测得质量是b,b-a代表湿质量,随后快速放置于烘箱24 h,直到衡重,称得质量为c,c-a代表干质量。以脑组织含水量的计算公式为依据:脑组织含水量=(湿质量-干质量)/湿质量×100%,可计算得出SAH后受损脑组织含水量。
1.7 标本处理颈椎脱臼法处死大鼠,取标本,腹腔注射10%水合氯醛麻醉,使用一次性采血针穿刺左心室尖部,使用眼科剪将右心室剪开,打开静脉窦,将300 mL冰生理盐水快速灌注入心脏,至肝脏颜色发白,表明灌注良好,随后立即去头,取脑,多聚甲醛固定,用蔗糖脱水,OCT包埋,冰冻切片机冷冻切片,收集切片备用。
1.8 细胞铁死亡指标的检测铁沉积情况用普鲁士蓝染色试剂进行检测,分光光度计法检测细胞铁死亡相关指标:(1)铁含量用组织铁试剂盒进行检测;(2)脂质过氧化物MDA的含量用脂质过氧化物试剂盒进行测定;(3)GSH的含量用GSH试剂盒检测;(4)GPX4活性用GPX4试剂盒检测,具体步骤参照厂家说明书。
1.9 Western blot法检测Nrf2和GPX4蛋白表达水平配胶,上样,电压60V电泳,待上层胶与下层胶交界处分离,溴酚蓝出现在其间时,将电压调至120 V恒压到底;切出合适面积的PVDF膜,切胶,将膜贴于胶上;转膜后在室温下用TBST配制的5%脱脂奶粉封闭2 h;孵育一抗、二抗;ECL显影。
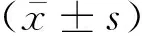
2 结果
2.1 大鼠骨髓间充质干细胞形态在原代培养3 d后可以看见BMSCs呈现放射状分布,细胞形状各不相同,培养6~7 d,在细胞融合度为80%~90%时消化传代,到了第三代可以看见细胞呈旋涡式生长,且细胞形态呈长梭形,见图1。
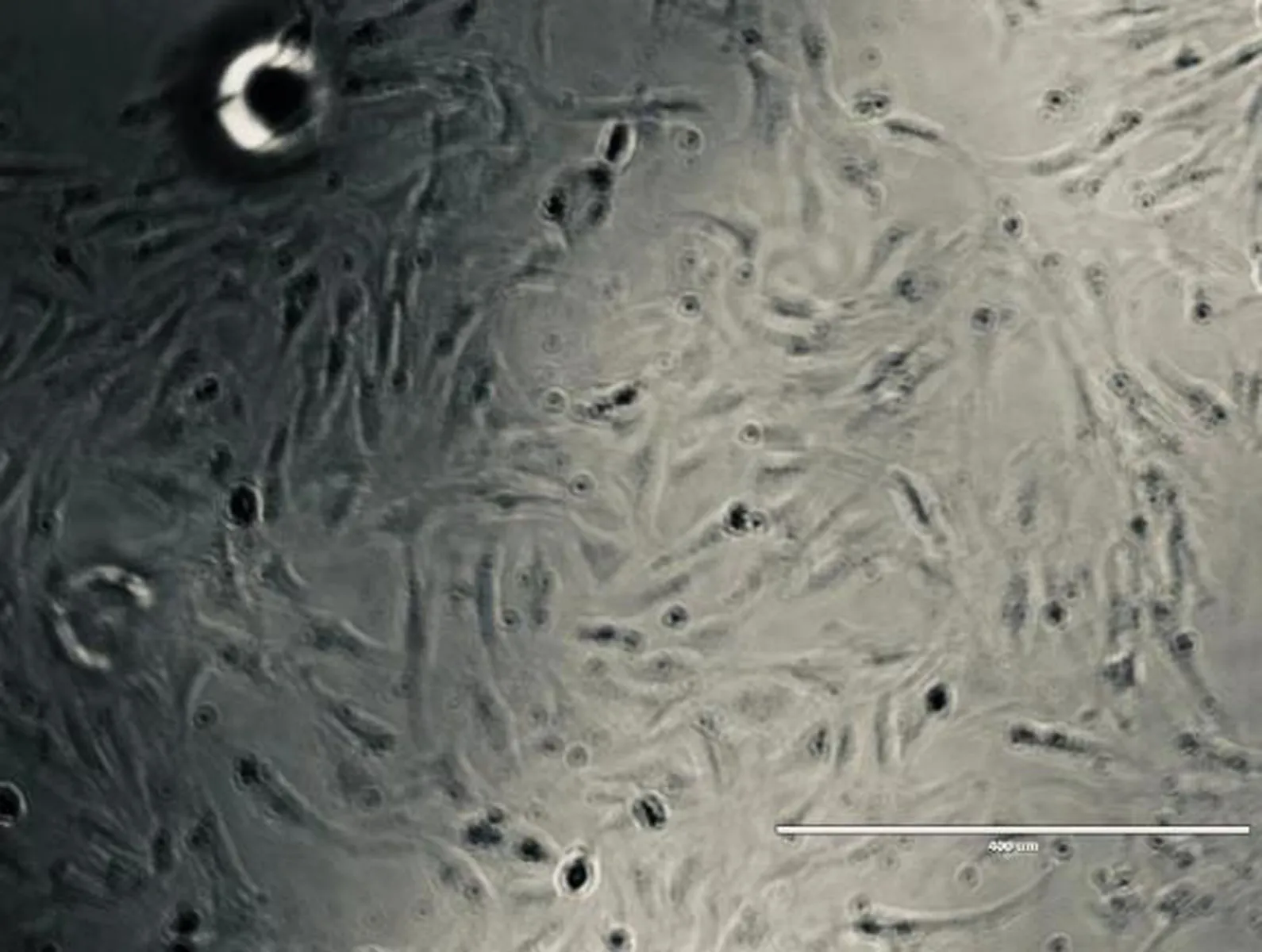
图1 第三代大鼠BMSCs的形态特征
2.2 大鼠骨髓间充质干细胞表型鉴定结果流式细胞术检测第三代大鼠骨髓间充质干细胞表面抗原CD31、CD34阳性率分别为0.7%和0.3%,呈阴性表达;CD44、CD105阳性率分别为100.0%和97.7%,呈阳性表达,见图2。
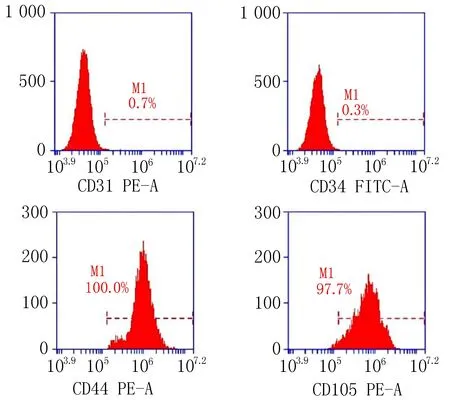
图2 大鼠BMSCs表面抗原流式细胞术检测结果
2.3 四组大鼠神经功能学评分比较造模3 d后,四组大鼠神经功能学评分差异具有统计学意义(P<0.001)。SAH组[(12.22±1.40)分]大鼠神经功能学评分较Sham组[(17.41±0.59)分]显著降低(P<0.05);BMSCs组[(15.57±1.59)分]大鼠神经功能学评分较SAH组显著增高(P<0.05);ML385组[(13.18±1.49)分]大鼠神经功能学评分较BMSCs组降低(P<0.05)。
2.4 四组大鼠脑组织含水量比较造模3 d后,四组大鼠脑组织含水量差异具有统计学意义(P<0.001)。SAH组[(81.4±0.6)%]大鼠脑组织含水量明显高于Sham组[(78.7±0.1)%]大鼠(P<0.05);BMSCs组[(79.2±0.1)%]大鼠脑组织含水量明显低于SAH组大鼠(P<0.05);ML385组[(80.7±0.2)%]大鼠脑组织含水量明显高于BMSCs组大鼠(P<0.05)。
2.5 BMSCs移植对SAH后铁死亡的影响造模3 d后,四组大鼠铁死亡相关指标差异具有统计学意义(P<0.001)。SAH组[(0.251±0.005)%]大鼠脑组织内铁沉积情况较Sham组[(0.014±0.008)%]大鼠明显加重,铁含量、MDA含量显著增多,GSH含量和GPX4活性显著降低(P<0.05);BMSCs组[(0.181±0.003)%]大鼠脑组织内铁沉积情况较SAH组明显减轻,铁含量、MDA含量明显减少,GSH含量和GPX4活性显著升高(P<0.05);与BMSCs组相比,ML385组[(0.231±0.006)%]大鼠脑组织内铁沉积情况加重,铁含量、MDA含量显著增多,GSH含量和GPX4活性显著降低(P<0.05),见图3、表1。
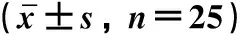
表1 各组大鼠脑组织内铁死亡相关指标的检测
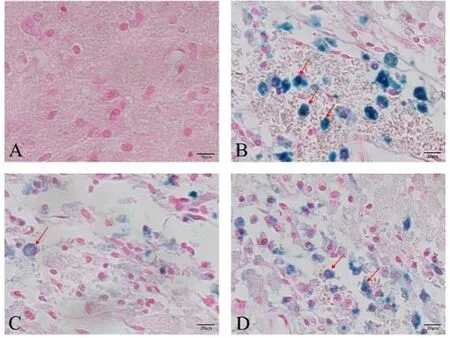
注:A,Sham组;B,SAH组;C,BMSCs组;D,ML385组。图3 大鼠脑组织内铁沉积情况(普鲁士蓝染色,标尺=20 μm)
2.6 BMSCs移植对Nrf2/GPX4信号通路的影响造模3 d后,Western blot结果显示,各组大鼠脑组织中Nrf2和GPX4蛋白表达水平差异具有统计学意义(P<0.001)。与Sham组[(0.747±0.015),(0.945±0.17)]相比,SAH组[(0.389±0.014),(0.328±0.023)]大鼠脑组织中Nrf2、GPX4表达水平显著减少(P<0.05);与SAH组相比,BMSCs组[(0.629±0.10),(0.826±0.017)]大鼠脑组织中Nrf2、 GPX4表达水平显著增多(P<0.05);与BMSCs组相比, ML385组[(0.419±0.017), (0.520±0.023)]大鼠脑组织中Nrf2、GPX4表达水平显著减少(P<0.05),见图4、5。
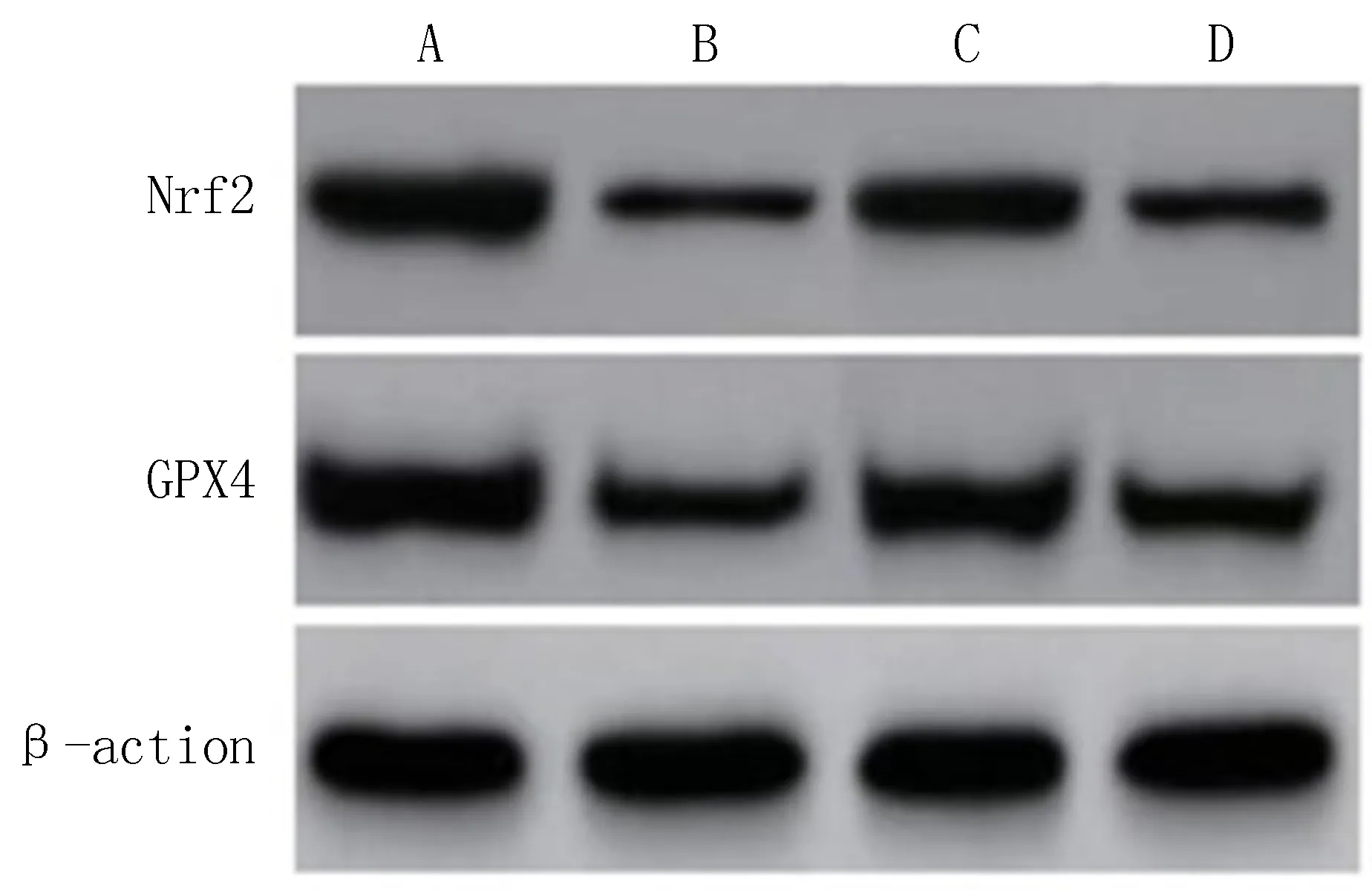
注: A, Sham组; B, SAH组; C, BMSCs组; D, ML385组。图4 各组大鼠受损脑组织中Nrf2和GPX4蛋白表达情况

注: 与Sham组相比, aP<0.05; 与SAH组相比, bP<0.05;与BMSCs组相比, cP<0.05。图5 各组大鼠受损脑组织中Nrf2、GPX4蛋白相对表达量比较
3 讨论
铁死亡是一种铁依赖性非凋亡性的细胞损伤方式,研究发现,SAH脑组织中存在铁死亡,且与铁代谢障碍[11]、线粒体功能障碍[12]和活性氧蓄积[13]等密切相关。因此,深入探索铁死亡与SAH后早期脑损伤的潜在联系,对SAH的诊疗具有十分重要的意义。
近年来随着细胞免疫治疗的发展,干细胞移植为有效治疗脑血管疾病提供了新的方向和方法[14]。BMSCs不仅可以通过分化成神经元来修复卒中后的脑组织,还可以通过分泌多种神经营养因子,使神经细胞凋亡减少,诱导血管生成和神经发生等,进而减少梗死面积和减轻血脑屏障破坏[15]。本研究结果发现BMSCs移植治疗后,神经功能学评分增高、脑组织含水量降低、铁含量降低,说明BMSCs移植能显著改善SAH大鼠脑组织的铁死亡,提示BMSCs移植在SAH治疗上是可行的。SAH后铁死亡的大鼠脑组织内谷胱甘肽的合成受到影响进而造成GPX4的活性受到抑制,后者的活性降低同样造成了细胞抗氧化能力下降,细胞内脂质活性氧生成和分解平衡紊乱,致使细胞膜脂质发生过氧化反应,最终导致细胞死亡[16-17]。本研究结果显示,大鼠发生SAH后,脑组织内的MDA含量升高、GSH含量降低,BMSCs移植可提高SAH后大鼠脑组织内GSH、GPX4的表达水平,提升细胞抗氧化能力,减少细胞内活性氧的积累,减少细胞膜中的过氧化,进而发挥对铁死亡的抑制作用。
Nrf2/GPX4信号通路在铁死亡过程中发挥重要作用,其是细胞抗氧化系统的重要组成部分[14]。GPX4是内源性抗氧化系统中的谷胱甘肽系统调节的核心酶,GPX4还是铁死亡的重要调控蛋白[6],当细胞内发生铁死亡时,GPX4的表达和活性都会降低,进而造成脂质过氧化物的清除降低,加重铁死亡[18]。Nrf2作为一种细胞内的转录因子,在多种疾病中对氧化应激损伤具有一定的保护作用[19],可增加GPX4的表达。本研究结果显示,SAH大鼠在BMSCs移植后,受损脑组织中的Nrf2和GPX4表达水平增加,铁含量明显减少,提示BMSCs对SAH后铁死亡的抑制作用与Nrf2/GPX4信号通路密切相关。本研究使用Nrf2/GPX4通路抑制剂后,大鼠脑组织中Nrf2、GPX4表达水平显著减少,铁含量显著增多,说明Nrf2/GPX4信号通路参与SAH后受损脑组织的铁死亡过程,BMSCs可通过调节此途径对SAH后受损脑组织起保护作用。
综上所述,本实验结果表明BMSCs可以有效改善SAH后神经功能损伤,并且可以显著减轻脑部水肿,减少铁沉积,其机制可能与BMSCs调节Nrf2/GPX4信号通路进而抑制铁死亡有关。本研究重点关注了BMSCs对Nrf2/GPX4信号通路的调节来抑制SAH后铁死亡,进而起神经保护作用,由于SAH后铁死亡发生的病理机制十分复杂,BMSCs是否还可以通过其他机制发挥作用,这值得后续研究进一步探讨。
