TMEM117调控TGF-β信号通路促进胃癌的作用及机制研究
2023-11-02李竞赵梓丹张辉
李竞,赵梓丹,张辉
(中南大学湘雅三医院 肝胆胰外科,湖南 长沙 410013)
胃癌(gastric cancer,GC)是世界上第五大常见癌症,也是因癌症导致死亡的第三大常见原因[1]。早期GC以内镜治疗为主,进展期GC治疗方法为手术为主的综合治疗,晚期GC主要采取化疗以及靶向治疗[2]。然而,GC的总体预后仍然不理想,因此,寻找GC潜在的治疗靶点迫在眉睫。
跨膜蛋白(transmembrane protein,TMEM)是一种跨越整个脂质双分子层的蛋白质,并永久锚定在膜上[3-4]。TMEM家族包含许多蛋白质,分布于细胞膜和各种细胞器膜[5],并且履行许多重要的生物学功能,如促进血管生成[6]、调节内质网应激[7-8]、维持线粒体功能[9-10]、蛋白质糖基化[11]、表皮角化[12]以及平滑肌收缩[13]等功能。
TMEM1117是TMEM家族中很重要的一员,在人体生理病理过程中发挥着重要的作用。有学者发现TMEM117参与低血糖的反应调节[13],另外有研究者发现敲低TMEM117可以预防血管紧张素Ⅱ诱导的心肌肥厚[14],此外TMEM117也参与了内质网应激的部分过程[15-16]。然而,TMEM117在癌症特别是GC中的表达以及作用尚不清楚。因此,本研究详细探讨了TMEM117在GC细胞中的功能及其机制,尝试为GC治疗提供新的靶点。
1 材料与方法
1.1 主要试剂与仪器
实验所用胃上皮细胞GES-1以及4种GC细胞AGS、SGC7901、MKN45、HGC27均来自上海细胞库(上海,中国),细胞使用培养基RPMI-1640购自Corning公司、10%胎牛血清购自Clark Bioscience,蛋白提取使用M-per蛋白裂解缓冲液购自Thermo Fisher,3个TMEM117敲低的siRNA以及1个过表达病毒均购自吉凯生物公司,CCK-8试剂盒以及EdU试剂盒购自碧云天公司,Transwell小室购自Corning公司。本实验所需一抗厂家来源:GAPDH(cat.#7074T;CST)、TMEM117(cat.#21314-1-AP;proteintech)、TGF-β(cat.#346599;正能)。LY2157299购自Proteintech公司。
1.2 实验方法
1.2.1 生物信息学分析 从TCGA(The Cancer Genome Atlas)网站(https://portal.gdc.cancer.gov)下载RNA测序数据集(RNA-seq)。从GTEx数据库(https://commonfund.nih.gov/GTEx)下载不同组织的基因表达数据,并与TCGA数据合并,用log2方法进行校正,利用Kruskal-Wall计算不同肿瘤中基因表达的差异。从GEO(Gene Expression Omnibus)下载的数据集(GSE13861、GSE66229、GSE26899、GSE26901、GSE66229)GC的正常和肿瘤组织的临床样本。使用R version 4.1.2筛选高TMEM117表达组与低TMEM117表达组之间的差异表达基因。人类蛋白质图谱(Human Protein Atlas,HPA)(https://www.proteinatlas.org)是一个整合各种组学技术,绘制细胞、组织和器官中人类蛋白质图谱的程序[17]。使用HPA数据库来说明TMEM117蛋白在正常和癌症组织中的分布。从Xena数据库(https://xena.ucsc.edu)下载TCGA数据库中恶性肿瘤患者的总生存期(OS)数据,进一步探讨基因表达与临床预后的关系。使用Kaplan-Meier法对下载的生存数据进行生存分析,采用“survival”和“survminer”包进行评价。
1.2.2 细胞培养 细胞使用RPMI-1640培养,同时向培养基中加入10%胎牛血清以及1%青霉素和1%链霉素,放入含有5% CO2的37 ℃恒温培养箱培养,当细胞生长至80%融合度时进行传代。细胞定期进行支原体检测以检测是否被污染。
1.2.3 qRT-PCR 使用TRIzol从GC细胞和组织中提取总RNA,随后进行反转录生成cDNA。使用SYBR Green(Toyobo)在热循环仪上进行实时聚合酶链反应。采用2-ΔΔCt法计算相对mRNA水平。GAPDH作为内源性对照。GAPDH正向:5'-ATC AAG AAG GTG GTG AAG CAG G-3',反向:5'-CGT CAA AGG TGG AGG AGT GG-3';TMEM117正向:5'-CCC TTC TTT GGT TTG CAT CAG G-3',反向:5'-TCC GAG TCT AGT TCG TAG GTG T-3'。
1.2.4 Western blot 在M-per蛋白裂解缓冲液加入磷酸酶和蛋白酶抑制剂取总蛋白质。配置分离胶后将相应蛋白加至相应小孔,通过变性SDS-PAGE分离细胞蛋白,然后把蛋白质转移到PVDF膜上,用5%脱脂牛奶封闭膜1 h后孵育一抗,4 ℃冰箱过夜。第2天用TBST洗涤PVDF膜后室温孵育二抗1 h,再次TBST洗涤,使用增强化学发光(ECL)对膜进行可视化,并使用Tanon-5200多平台成像,最后使用Image J软件对条带进行灰度值量化。
1.2.5 慢病毒转染 接种适量需要转染的细胞于12孔板,待第2天细胞贴壁后按照说明书(MOI=10)将过表达或者敲低慢病毒加入12孔板,同时加入助转剂进行转染,24 h后更换培养基,48 h后进行传代,待细胞贴壁后换成含有嘌呤霉素的培养基进行筛选感染成功的细胞,提取蛋白质检测转染效率。shRNA序列如下:GAT ATG ATG CTT CAA GACA、GCT ACT GGC CAT TCT CAT A、GGA TCA GCT GGG ACA AACT。
1.2.6 CCK-8实验 将转染后的细胞接种于96孔板(3 000个/孔),用CCK-8试剂盒检测细胞的增殖情况,每24 h检测1次,连续5 d,每孔加入100 μL CCK-8溶液,37 ℃孵育2 h。利用酶标仪在450 nm波长处测定吸光度。
1.2.7 EdU实验 将提前消毒好的爬片放入12孔板,接种适量细胞过夜。次日按照说明书配置好2X EdU工作液,并与培养基等体积混合后加入12孔板中37 ℃孵育2 h。去除培养基后加入4%多聚甲醛固定15 min,用含3%BSA的PBS洗涤后加入0.3% TritonX-100室温孵育15 min。洗涤后将提前配置好的Click反应液加入12孔板中孵育30 min,洗涤后加入Hoechst33342进行细胞核染色10 min,加入抗猝灭剂后用Leica microscope进行观察、拍照。
1.2.8 Transwell实验 接种适量对数生长期的细胞,第二天换成无血清培养基饥饿细胞24 h。将Matrigel胶稀释至工作浓度小心铺至Transwell小室上层,放入37 ℃培养箱静置5 h。计数细胞并将细胞浓度调整至8×105个/mL,上室内加入100 mL细胞悬液,下室内加入650 μL高血清培养基后置于培养箱培养。特定时间后取出小室,用4%多聚甲醛固定、0.1%结晶紫染色后使用徕卡显微镜观察并且拍照。
1.2.9 裸鼠皮下成瘤 SPF级BALB/C裸鼠,自然生长至4周龄。将裸鼠分为敲低组与对照组,每组各6只。将敲低TMEM1117的SGC7901细胞消化、使用PBS重悬后,左侧腋下注射敲低组裸鼠,每只注射5×106个细胞。对照组裸鼠按同样方式注射相同数量感染空白病毒的SGC7901细胞。裸鼠给予充足的食物和饮水,每隔3 d观察并且记录质量以及皮下成瘤体积,待质量明显下降或者瘤体直径超过1.5 cm处死。
1.3 统计学处理
所有统计分析均使用编程语言R 4.1.2或GraphPad Prism v.8.0进行。采用单因素生存分析计算风险比(hazard ratio,HR)和95%置信区间(confidence interval,CI)。采用Kaplan-Meier法分析患者的生存率。采用单因素方差分析进行多组间差异比较,两两之间差异进一步比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 TMEM117的泛癌表达分析
通过HPA数据库分析发现在人体正常组织中,TMEM117在十二指肠、结直肠等消化系统器官中表达最高,表达最低的为造血系统(图1A)。使用TCGA数据集分析了TMEM117在多种人类癌症组织中的表达,结果显示,TMEM117在12个肿瘤组织中高表达,其中表达差异最明显的肿瘤为结肠癌、肾癌、肝癌、胆管癌、GC以及肺癌(图1B)。TMEM117在不同肿瘤细胞系中的表达水平如图1C所示,表达较高的肿瘤细胞系为皮肤癌、食管癌、结直肠癌、GC、脑膜瘤等。
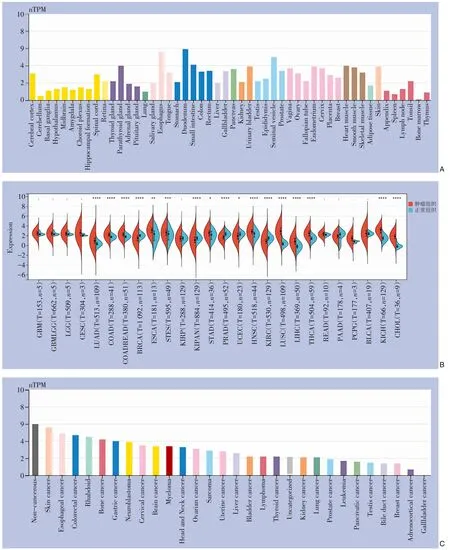
图1 TMEM117在泛癌组织中的差异表达分析 A:来自HPA数据库的人正常组织TMEM117蛋白表达谱;B:TMEM117在TCGA泛癌组织中的表达谱(蓝色代表正常组织,红色代表肿瘤组织);C:HPA数据库的泛癌细胞系TMEM117表达谱Figure 1 Differential expression analysis of TMEM117 in pan-cancer tissues A: Protein expression profile of TMEM117 in normal human tissues from the HPA database; B: Expression profile of TMEM117 in pan-cancer tissues from TCGA (blue representing normal tissues,red representing tumor tissues); C: Expression profile of TMEM117 in pan-cancer cell lines from the HPA database
2.2 TMEM117在GC细胞与组织中表达及其与预后的关系
通过对TCGA和GTEx数据库对TMEM117在GC中的表达进行分析,发现与正常组织相比,GC组织中TMEM117的表达明显升高(图2A)。随后提取正常胃上皮细胞(GES1)与4种GC细胞系(HGC27、SGC7901、AGS、MKN45)RNA进行qRTPCR验证,结果发现,与GES1比较,4种GC细胞系中TMEM117在RNA水平上表达均有不同程度的升高,其中HGC27细胞系中TMEM117升高最为明显(均P<0.05)(图2B)。与癌旁正常组织比较,GC组织中TMEM117在RNA水平表达呈上升趋势(P<0.05)(图2C)。Western blot检测TMEM117在GC细胞系中蛋白层面的表达,也得到了与qRTPCR相同的趋势(图2D)。以上结果表明TMEM117在GC细胞以及组织中表达上调。通过在TCGA数据库以及GEO数据库进行TMEM117的Kaplan-Meier法的生存分析,发现TMEM117的高表达与GC患者不良预后相关(均P<0.05)(图2E)。

图2 TMEM117在GC中的表达及其预后的关系 A:基于TCGA数据库通过生物信息学分析TMEM117在GC中的表达;B:qRT-PCR检测TMEM117在GES-1中与GC细胞中RNA水平的表达差异;C:qRT-PCR检测TMEM117在GC组织以及癌旁正常组织中在RNA水平的表达差异;D:Western blot检测TMEM117在GES-1中与GC细胞中蛋白水平的表达差异;E:基于TCGA与GEO数据库分析TMEM117与GC患者生存的关系Figure 2 Expression of TMEM117 in GC and its prognostic implications A: Bioinformatics analysis of TMEM117 expression in GC based on the TCGA database; B: qRT-PCR detection of RNA level differences in TMEM117 expression between GES-1 and GC cells; C: qRT-PCR detection of RNA level differences in TMEM117 expression between GC tissue and adjacent normal tissue; D: Western blot detection of protein level differences in TMEM117 expression between GES-1 and GC cells; E: Analysis of the relationship between TMEM117 and the survival of GC patients based on TCGA and GEO databases
2.3 敲低TMEM117对GC细胞的增殖、侵袭和迁移的影响
分别在HGC27与SGC7901两个细胞系中转染3个不同序列siRNA,并通过Western blot检测3个序列的转染效率,后续实验选择敲低效率相对较好的Sh-2、Sh-3进行(图3A)。首先通过CCK-8实验检测敲低TMEM117对HGC27、SGC7901细胞增殖能力的影响,结果表明,敲低TMEM117后GC细胞增殖能力降低(均P<0.05)(图3B)。后续EdU实验也发现敲低TMEM117后两个GC细胞系增殖细胞的比例明显减少(均P<0.05)(图3C)。通过Transwell实验检测敲低TMEM117对GC细胞侵袭和迁移的影响,发现在HGC27、SGC7901细胞中转染siRNA敲低TMEM117后,其侵袭和迁移能力均明显减弱(均P<0.05)(图3D)。
2.4 过表达TMEM117对GC细胞的增殖、侵袭和迁移的影响
为了进一步研究TMEM117在体外对GC细胞的影响,在AGS细胞中通过转染慢病毒过表达TMEM117,并且通过Western blot检测TMEM117的表达以确认在SGC7901细胞中成功过表达(图4A)。通过CCK-8实验检测TMEM117GC细胞增殖的影响,结果表明与对照组相比过表达TMEM117后AGS细胞的增殖能力明显增强(P<0.05)(图4B)。EdU增殖实验也表明过表达TMEM117后,AGS细胞增殖细胞占总细胞的比例明显增高(P<0.05)(图4C)。然后,通过Transwell实验检测了过表达TMEM117后对GC细胞侵袭和迁移的影响,结果表明过表达TMEM117可以明显提高AGSGC细胞的侵袭和迁移能力(均P<0.05)(图4D)。
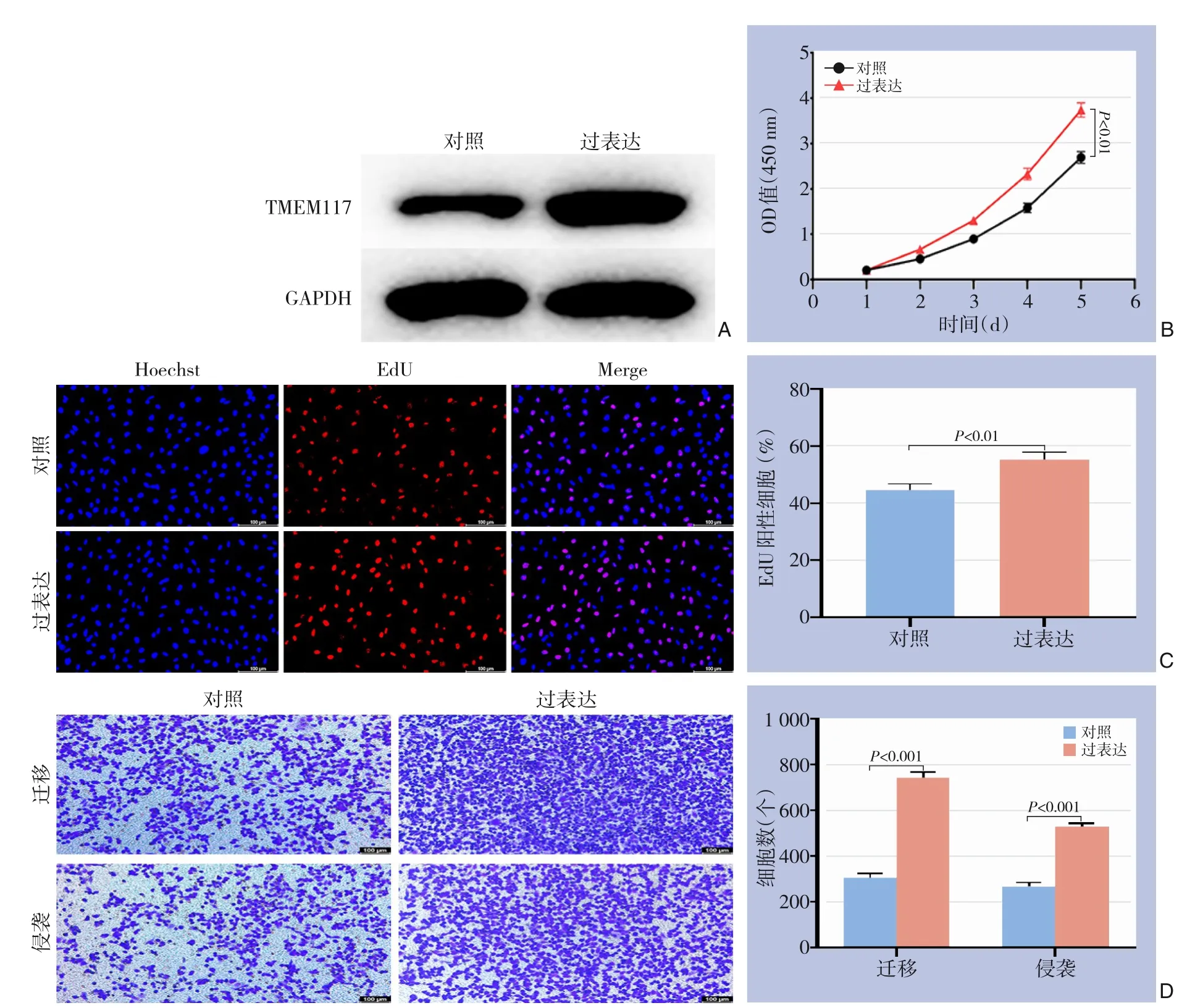
图4 过表达TMEM117对GC细胞增殖、侵袭和迁移能力的影响 A:Western blot检测在AGS细胞中TMEM117过表达效率;B:CCK-8实验检测过表达TMEM117后对AGS细胞增殖的影响;C:EdU实验检测过表达TMEM117后对AGS细胞增殖能力的影响;D:Transwell实验检测过表达TMEM117后对AGS细胞侵袭和迁移能力的影响Figure 4 Impact of TMEM117 overexpression on proliferation,invasion,and migration abilities in GC cells A: Western blot to assess the efficiency of TMEM117 overexpression in AGS cells; B: CCK-8 assay to evaluate the effect of TMEM117 overexpression on the proliferation of AGS cells; C: EdU assay to assess the impact of TMEM117 overexpression on the proliferation ability of AGS cells; D: Transwell assay to examine the effect of TMEM117 overexpression on the invasion and migration abilities of AGS cells
2.5 TMEM117与TGF-β信号通路的关系
以往研究表明TMEM家族与TGF-β信号通路联系密切,比如TMEM88能通过调节TGF-β影响成纤维细胞的细胞外基质表达[18],TMEM63C也与TGF-β密切相关[19]。在敲低与过表达TMEM117的GC细胞中通过Western blot检测TGF-β的蛋白表达水平,发现在敲低TMEM117的HGC27与SGC7901细胞中TGF-β的表达明显降低,而在过表达TMEM117的AGS细胞中出现了相反的情况(均P<0.05)(图5A)。用LY2157299(5 μmol/L)抑制GC细胞中TGF-β的水平并且检测效率(图5B),发现当在过表达TMEM117的AGS细胞系中加入TGF-β抑制剂LY2157299时,能部分抵消过表达TMEM117对AGS细胞系增殖能力的促进作用(图5C)。同样,LY2157299也能部分抵消过表达TMEM117对AGS细胞系侵袭和迁移能力的促进作用(图5D)。
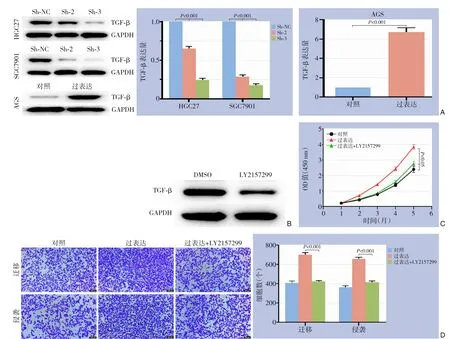
图5 TMEM117与TGF-β信号通路的关系分析 A:Western blot检测在GC细胞中敲低或过表达TMEM117后TGF-β的表达水平;B:Western blot检测LY2157299抑制TGF-β的效率;C:CCK-8实验检测加入LY2157299后对过表达TMEM117的AGS细胞增殖能力的影响;D:Transwell实验检测加入LY2157299后对过表达TMEM117的AGS细胞侵袭和迁移能力的影响Figure 5 Analysis of the relationship between TMEM117 and the TGF-β signaling pathway A: Western blot to assess the expression levels of TGF-β in GC cells after TMEM117 knockdown or overexpression; B: Western blot to evaluate the efficiency of LY2157299 in inhibiting TGF-β; C: CCK-8 assay to examine the effect of adding LY2157299 on the proliferation ability of AGS cells overexpressing TMEM117; D: Transwell assay to assess the impact of adding LY2157299 on the invasion and migration abilities of AGS cells overexpressing TMEM117
2.6 TMEM117对GC细胞体内成瘤的影响
用裸鼠成瘤实验进行体内验证,结果显示,TMEM117敲低组的瘤体大小明显小于对照组(图6A),肿瘤体积与质量均明显低于对照组(均P<0.05)(图6B)。
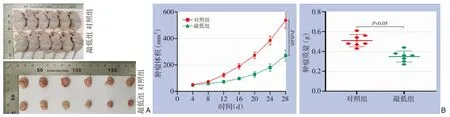
图6 裸鼠皮下成瘤实验 A:敲低组与对照组移植瘤大体形态比较;B:敲低组与对照组肿瘤体积与质量比较Figure 6 Subcutaneous tumor formation experiment in nude mice A: Comparison of the gross morphology of transplanted tumors between the knockdown group and the control group; B: Comparison of tumor volume and mass between the knockdown group and the control group
3 讨 论
尽管目前治疗GC的方法取得了一定的进展,但是进展期GC的病死率仍然较高[20-22],因此急需寻找新的GC治疗靶点。以往的研究表明TMEM跨膜蛋白家族在肿瘤进展中发挥着重要作用,如TMEM25、TMEM7等蛋白为肿瘤抑制因子[23-24],TMEM48、TMEM97为肿瘤促进因子[13,25-29],还有小部分跨膜蛋白如TMEM88参与肿瘤化学耐药性[30-33],而TMEM117在癌症中尚未见基础研究。在本研究中,通过检测TMEM117在GC中的表达、探索对TMEM117对GC细胞功能的影响以及机制,系统阐述了TMEM117对调节GC进展的影响。
本研究发现TMEM117在多种癌症中存在表达差异,然后将重点放在了TMEM117在GC中的作用研究。首先本研究检测了TMEM117在GC细胞以及组织中的表达,发现TMEM117在GC中明显高表达。同时发现TMEM117表达升高与GC患者不良预后密切相关,生存分析证明TMEM117在GC中具有较强的研究意义。
紧接着本研究探索TMEM117对GC细胞功能的影响。在HGC27和SGC7901细胞系中敲低TMEM117,通过CCK-8实验、EdU实验、Transwell实验证明敲低TMEM117可以抑制HGC27和SGC7901细胞系增殖、侵袭和迁移。同样地,在AGS细胞系中过表达TMEM117也发现了可以促进GC细胞增殖、侵袭和迁移。以上实验结果表明TMEM117对GC发展有促进作用。
然后,本研究通过实验证明发现TMEM117在GC中的作用机制与TGF-β相关。转化生长因子由TGF-β、激活素、节点、骨形态发生蛋白(BMP)、生长和分化因子(GDFs)以及其他因子组成[34-35],其在人体胚胎发育以及维持机体稳态发挥重要作用[36]。近年来研究者[37]发现TGF-β信号传导失调会导致免疫功能障碍、纤维化、癌症。TGF-β信号通路在肿瘤中具有双重作用,在不同的肿瘤微环境或者肿瘤不同的阶段可扮演肿瘤抑制因子或者肿瘤促进因子[34,38-39]。在本研究中,通过Western blot检测了过表达或者敲低TMEM117时的TGF-β表达水平,发现TGF-β与TMEM117呈正相关变化,表明TMEM117可以通过上调TGF-β表达水平来促进GC进展,随后本研究通过使用TGF-β抑制剂LY2157299明确TMEM117通过TGF-β发挥作用。最后通过裸鼠体内成瘤实验,本研究进一步证明TMEM117能够促进GC进展。
综上所述,本研究第一次系统地探讨了TMEM117在GC中的表达以及功能作用。结果表明,TMEM117在GC中高表达且预示着不良预后,TMEM117能够显著促进GC的增殖、侵袭和迁移。从机制上来讲,TMEM117可能通过调节TGF-β水平来促进GC进展。TMEM117有可能成为治疗GC的关键靶点,未来的研究应该侧重于靶向TMEM117对GC的疗效。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:李竞负责实验设计与实施、数据收集以及统计学分析、论文撰写,赵梓丹负责生物信息学分析,张辉负责技术和材料支持、指导实验、修改和审核论文。
