超声造影评估肝癌局部热消融疗效的价值及局部肿瘤进展的影响因素分析
2023-11-02薛改琴
张 慧 薛改琴
原发性肝癌是世界第5 位常见恶性肿瘤[1],外科手术是其根治性治疗的首选方法[2],但部分患者由于年龄大、肝功能储备不足、肝癌多中心发生等不能耐受手术治疗[3]。目前转移性肝癌的发病率逐年上升[4],其中符合手术条件者仅占20%[5],故寻找一种安全、有效的非手术治疗方式对改善患者预后有重要的意义。热消融以其操作简便、微创、疗效确切等优点,在非手术治疗中发展迅速[6-7]。临床常用增强磁共振成像(contrast-enhanced magnetic resonance imaging,CEMRI)或增强计算机体层成像(contrast-enhanced computed tomography,CECT)评估热消融疗效,但两种检查存在价格昂贵和造影剂具有肝、肾毒性等不足[8]。超声造影(contrast-enhanced ultrasound,CEUS)通过实时观察肿瘤的微血管灌注情况,在判断灭活范围及评估热消融疗效中均有良好的效能[8],且操作简便、快捷、安全、可重复性好。本研究旨在探讨CEUS 在肝癌局部热消融疗效评估中的应用价值,并分析局部肿瘤进展的影响因素。
资料与方法
一、研究对象
选取2019年6月至2022年5月于我院行超声引导下热消融治疗的92例肝癌患者(114个病灶),男63例,女29 例,年龄28~85 岁,平均(59.71±10.29)岁;其中射频消融治疗54 例,微波消融治疗38 例;肝功能分级Child-Pugh A 级87 例,B 级5 例。其中原发性肝癌35 例(38 个病灶),合并乙肝25 例、丙肝3 例,合并肝硬化25 例,甲胎蛋白1.44~1190.00 μg/L(甲胎蛋白阳性10 例);转移性肝癌57 例(76 个病灶),原发癌源于结肠17 例、直肠29 例、胃5 例、卵巢和食管各2 例、乳腺和胰腺各1 例。纳入标准:①所有患者术前均行2 种增强影像学检查(CEUS、CEMRI 或CECT)或经病理检查证实;②热消融治疗后随访3 个月及以上,随访期间无失访,且均行CEUS、CEMRI 或CECT 检查。排除标准:热消融治疗后未在我院随访,或随访期间失访。本研究经我院医学伦理委员会批准(伦审号:2023WJW03),所有患者及其家属均签署知情同意书。
二、仪器与方法
1.CEUS 检查:使用法国声科Aixplorer V、Philips EPIQ 7 彩色多普勒超声诊断仪,XC6-1、C5-1 探头,频率1.0~6.0 MHz;造影剂使用SonoVue(意大利Bracco公司),使用前加入5.0 ml生理盐水振荡混匀。患者取仰卧位或侧卧位,首先行常规超声观察肝脏内病灶位置、部位、大小、形态及边界等,选取病灶显示最佳切面,然后切换至造影模式,经外周静脉团注造影剂混悬液2.4 ml,随后迅速推注5.0 ml 生理盐水,实时观察病灶及其周围组织增强模式。以上操作均由同一具有10年以上CEUS检查经验的超声医师完成。
2.CEMRI和CECT检查:①CEMRI检查使用Philips Achieva 3.0 T、GE Discovery MR750w 3.0 T 磁共振成像仪,患者取仰卧位,序列采用T1WI、T2WI、DWI、增强扫描,其中增强扫描经外周静脉注射造影剂钆双胺注射液(欧乃影,GE 医疗集团,剂量0.2 mmol/kg,注射速率3 ml/s)或钆塞酸二钠注射液(普美显,拜耳医药保健有限公司,剂量0.025 mmol/kg,注射速率1~2 ml/s)。动脉期、门脉期、延迟期分别从注射20 s、60 s、2 min后开始扫描,肝胆特异期从注射20 min 后扫描(注射欧乃影无需扫描该期),由经验丰富的MRI 医师判断最终结果。②CECT 检查使用GE Discovery CT 750、西门子SOMATOM Force CT 成像仪,患者取仰卧位,行腹部平扫及增强扫描,其中增强扫描经外周静脉注射碘克沙醇注射液(威视派克,GE医疗集团)或碘普罗胺注射液(优维显,拜耳医药保健有限公司),剂量1.5 ml/kg,注射速率2~3 ml/s,动脉期、门脉期、延迟期分别从注射30 s、60 s、120 s 后开始扫描,由经验丰富的CT 医师判断最终结果。
3.热消融治疗:射频消融治疗使用CelonLab POW射频消融治疗仪(德国奥林巴斯公司),200-T20~200-T40 消融针;微波消融治疗使用KY-2000 微波消融治疗仪(南京康友医疗新科技有限公司),KY-2450A 或KY-2450B 消融针。热消融治疗前均行CEUS、CEMRI或CECT 检查明确病灶位置、数目、大小及增强模式;部分患者术中通过人工胸或腹水等辅助成像以清晰显示病灶或避免重要脏器受损。热消融治疗均由同一获得消融资质的主任医师完成。消融术毕即刻行CEUS 评估消融效果,若提示局部有残留或消融范围不足立即行补充消融。
4.随访:治疗后1 个月均首次行CEUS 和CEMRI或CECT 检查明确有无肿瘤残余,随后每3 个月行CEUS 和CEMRI 或CECT 检查评估有无局部肿瘤进展。结合2 种及以上增强影像学检查、肿瘤标志物水平进行临床综合诊断;当增强影像学检查结果不一致时,以病理结果或继续随访3 个月及以上增强影像学检查、肿瘤标志物水平进行综合判断并作为最终诊断[9]。发现肿瘤残余或局部进展者再次行消融或其他手段治疗,同时结束随访监测。疗效评价标准[6]:①肿瘤完全消融定义为术后首次增强影像学随访提示消融区无强化;②肿瘤残余定义为术后首次增强影像学随访提示消融区存在活性肿瘤[10];③局部肿瘤进展定义为已判定为完全消融的消融区内部及其周边在之后任何一次增强影像学随访中提示存在活性肿瘤。
三、统计学处理
应用SPSS 26.0统计软件,计数资料以频数或率表示,采用χ2检验、McNemar 检验或Fisher 确切概率法。以临床综合诊断结果为标准,计算并比较CEUS、CEMRI 或CECT 评估肝癌局部热消融疗效的灵敏度、特异度、阳性预测值、阴性预测值及准确率。采用单因素分析和多因素Logistic 回归分析局部肿瘤进展的影响因素。P<0.05为差异有统计学意义。
结果
一、临床综合诊断、CEUS、CEMRI 或CECT 随访肝癌局部热消融治疗结果
114个病灶随访3~18个月,平均(13.77±4.96)个月,临床综合诊断为完全消融93 个,肿瘤残余1 个,局部肿瘤进展20 个。局部肿瘤进展发生率为17.54%,平均进展时间(8.35±0.84)个月。CEUS 诊断完全消融95 个,肿瘤残余3 个,局部肿瘤进展16 个。CEMRI 或CECT 诊断完全消融91 个,肿瘤残余3 个,局部肿瘤进展20个。
CEUS、CEMRI 或CECT 随访肝癌局部热消融治疗结果与临床综合诊断结果比较差异均无统计学意义。CEUS 与CEMRI 或CECT 随访肝癌局部热消融治疗结果比较差异无统计学意义。见图1~3和表1,2。

表1 临床综合诊断、CEUS和CEMRI或CECT随访肝癌局部热消融治疗结果 个
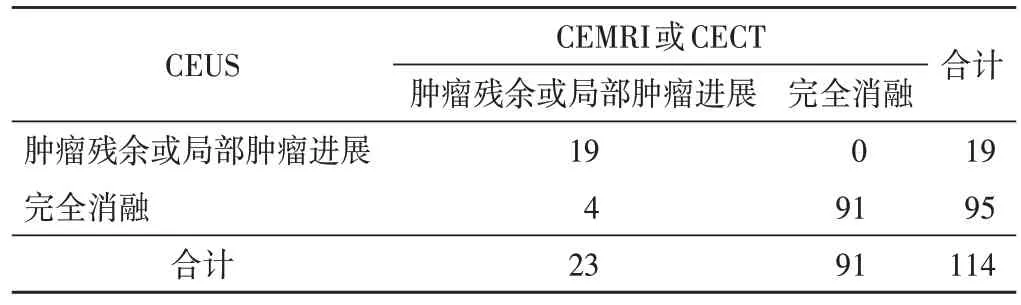
表2 CEUS与CEMRI或CECT随访肝癌局部热消融治疗结果 个

图1 完全消融患者(女,49岁,肝S6段转移性肝癌病灶,考虑卵巢来源)术后1个月常规超声、CEUS及CEMRI图

图2 肿瘤残余患者(女,33岁,肝S4段转移性肝癌病灶,考虑乳腺来源)术后1个月常规超声、CEUS及CEMRI图

图3 局部肿瘤进展患者(女,64岁,肝S5段转移性肝癌病灶,考虑结肠来源)术后6个月常规超声、CEUS及CEMRI图
二、CEUS与CEMRI或CECT评估肝癌局部热消融疗效的效能比较
CEUS 评估肝癌局部热消融疗效的灵敏度、特异度、阳性预测值、阴性预测值及准确率分别为97.85%、80.95%、95.79%、89.47%及94.73%;CEMRI 或CECT 评估肝癌局部热消融疗效的灵敏度、特异度、阳性预测值、阴性预测值及准确率分别为96.77%、95.24%、98.90%、86.96%及96.49%,二者诊断效能比较差异均无统计学意义。
三、热消融治疗后局部肿瘤进展的影响因素分析
本研究纳入的影响因素有病灶位置、邻近部位(包括是否邻近血管、膈顶、肝表面或重要脏器)、边界、形态、最大径、CEUS 各时相病灶增强模式、病理类型、术中是否采用辅助成像。单因素分析显示,病灶边界、形态和最大径均为热消融治疗后局部肿瘤进展的影响因素(均P<0.05)。见表3。多因素Logistic回归分析显示,病灶最大径是热消融治疗后局部肿瘤进展的独立危险因素(P<0.05)。见表4。

表3 热消融治疗后局部肿瘤进展的单因素分析 个
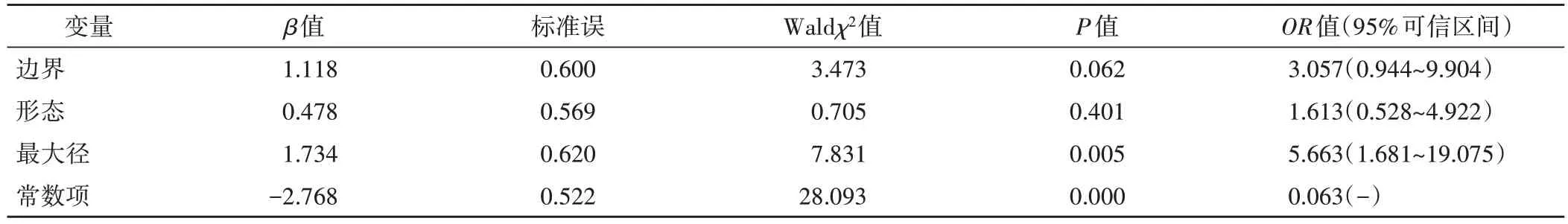
表4 热消融治疗后局部肿瘤进展的多因素Logistic回归分析
讨论
手术切除治疗肝癌的5 年复发率可达50%以上[11-12],而热消融治疗后肝癌复发率(8%~19%)较手术低[13-14],分析原因可能为热消融治疗可直接灭活肿瘤组织,不但具有高效、快速的优势,还可避免手术切除中挤压、触碰肿瘤可能发生的转移。目前热消融治疗肝癌已广泛应用于临床,影响其疗效的主要因素是消融不全或肿瘤局部进展[15]。达到完全消融的关键是保证安全边界,即消融范围应包括病灶及其周边5~10 mm 内的正常肝组织。因此,应用影像学技术准确判断病灶的边界有助于早期发现及诊治肿瘤残余或局部进展。CEMRI 和CECT 是目前临床公认的评估消融疗效的影像学标准[16],当肿瘤完全消融后,其内仅存留无血供的凝固性坏死组织,CEMRI 或CECT均表现为无强化,但CEMRI 价格昂贵,CECT 存在一定电离辐射,体内植入金属器械、心脏起搏器的患者禁用,且造影剂具有肝、肾毒性等,其临床应用有一定局限。CEUS 无电离辐射,造影剂无肝、肾毒性,应用范围较广,本研究旨在探讨CEUS 在肝癌局部热消融疗效评估中的应用价值,并分析局部肿瘤进展的影响因素。
研究[17-18]表明,应用CEUS 评估肝癌局部消融治疗后疗效与CECT或CEMRI价值相当。本研究结果也表明,CEUS与CEMRI或CECT评估肝癌局部热消融疗效的灵敏度、特异度、阳性预测值、阴性预测值及准确率比较,差异均无统计学意义,与上述研究结果一致,表明CEUS 在肝癌局部热消融疗效评估中具有重要价值。本研究随访时发现2 个假阳性病灶,术后1 个月CEUS 和CECT 均表现为消融区周边动脉期明显强化,考虑为肿瘤残余,后随访12 个月未见明显变化,临床综合诊断为完全消融,分析误诊原因为消融区周边出现异常灌注或形成炎性结节,不易与肿瘤残余鉴别所致。但肿瘤残余病灶常随着时间延长而增大,可见消融治疗后密切随访十分重要。本研究CEUS 随访时有3 个假阴性病灶,均位于肝右叶近膈顶或近肝表面,分析可能为呼吸和肋骨遮挡等因素导致病灶部分区域CEUS 显示不清,此时应采用CEMRI 或CECT 进行评估,发挥其不受肺气干扰、无探查盲区等优点以弥补CEUS 的局限。由此可见,CEUS 和CEMRI 或CECT 不仅可以相互佐证,还可以互为补充,且当残余病灶或进展病灶影像学表现不典型,短期无法准确评估时,进行长时间规律随访可提高诊断准确率。
本研究对114 个病灶进行随访,结果发现仅1 个肿瘤残余,其发生率(0.87%)低于刘宜翔和牛坚[19]研究结果(2.94%),分析与本研究所有病灶消融治疗后即刻行CEUS 评估是否灭活彻底、若有残留立即行补充消融的治疗策略有关。该残余病灶最大径>3 cm,病理类型为转移性肝癌,原发灶为左乳浸润性导管癌,分析肿瘤残余的原因为消融治疗后病灶周边有肿瘤细胞沿新生血管呈浸润性生长,导致病灶消融不全。此外,本研究发现热消融治疗后局部肿瘤进展发生率(17.54%)稍高于既往研究[19-20]报道(15.69%和14.02%),分析原因可能为诊断局部肿瘤进展常根据增强影像学表现,但本研究未纳入仅行CEUS、CEMRI 或CECT 的病灶,导致结果不同;但病灶平均进展时间为(8.35±0.84)个月,稍低于上述研究[19-20]报道(10 个月和9 个月),原因可能为本研究纳入病灶的随访时间较短,且无统一随访时限。本研究对病灶发生局部肿瘤进展的影响因素进行了单因素和多因素Logistic 回归分析,结果表明病灶最大径是热消融治疗后局部肿瘤进展的独立危险因素(OR=5.663,P<0.05),即随着病灶增大,出现局部肿瘤进展的风险增加,与Liu 等[21]研究结果一致,提示当病灶最大径>3 cm 时,需保证消融范围应包括病灶及其周边5~10 mm,且采用多点、多次叠加消融,前次的消融效应势必影响之后操作的精准性。既往研究[20,22]发现CEUS 定量分析测得病灶血流灌注程度是局部肿瘤进展的独立危险因素,复发性肝细胞癌及非胃、肠道来源转移性肝癌在射频消融治疗后发生肿瘤残余和局部肿瘤进展的概率较原发性肝细胞癌更高。但本研究单因素分析结果显示,病理类型和CEUS 各时相增强模式并非热消融治疗后局部肿瘤进展的影响因素,分析原因可能与纳入样本量较小或每个病灶采取个体化精准治疗有关。
综上所述,CEUS 评估肝癌局部热消融疗效的价值与CEMRI 或CECT 相当,可作为一种有效的随访手段;病灶最大径是热消融治疗后局部肿瘤进展的独立危险因素。但本研究样本量小、随访时间较短,有待今后扩大样本量、延长随访期限及扩充随访方法,对局部肿瘤进展病灶的病理类型、常规超声特征、超声造影定量参数等进行更深入的研究。
