非对称性二甲基精氨酸通过激活铁死亡促进小鼠早期肾损伤*
2023-11-02王知源刘志华李晓媚
占 玉, 王知源, 刘志华, 李晓媚
(广州医科大学附属第五医院前沿医学交叉研究中心,广州市生物靶向诊治重点实验室,广东高校生物靶向诊治与康复重点实验室,广东 广州 510700)
近年来,慢性肾病(chronic kidney disease, CKD)的发病率和死亡率逐年升高,根据近700 万成人患者的数据分析显示,全球肾病患病率约为13%[1]。CKD 的早期肾损伤表现为微量白蛋白尿、肾小球肿大、肾小球系膜扩张、肾小球滤过率降低和炎症反应等,并逐渐发展为进行性肾功能减退和肾脏纤维化,最终形成终末期肾病[2],给患者和社会带来沉重的负担,需进一步研究CKD的早期肾损伤机制。
铁死亡(ferroptosis)是指在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化而诱导细胞死亡,还表现为谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)的蛋白表达降低。有研究显示,与对照组相比,糖尿病肾病和急性肾损伤模型小鼠的肾组织GPX4 蛋白均显著减少、组织铁蓄积,而通过抑制铁死亡可显著改善糖尿病肾病的肾脏肥大和蛋白尿增多等病理损伤,并提高小鼠存活率[3-5],但在CKD 中铁死亡通路激活的上游因素尚未清楚。
铁死亡主要由铁稳态和氧化应激通路调控,而体内存在着一种激活氧化应激的调控途径。非对称性二甲基精氨酸(asymmetric dimethylarginine, ADMA)是内源性一氧化氮合酶(nitric oxide synthase, NOS)抑制物,可与L-精氨酸竞争NOS 的结合位点并使其解偶联,减少NO 合成,并增加超氧阴离子产生,导致氧化应激[6]。有研究显示,ADMA蓄积与伴有和不伴有2 型糖尿病的高血压患者的蛋白尿浓度呈正相关,且早期肾病患者血浆中也检测到ADMA 含量升高,到终末期肾病时,血浆ADMA 进一步显著升高[7-8]。此外,ADMA 含量也与CKD 儿童患者的肾功能指标肾小球过滤率呈负相关[9]。上述研究提示ADMA 可能与CKD 的早期肾损伤密切相关,但其是否通过激活细胞铁死亡促早期肾脏损伤,尚未见文献报导。因此,本研究通过ADMA 灌胃正常小鼠16周制备实验小鼠模型,检测糖脂代谢指标、ADMA/NOS/NO 通路及铁死亡通路等指标,观察ADMA 是否直接激活铁死亡通路促早期肾损伤。
材 料 和 方 法
1 主要试剂
ADMA ELISA 试剂盒购于晶美生物科技公司;ADMA 购于CSNpharm;胰岛素购于Macklin;甘油三酯(triglyceride, TG)试剂盒、总胆固醇(total cholesterol, TC)试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)试剂盒、组织铁离子检测试剂盒和血尿素氮(blood urea nitrogen,BUN)试剂盒均购于南京建成生物研究所;抗诱导型NOS(inducible NOS, iNOS)、内皮型NOS(endothelial NOS, eNOS)、GPX4、Bcl2、Bax 和caspase-1 抗体均购于Cell Signaling Technology;β-actin 抗体购 于Abcam;兔Ⅱ抗、鼠Ⅱ抗、白细胞介素6(interleukin-6,IL-6) ELISA 试剂盒、IL-1β ELISA 试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)活性检测试剂盒、丙二醛(malonaldehyde, MDA)检测试剂盒和BCA Protein Assay Kit均购于上海碧云天生物公司。
2 主要实验方法
2.1 NOS 抑制物ADMA 大鼠模型 8 周龄体重为(20±5) g 的SPF 级C57BL/6 雄鼠购于广东省医学实验动物中心[许可证号为SCXK(粤)2022-0002]。将16 只体重为(25±5)g 的SPF 级雄性C57BL/6 适应性喂养1 周后,随机分为正常对照(control)组和ADMA处理(ADMA)组,每组8 只。ADMA 组小鼠正常饮食,每天灌胃给予小鼠ADMA 60 mg·kg-1·d-1[10],正常对照组小鼠正常饮食,每天灌胃给予等体积的生理盐水,实验周期为16 周。由于后续需要检测的血清(每只300~500 µL)指标(TG、TC、HDL-C、BUN 和ADMA)比较多且需复孔,为了保证上述指标都能检测到,所以选择每组n=5;而收集的肾组织需要检测HE 实验,Western blot 实验和ELISA 实验等,待检测的指标多且样品处理方式不一样,因此, HE 染色切片实验每组选取n=8,而其他实验n=5;口服糖耐量实验(oral glucose tolerance test, OGTT)和胰岛素耐受实验(insulin tolerance test, ITT)实验在模型构建周期完成后进行检测,每组n=5。
2.2 OGTT 根据文献报导方法进行口服糖耐量实验[11],以评价胰岛素敏感性。小鼠禁食12 h 后经尾静脉取血,使用血糖仪测定空腹血糖值(fasting blood glucose, FBG),然后给小鼠一次性灌胃葡萄糖溶液(2 g/kg),分别在灌胃后30、60、90 和120 min 时点测定血糖值(blood glucose, BG);绘制血糖-时间曲线并计算曲线下面积(area under the curve,AUC),计算公式 为:AUC (mmol·L-1·min)=1/2×(BG0min+BG30min)×30+1/2×(BG30min+BG60min)×30+1/2×(BG60min+BG90min)×30+1/2×(BG90min+BG120min)×30。
2.3 ITT 根据文献报导方法进行胰岛素耐量实验[12],以评价胰岛素耐受情况。小鼠禁食6 h后经尾静脉取血,使用血糖仪测定FBG,然后给小鼠一次性腹腔注射胰岛素(0.75 U/kg),分别在注射后30、60、90 和120 min 时点测定,绘制血糖-时间曲线并计算AUC。
2.4 血脂检测实验 根据试剂盒的操作步骤,利用CPO-PAP 酶法检测小鼠血清的TG 含量;CPO-PAP 酶法检测血清的TC 含量;微板法检测血清的HDL-C含量。
2.5 ELISA实验 根据采购的ELISA试剂盒的操作步骤,首先配制标准品,并设置空白孔、标准品孔和待测样本孔;分别将不同浓度标准品按照每孔100µL 加入相应孔中,而待测样本则按照每孔加50 µL样品和50 µL 样品分析缓冲液,用封板膜封住反应孔,室温孵育120 min;然后洗板5 次;每孔加入生物素化抗体100 µL,用封板膜(透明) 封住,室温孵育60 min;再洗板5 次;每孔加入辣根过氧化物酶标记物100 µL,用封板膜封住反应孔,室温避光孵育20 min;洗板5 次;每孔加入显色剂100 µL,用封板膜封住反应孔,室温避光孵育20 min;最后每孔加入终止液50 µL,混匀后立即测量A450值。
3 统计学处理
数据使用均数±标准差(mean±SD)表示,采用SPSS 16.0统计学软件对数据进行分析,采用t-test检验。检验水平取双侧α=0.05,以P<0.05为差异有统计学意义。
结 果
1 ADMA可诱导小鼠糖代谢紊乱
如图1 所示,OGTT 实验结果显示,经过ADMA(60 mg·kg-1·d-1)灌胃处理16 周后,ADMA 组小鼠在30、60、90 和120 min 时点的血糖均显著高于正常对照组(P<0.01, 图1A),并且其血糖-时间曲线下面积(OGTT-AUC)也显著高于正常对照组(P<0.01, 图1B)。ITT 实验显示,ADMA 组小鼠在30、60、90 和120 min 时点的血糖也均显著高于正常对照组(P<0.01, 图1C),并且其血糖-时间曲线下面积(ITTAUC)也显著高于正常对照组(P<0.01, 图1D)。
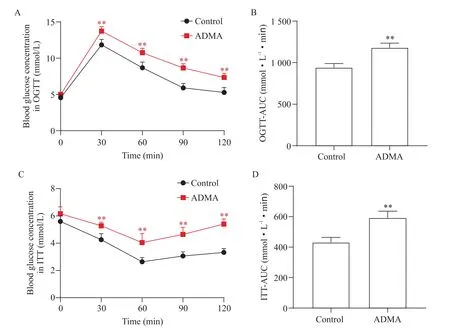
Figure 1.The effect of ADMA treatment on glucose tolerance of the mice.A: blood glucose levels in OGTT; B: the area under the concentration-time curve(AUC) in OGTT; C: blood glucose levels in ITT; D: the AUC in ITT.Mean±SD.n=5.**P<0.01 vs control group.图1 ADMA对小鼠糖耐受的影响
2 ADMA可诱导小鼠脂代谢异常
如表1 所示,与正常对照组小鼠相比,经过ADMA(60 mg·kg-1·d-1)灌胃处理16 周后,ADMA 处理组小鼠血清的TG 和TC 的含量均显著升高(P<0.01),而HDL-C的含量则显著降低(P<0.05)。

表1 ADMA对小鼠血脂代谢的影响Table 1.The effect of ADMA treatment on lipid metabolism of the mice (mmol/L.Mean±SD. n=5)
3 ADMA损伤肾脏组织的形态结构
如图2A、B 所示,与正常组小鼠相比,ADMA 处理组小鼠的肾重比显著升高(P<0.01),并且BUN 的含量也显著增多(P<0.01)。HE 组织染色实验结果显示,与正常对照组相比,ADMA 组小鼠表现出一系列的肾病指标,ADMA 诱导小鼠的肾小球显著肥大并胀裂、系膜细胞肥大、管腔变大等(图2C)。

Figure 2.The kidney injury of ADMA-treated mice.A: the ratio of kidney weight to body weight in each group; B: the content of blood urea nitrogen (BUN) in each group; C: the morphological change of renal tissue in each group(HE staining, scale bar=20 µm; the number 1 black arrow indicates glomerular hypertrophy, the number 2 black arrow indicates mesangial cell hypertrophy, and the number 3 black arrow indicates tubular lumen dilatation in ADMA-treated mice).Mean±SD.n=5.**P<0.01 vs control group.图2 ADMA对小鼠肾损伤的作用
4 ADMA诱导肾脏的炎症反应
根据Western blot 实验结果,与正常对照组相比,NOS抑制物ADMA处理16周后,显著升高小鼠血清中的ADMA 含量(P<0.01, 图3A),并显著抑制小鼠肾组织中eNOS 的表达,但显著增加了iNOS 的蛋白表达(P<0.01, 图3B),显著减少肾脏组织的NO含量(P<0.01, 图3C),并且ELISA 实验结果也显示,肾脏组织的促炎因子IL-6 和IL-1β 含量也都相对于正常对照组显著升高(P<0.01, 图3D、E)。

Figure 3.The pro-inflammatory effect of ADMA-treated mice.A: the serum ADMA content in each group; B: the protein levels of nitric oxide synthase (eNOS and iNOS) in renal tissue; C: the NO content in renal tissue; D: the IL-6 level in renal tissue;E: the IL-1β content in renal tissue.Mean±SD.n=5.**P<0.01 vs control group.图3 ADMA对小鼠肾脏的促炎作用
5 ADMA诱导脂质过氧化
通过检测脂质过氧化的最终代谢产物和抗氧化酶活性,以反映肾组织的脂质过氧化情况。结果显示,与正常对照组相比,NOS 抑制物ADMA 显著增加了正常小鼠肾脏组织脂质过氧化,如抗氧化酶SOD活性显著降低(P<0.05,图4A)、脂质过氧化最终代谢产物MDA显著增加(P<0.01,图4B)。

Figure 4.The lipid peroxidation in renal tissue of ADMA-treated mice.A: the antioxidant enzyme SOD activity in renal tissue; B:the MDA content in renal tissue.Mean±SD.n=5.*P<0.05, **P<0.01 vs control group.图4 ADMA对小鼠肾组织脂质过氧化的作用
6 ADMA激活铁死亡
通过检测铁死亡相关指针,结果显示,与正常对照组小鼠相比,NOS 抑制物ADMA 处理组小鼠肾组织的谷胱甘肽过氧化物酶4 蛋白表达显著减低(P<0.01,图5A),铁离子含量显著增加(P<0.01,图5B),并且促凋亡蛋白Bax 和caspase-1 蛋白表达都显著升高,而抗凋亡蛋白Bcl2 则显著降低(P<0.05,P<0.01,图5C)。

Figure 5.The ferroptosis in renal tissue of ADMA-treated mice.A: the protein level of GPX4 in renal tissue; B: the iron content in renal tissue; C: the protein levels of Bcl2, Bax and caspase-1 in renal tissue.Mean±SD.n=5.*P<0.05, **P<0.01 vs control group.图5 ADMA对小鼠肾组织铁死亡的作用
讨 论
内源性NOS 抑制物ADMA 在体内主要抑制NO生成和诱导氧化应激的发生,参与了多种人类疾病发展,如心血管、糖尿病和CKD 等[13-15]。本研究首次显示,ADMA 灌胃可直接诱导小鼠的肾重比和BUN含量增加、肾小球显著肥大并胀裂、系膜细胞肥大及肾组织促炎因子IL-6 和IL-1β 增多等早期肾损伤的病理症状;并伴随着脂质过氧化最终产物MDA 增加、抗氧化酶SOD 活性降低、组织铁蓄积和GPX4 蛋白表达降低等,该结果表明ADMA 可诱导早期肾损伤,并激活肾组织铁死亡。由此,本研究首次提出“ADMA 蓄积可能通过激活细胞铁死亡促小鼠的早期肾损伤”的观点。目前尚未见文献报导ADMA 与铁死亡通路在肾损伤的调控关系。但有文献报导,通过微型渗透泵给予小鼠输注ADMA 8 周,可显著诱导小鼠的肾小球肿大和肾血管纤维化[10];也有细胞实验显示,ADMA 和高糖均显著增加大鼠肾成纤维细胞和系膜细胞的迁移、侵袭、增殖和细胞外基质蛋白的积累等肾细胞纤维化的指标,而ADMA 水解酶的激动剂和NOS竞争性抑制剂L-精氨酸则可降低ADMA 的积聚,并显著改善ADMA 诱导的肾细胞纤维化,结果表明ADMA 参与诱导肾细胞纤维化损伤[16]。另一方面,还有文献显示,与无处理的妊娠大鼠组相比,外源性NOS 抑制物L-NAME 灌胃处理不仅诱导大鼠胎盘组织抗氧化酶SOD 活性降低和脂质过氧化代谢物MDA 显著升高,并显著降低铁死亡标记物GPX4 蛋白表达,增加肾组织铁蓄积,提示铁死亡;使用铁离子螯合剂去铁胺治疗则可逆转外源性NOS 抑制物L-NAME 引起的细胞铁死亡和胎盘损伤[17],表明NOS抑制物蓄积可激活细胞铁死亡通路。上述报道的研究结果是对本研究观点的佐证,但ADMA如何诱导铁死亡尚未清楚。
目前,已知高血糖、肥胖和高脂血症是CKD早期发生的独立危险因素,糖脂代谢紊乱有害于肾功能[18-19]。因此,本研究观察了ADMA灌胃处理对正常小鼠糖脂代谢的影响。OGTT 和ITT 实验都显示,与正常对照组相比,ADMA 处理显著升高0~120 min 的血糖浓度,提示糖耐受和胰岛素耐受;并且ADMA 直接诱导小鼠的脂代谢异常,如血清中TG 和TC 含量都显著升高,HDL-C 则显著降低,提示ADMA 诱导小鼠糖脂代谢紊乱;此外,NOS 抑制物ADMA 处理可增加小鼠血清ADMA 的含量,也显著降低肾组织中eNOS 蛋白表达和总NO 含量。这是因为NO 参与介导胰岛素的分泌[20-21],而NOS 抑制物ADMA 通过抑制NOS 活性和蛋白表达,减少胰腺B 细胞NO 的合成,从而导致分泌的胰岛素降低,血糖升高[22-23]。在糖代谢方面,高糖孵育可诱导HK-2 肾小管上皮细胞细胞产生大量活性氧,对肾细胞形成氧化应激性损伤和脂质过氧化,从而诱导细胞铁超载和铁死亡[24];在脂代谢方面,胆固醇脂质极容易被过氧化生成各种CH-OOH 产物,并且在铁的存在下,CH-OOH 可将相邻的脂类过氧化,促进脂质过氧化,进而激活铁死亡[25-26]。这些研究佐证了本研究中结果,即NOS 抑制物ADMA 可能通过诱导糖脂代谢紊乱促进小鼠肾组织氧化应激性损伤和脂质过氧化,从而激活铁死亡通路。
本研究还观察到ADMA 可直接诱导小鼠肾脏的炎症反应,如促炎因子IL-1β、IL-6 和iNOS 蛋白表达都显著增加,并伴随着Bcl2/Bax/caspase通路的改变。炎症反应是因为ADMA 蓄积除了抑制NO 合成外,同时也会产生大量的活性氧,氧化应激可诱导炎症的发生[14,27]。此外,有研究报导,在脂多糖诱导的急性肾炎症损伤小鼠模型中观察到,肾组织中的抗凋亡蛋白Bcl2 表达降低,促凋亡蛋白Bax 和caspase-1 蛋白表达上调,而通过抗氧化剂抑制小鼠肾炎症损伤后,也显著抑制Bcl2/Bax/caspase凋亡通路,这提示炎症反应可调控Bcl2/Bax/caspase 通路[28];还有研究显示,在肺腺癌细胞中,白花蛇舌草注射液可通过抑制Bcl2、促进Bax 表达激活电压依赖性阴离子通道2/3,进而诱导细胞铁死亡[29]。上述研究提示,ADMA 诱导的促炎反应可能通过抑制Bcl2 和促进Bax 进而诱导细胞铁死亡。
综上所述,本研究揭示了内源性NOS 抑制物ADMA 蓄积可诱导小鼠的早期肾损伤,其机制其一是ADMA 诱导小鼠的糖脂代谢紊乱引起肾脏的氧化应激和脂质过氧化,进而激活铁死亡诱导小鼠肾损伤;其二是ADMA 可能通过促炎因子IL-6 直接降低GPX4 表达,诱导肾脏细胞铁死亡,以及炎症反应可能通过调控Bcl2/Bax/caspase 通路诱导细胞铁死亡,从而促使早期肾损伤的发生。
