抑制TRAF6的E3泛素连接酶活性减轻野百合碱诱导的肺动脉高压大鼠肺血管重构*
2023-11-02许正秋邱莉华李冰冰
许正秋, 邱莉华, 陈 睿, 马 倩, 李冰冰
(南京中医药大学附属鼓楼临床医学院麻醉科,江苏 南京 210008)
肺动脉高压(pulmonary hypertension, PH)是一类严重影响人类生活质量的心血管疾病,表现为肺血管重塑和肺血管后负荷进行性升高,严重时引起患者右心功能衰竭甚至死亡[1]。肺动脉平滑肌细胞过度增殖和凋亡抵抗导致肺小动脉中膜增厚甚至闭塞是PH 的主要病理机制之一[2-3]。尽管目前临床上使用的血管扩张药物主要包括前列环素类似物和前列环素受体激动剂、内皮素受体拮抗剂、磷酸二酯酶-5 抑制剂和可溶性鸟苷酸环化酶抑制剂等药物在一定程度上对PH 患者的症状有缓解作用[4],但对于改善患者的远期生存率效果不佳,仍需要进一步探讨PH 的血管重塑机制,为靶向治疗提供新的策略。肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6, TRAF6)是一种能够介导蛋白间相互作用的适配蛋白以及免疫调节受体家族的下游因子[5],有研究报道发现其N 端的RING 结构域具有E3 泛素连接酶的活性,能够介导其自身在内的多种蛋白质的多聚泛素化以及信号转导[6]。信号转导及转录激活因子3(signal transducer and activator of transcription 3, STAT3)是一类细胞信号转录因子,有研究表明磷酸化的STAT3能促进肺动脉平滑肌细胞的增殖与凋亡抵抗,导致PH 的发生[7];研究发现在荷瘤小鼠模型中,来源于肿瘤组织的髓源性抑制细 胞(myeloid-derived suppressor cells, MDSCs)中TRAF6 的表达显著上调,且TRAF6 能够与STAT3 结合,介导STAT3 的K63 连接的多聚泛素化及STAT3的磷酸化激活来调节MDSCs 的免疫抑制活性,促进肿瘤的发展[8]。但在PH 中TRAF6 的E3 泛素连接酶活性是否对STAT3的磷酸化激活至关重要目前还不清楚。因此,本研究探讨了PH中TRAF6的泛素连接酶活性对STAT3激活和肺血管重构的影响。
材 料 和 方 法
1 实验动物与试剂
雄性SD大鼠42只,6~8周龄,质量为180~220 g,购自北京斯贝福生物技术有限公司[实验动物许可证号:SYXK(苏)2021-0007]。维持环境温度20~21 ℃,湿度50%~60%,动物采用普通饲料喂养,自由饮食。本研究所有的动物相关操作均按照动物实验伦理的规定进行。野百合碱(monocrotaline, MCT)为Sigma 产品;C25-140(TRAF6 特异性E3 泛素连接酶活性抑制剂)购自MedChemExpress;抗TRAF6 抗体(ab33915)为Abcam 产品;抗STAT3 抗体(4904T)及抗p-STAT3 抗体(9145T)为Cell Signaling Technology产品;抗细胞周期蛋白D1(cyclin D1)抗体及抗β-actin 抗体为Proteintech 产品;抗K63 ubiquitin 抗体为Cell Signaling Technology 产品。免疫共沉淀试剂盒(2179S)购自上海碧云天生物技术有限公司。
2 动物分组及处理
在饲养环境适应1 周后,将42 只SD 大鼠随机分为4 组:对照(control, CON)组,C25-140 组,MCT 组及MCT+C25-140 组。MCT 组及MCT+C25-140 组的大鼠均先在颈后皮下单次注射野百合碱,浓度为2%,剂量为60 mg/kg,建立PH 模型。C25-140 组及MCT+C25-140组大鼠于造模后第14天、21天和28天腹腔注射剂量为9.8 mg/kg的C25-140化合物。
3 实验方法
3.1 超声心动图检测 大鼠吸入异氟烷麻醉,体动反应消失后仰卧固定于鼠板,固定呼吸面罩,以500 mL/min流量的异氟烷维持,去除胸前毛发,将耦合剂涂抹于超声探头,准备超声检测。脉冲多普勒模式测量肺动脉血流加速时间(pulmonary arterial acceleration time, PAAT),在心尖四腔切面使用M 超测量三尖瓣环平面收缩期位移(tricuspid annular plane systolic excursion, TAPSE)。
3.2 肺组织取材 大鼠安乐死后,暴露出双肺和心脏,剪开左心耳,经左心室用肝素生理盐水对肺循环持续进行灌注,直至双肺颜色转白停止灌注。取右肺部分置于-80 ℃保存,左肺用4%多聚甲醛固定24 h,用于之后的病理学染色。
3.3 大鼠原代肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs)分离培养 大鼠水合氯醛腹腔注射麻醉后,浸泡于75%乙醇5 min,于无菌手术台上开胸取出肺组织,无菌PBS 冲洗3 次。显微镜下分离出肺动脉,剔除血管周围肺组织、神经及筋膜等,分离干净的血管转移至新10 cm 培养皿中。纵行剪开肺血管,用镊子轻轻刮拭内层,去除内皮细胞层。用眼科剪剪成约1 mm×1 mm×1 mm 的小块,接种到含1 mL DMEM 培养基(含20%血清、100 U/mL 双抗)的平皿中,轻摇培养基,使每块组织块间间距约为0.8~1.0 cm。静置于37 ℃、5% CO2培养箱中2 h,待组织贴牢后,缓慢添加DMEM 培养基(含20%血清、100 U/mL 双抗)完全覆盖组织块,继续培养至细胞从组织块周围爬出。
3.4 HE 染色 将固定好的大鼠肺组织进行脱水、石蜡包埋,切成5 µm 厚的切片,用苏木精和伊红进行染色,在400倍镜下观察各组管径20~150 µm的肺中小动脉形态,使用Image-Pro Plus 6.0 测量肺小动脉中膜厚度(media thickness, MT)和血管外径(external diameter, ED),计算肺小动脉中膜厚度百分比(中膜厚度百分比=2MT/ED×100%)。
3.5 Western blot 称取50~100 mg 的新鲜肺组织,用预冷的PBS 清洗,去除多余水分后加入含磷酸酶和蛋白酶抑制剂的裂解液,剪碎组织后匀浆,冰上静置30 min,离心后取上清,BCA 法测定蛋白浓度。使用相应浓度的SDS-PAGE 进行蛋白分离、转膜、封闭,加Ⅰ抗(TRAF6和cyclin D1抗体,1∶5 000;STAT3和p-STAT3 抗体,1∶2 000;β-actin 抗体,1∶10 000),置于4 ℃摇床上孵育过夜。TBST 洗膜3 次,加入相应的HRP 标记的Ⅱ抗,室温下孵育1.5 h,TBST 再次洗涤后进行曝光,留取图片,使用ImageJ 分析条带的灰度值,以目的条带和内参条带的灰度值之比反应目的蛋白的表达水平。
3.6 免疫共沉淀 取CON 组及PH 组大鼠PASMCs各一皿,弃培养基,PBS 清洗后加入含磷酸酶和蛋白酶抑制剂的裂解液,用细胞刮将细胞刮下并转移至1.5 mL 离心管中,冰上裂解30 min,离心后取上清,BCA 法测定蛋白浓度。取适量CON 组和PH 组细胞蛋白上清液,加入STAT3抗体工作液(稀释度1∶200)和IgG 工作液,置于侧摆摇床,4 ℃孵育过夜。采用免疫共沉淀法测定STAT3 的K63 泛素化水平。将免疫沉淀后的上清使用相应浓度的SDS-PAGE 进行分离、转膜、封闭,加Ⅰ抗K63 ubiquitin 抗体(稀释度1∶1 000),4 ℃摇床孵育过夜。TBST 洗膜3 次,加入相应的HRP 标记的Ⅱ抗,室温下孵育1.5 h,TBST 再次洗涤后进行曝光,留取图片。
3.7 免疫荧光染色 新鲜取材的肺组织用OCT进行包埋,切成7 µm 的厚度。用0.5% Triton X-100 溶液进行通透,PBS 洗涤3 次。5% BSA 溶液室温封闭35 min。甩去封闭液,加入适量TRAF6(稀释度1∶50)和STAT3(稀释度1∶1 000)的Ⅰ抗混合液,4 ℃过夜。孵育相应的Ⅱ抗,37 ℃孵育30 min,PBS冲洗后,加DAPI(含抗荧光淬灭剂)封片。荧光显微镜下观察肺中小动脉中目标蛋白的定位和表达,拍照并存图。
4 统计学处理
采用GraphPad Prism 9 软件进行分析处理,正态分布的计量资料以均数±标准差(mean±SD)表示,配对样本采用t检验,多个样本比较时采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 腹腔注射C25-140对PH大鼠肺血管重构的影响
与CON 组比较,MCT 组大鼠PAAT 和TAPSE 明显缩短(P<0.05),中小肺动脉中膜明显增厚(P<0.05),α-SMA 荧光强度明显增强(P<0.05);MCT+C25-140组大鼠PAAT 和TAPSE 相对MCT 组增加,肺中小动脉中膜增厚程度减小(P<0.05),α-SMA 荧光强度降低(P<0.05),见图1和2。

Figure1.Comparison of PAAT, TAPSE and related indexes of vascular remodeling in rats before and after modeling.Mean±SD.n=6.**P<0.01 vs CON group; &&P<0.01 vs MCT group.图1 造模前后大鼠PAAT、TAPSE及血管重构相关指标的比较

Figture 2.HE staining and α-SMA immunofluorescence of small pulmonary vessels in rats (scale bar=50 µm).Mean±SD.n=6.*P<0.05 vs CON group; &P<0.05 vs MCT group.图2 大鼠肺组织HE染色和α-SMA免疫荧光结果
2 PH大鼠PASMCs中STAT3的K63泛素化情况
与CON 组PASMCs 比 较,PH 大 鼠PASMCs 中STAT3的K63泛素化水平明显升高,见图3。

Figure 3.K63 ubiquitin level of STAT3 in pulmonary artery smooth muscle cells.图3 肺动脉平滑肌细胞中STAT3的K63泛素化情况
3 腹腔注射C25-140 对PH 大鼠肺组织TRAF6 表达、STAT3磷酸化及cyclin D1表达的影响
与CON 组比较,MCT 组大鼠肺组织TRAF6 蛋白水平、p-STAT3/STAT3 比值及cyclin D1 蛋白水平明显升高(P<0.05),而MCT+C25-140 组大鼠肺组织中TRAF6 蛋白水平、p-STAT3/STAT3 比值及cyclin D1蛋白水平相对于MCT 组有所降低(P<0.05),见图4。
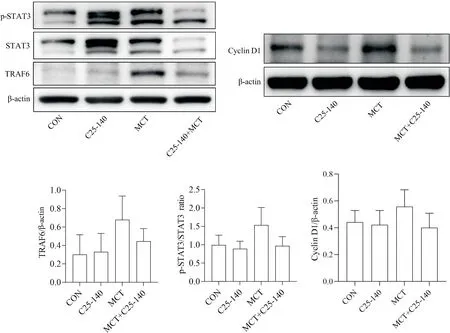
Figure 4.The protein expression of TRAF6, STAT3, p-STAT3 and cyclin D1 in each group.Mean±SD.n=6.*P<0.05, **P<0.01 vs CON group; &P<0.05, &&P<0.01 vs MCT group.图4 肺组织TRAF6、STAT3、p-STAT3及cyclin D1的表达
4 腹腔注射C25-140 对PH 大鼠肺组织TRAF6 与STAT3共定位影响
与CON 组相比,MCT 组大鼠肺血管中膜TRAF6和STAT3 存在共定位,经C25-140 处理以后,两者的共定位明显减弱,见图5。

Figure 5.Immunofluorescence of TRAF6 and STAT3 in lung tissue of rats in each group (scale bar=50 µm).图5 肺血管TRAF6与STAT3的共定位情况
讨 论
PH 是一种严重的心血管疾病,被称为心血管系统中的癌症,其主要病理特征是肺动脉中膜平滑肌细胞的异常增殖,内膜和外膜的纤维化,原位血栓形成、丛状病变以及周围血管炎症浸润,引起肺动脉持续性异常收缩,肺血管阻力和肺动脉压升高,最终导致右心衰竭甚至死亡[9]。在本研究中,采用单次皮下注射野百合碱的方式构建大鼠PH 模型,造模后PH 大鼠PAAT 和TAPSE 明显缩短,中小肺动脉中膜厚度明显增加,α-SMA 荧光强度明显增加,提示造模成功。
TRAF6 是一种具有E3 泛素连接酶活性和免疫调节双重作用的蛋白,已有研究表明TRAF6 在结肠癌、乳腺癌、肺癌以及胰腺癌等多种恶性肿瘤中均存在异常表达,并参与肿瘤细胞的增殖、转移及血管生成等过程[10-13]。本研究发现MCT 诱导的PH 大鼠肺组织中TRAF6 也存在明显升高,通过使用化合物C25-140 抑制TRAF6 的泛素连接酶活性后,TRAF6的蛋白水平有所下降,可能是由于TRAF6 泛素连接酶活性受到抑制时,功能失活的TRAF6 自身稳定性有所降低,继而被降解,但具体的降解机制还需要进一步的探究。STAT3 是一种细胞信号转录因子,参与正常细胞的分化、增殖和血管生成等多种生命活动[14]。STAT3 静息状态下通常以非活性状态定位于细胞的胞质当中,磷酸化是STAT3激活的重要步骤,STAT3 一旦被激活即转移到细胞核当中,充当多种靶基因的转录激活剂[15-16]。早在2012年,Wei等[17]就通过免疫共沉淀实验证明在哺乳动物细胞中E3 泛素连接酶TRAF6 能够与STAT3 结合,负调控TAK2-STAT3 信号通路的激活,下调STAT3 下游的靶基因CRP 和ACT 的表达;另外,Ruan 等[18]的研究证实了鼠沙门氏杆菌感染宿主细胞时可以特异性诱导TRAF6 发生泛素化,随后TRAF6 在STAT3 的SH2 结构域介导K63 连接的泛素化,促使STAT3 被招募到细胞膜,发生磷酸化激活,以利于沙门氏杆菌在宿主细胞内生长繁殖。在本研究当中,在TRAF6的E3泛素连接酶活性受到抑制时,STAT3 的磷酸化水平明显降低,且免疫荧光共定位的结果也显示抑制TRAF6 的泛素连接酶活性时肺动脉上STAT3 与TRAF6 的共定位情况明显减弱。由此可见,通过抑制TRAF6 的E3 泛素连接酶活性,可能影响TRAF6与STAT3 的相互结合,从而影响STAT3 的磷酸化激活过程。
cyclin D1 是一种细胞周期调节蛋白,在有丝分裂的G1期向S 期转变的过程中发挥关键调节作用,是细胞增殖的关键靶点[19]。多项研究表明cyclin D1是STAT3 下游靶点,能够被 STAT3 直接调控。Deng等[20]发现在肠上皮细胞中STAT3 能够调节下游cyclin D1 的表达,促进肠上皮细胞的增殖。另外Zhou等[21]发现血管平滑肌细胞当中STAT3 也能够直接靶向下游的cyclin D1,促进血管平滑肌细胞的增殖与迁移。cyclin D1 的过表达与PH 发病密切相关,Zhu等[22]发现在PH 发病过程中,血小板衍生生长因子能够诱导肺动脉平滑肌细胞中cyclin D1 的过表达,引起PASMCs增殖。类似地,Xiao等[23]发现在缺氧诱导的PH 大鼠肺动脉平滑肌细胞当中cyclin D1 明显过表达。在本研究中,当抑制TRAF6 的泛素连接酶活性时,STAT3 的磷酸化水平下降,下游的cyclin D1 水平也随之改变,故PH 疾病当中TRAF6-STAT3-cyclin D1信号通路激活并调控肺动脉平滑肌细胞的增殖。
综上所述,TRAF6 分子上调介导STAT3 泛素化后磷酸化激活,磷酸化的STAT3随后激活下游cyclin D1 等细胞周期因子的转录,导致肺动脉平滑肌细胞增殖与凋亡抵抗,肺动脉中膜增厚,肺血管重构。当抑制TRAF6 的泛素连接酶活性时,STAT3 的磷酸化水平降低,抑制STAT3与TRAF6相互作用,最终可降低大鼠肺动脉压力、增强右心的收缩力和缓解肺血管中膜增厚,故TRAF6作为一种E3泛素连接酶直接介导STAT3 泛素化后磷酸化激活的机制可能在PH的发病过程中发挥重要作用。
