沉默CBX4抑制食管胃结合部腺癌细胞的增殖、迁移和侵袭*
2023-11-02彭雨婷任益凡徐泽宇莱智勇
彭雨婷, 武 锋, 任益凡, 徐泽宇, 莱智勇, 徐 钧△
(1山西医科大学基础医学院,山西 太原 030001;2山西医科大学第一临床医学院,山西 太原 030001;3山西医科大学第一医院,山西 太原 030001)
食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)是肿瘤中心位于食管-胃解剖交界线上下5 cm 范围以内的腺癌[1]。其解剖结构和生物学行为既不同于食管癌也不同于胃癌。在全球范围内,尽管远端胃癌的发病率和死亡率呈稳步下降状态,但AEG 的发病率在过去几十年中持续呈现上升趋势[2],尤其在西方国家,其发病率急剧增加[3]。美国研究结果表明,自1973 年至1992 年,AEG 的发病率增加了近2.5 倍[4]。而国内关于AEG 发病率的研究报道暂时还较少。从国内某一项单机构数据分析结果显示,仅在1988 年至2012 年间,在研究者所在机构中,发现AEG 的比例由原来的22.3%增加到35.7%[5]。
目前,AEG 的治疗方式仍然以手术为主。虽然一定程度可以短期控制病情和抑制远处转移,但患者的远期存活率在近年来依旧没有明显改善。AEG普遍预后较差的主要原因之一在于AEG的早期症状不典型,大部分患者在肿瘤初期阶段尚未诊断出来,一旦被确诊时或已经发生了远处转移等晚期征象。且AEG 的发病原因复杂,尚未知晓其明确的发病机制。因此只有明确AEG 的易感因素,在分子水平上进行更加深入的机制研究,才能有效地遏制疾病的发生发展,便于疾病能够早期诊断、及时治疗,从而降低患者的死亡率以及提高患者的远期存活率。
多梳蛋白家族(ploycomb group proteins, PcG)通过修饰染色质来调控转录过程,在调节细胞的周期和衰老、细胞命运决定以及肿瘤等多种生理及病理功能中起到重要作用[6]。截止到目前为止,已经有越来越多的证据表明,PcG 蛋白参与肿瘤发生发展的调控,其可作为治疗反应和预后的生物标志物[7]。
色素框同源蛋白4(chromobox 4, CBX4)作为PcG 中的重要成员之一[8],也称为多梳蛋白2(polycomb 2, Pc2),是具有小泛素相关修饰物(small ubiquitin-related modifier, SUMD)E3 连接酶活性的蛋白质[9]。由于其可调控RNA 转录以及蛋白质翻译后修饰等多个环节,因而可参与调节多种肿瘤的发生发展。有文献报道,在多种恶性肿瘤中,如肺癌、乳腺癌、肝癌、骨肉瘤及宫颈癌等,CBX4可以作为肿瘤基因促进肿瘤细胞的增殖和迁移[10-16]。但也有学者发现在有些肿瘤中,CBX4对肿瘤的恶性进展起到了抑制作用,例如Wang 等[17]研究发现CBX4 通过介导Runx2 来遏制结直肠癌细胞迁移、侵袭和转移。CBX4是作为肿瘤基因或是抑癌因子,取决于是在何种细胞中以及与其相互起作用的因子。综上所述,尽管CBX4 在多种肿瘤中已有研究,但CBX4 在AEG中的表达水平以及功能作用暂不清楚,有待我们进一步研究。
本研究检测40 对AEG 患者肿瘤组织和对应的临近正常组织中CBX4 的表达水平,分析CBX4 的表达量与患者预后生存时间的关系;同时选择恰当的细胞系进行实验,通过敲低CBX4在AEG 细胞中的表达,研究沉默CBX4对AEG 细胞增殖、迁移以及侵袭的影响,并初步探讨CBX4 在AEG 中起作用的分子机制,以期为AEG 患者提供新的分子标志物以及治疗靶点。
材 料 和 方 法
1 材料
1.1 数据收集 收集山西省肿瘤医院进行手术切除的22 例患者的AEG 组织,将这22 例患者的AEG组织以及配对的癌旁组织送往深圳华大基因研究院,采用Illumina HiSeq 测序平台进行高通量测序[18]。CBX4 与Wnt/β-catenin 信号通路蛋白相关性分析使用在线GEPIA2数据库。
1.2 人胃食管结合部腺癌组织样本 临床组织样本均取自于2017 年6 月至2019 年6 月在山西省肿瘤医院接受手术治疗患者的40 例AEG 组织和距离肿瘤2~5 cm范围内配对正常组织。肿瘤标本以及配对的正常组织均取自手术切除的组织,切缘术后病理类型全为阴性。40 例患者基本信息见表1。AEG 的诊断与治疗均依据中国学者普遍认可的Siewert分型及治疗方法,所有患者均未接受任何其他的术前治疗。本次研究中涉及的所有患者,均已获得知情同意,且书面知情同意书均已签署。所有方案均经山西省医学科学院伦理委员会和山西省肿瘤医院批准。

表1 40例患者的基本信息Table 1.Clinical information of 40 patients
1.3 细胞系 由于AEG 解剖位置以及结构的特殊性,暂时没有特定的AEG 细胞系。考虑到AEG 的病理类型,故选用食管腺癌以及胃癌细胞系作为替代细胞完成后续实验。本研究选用了以下4 种细胞系作为实验研究对象:AGS、HGC-27、SK-GT-4 和TE-1。均购于中国科学院上海细胞库。
1.4 试剂 胎牛血清(fetal bovine serum,FBS)、胰蛋白酶(Trypsin)、RPMI-1640 培养液和BCA 蛋白浓度测定试剂盒购于赛文创新(北京)生物科技有限公司;Trizol 试剂、细胞计数试剂盒8(Cell Counting Kit-8,CCK-8)和LipofectamineTM2000 试剂盒购自Invitrogen;逆转录试剂盒购于天根生化科技(北京)有限公司;PVDF 膜购自Millipore;兔抗CBX4、c-MYC 和细胞周期蛋白D1(cyclin D1)多克隆抗体购自上海生工生物工程股份有限公司。
2 主要方法
2.1 细胞培养 4 种AEG 细胞系(AGS、SK-GT-4、HGC-27和TE1)和1种正常人胃黏膜上皮细胞(GES-1)均用含有10% FBS 和1%青霉素和链霉素双抗的RPMI-1640 培养液培养,培养于37 ℃、5% CO2、湿度97%的细胞培养箱中。每2~3 d 更换1 次新鲜培养基。待细胞融合至80%~90%时,以胰蛋白酶消化,传代培养。
2.2 细胞转染 将AGS和SK-GT-4细胞接种于6孔板上培养,每孔1×105个细胞。待细胞密度培养到50%~70%后更换成不含FBS 的RPMI-1640 培养基。根据转染试剂的产品说明书,使用Lipofectamine 2000分别将CBX4 siRNA (si-CBX4)或乱序无意义阴性对照(negative control siRNA, si-NC)转染在6 孔板上培养的AGS 和SK-GT-4 细胞中。si-CBX4 和si-NC购自上海吉玛生物有限公司,序列见表2。转染6 h后,更换成含有FBS的培养基。

表2 siRNA序列和RT-qPCR引物序列Table 2.Sequences of siRNA and primers for RT-qPCR
2.3 实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR) 根据提取RNA 试剂盒的说明书,用提取细胞RNA 试剂盒提取细胞的总RNA,同时使用Trizol 试剂从AEG 组织样品中分离出RNA。使用微量核酸仪检测RNA的纯度和浓度。使用 Prime-Script™ 一步式RT-qPCR试剂盒将RNA 逆转录为cDNA。然后以cDNA 为模板,进行PCR 扩增。PCR 反应设定为95 ℃ 10 min;然后95 ℃ 15 s、60 ℃ 60 s,重复45 个循环。GAPDH是内参照。GAPDH和CBX4引物序列见表2。
2.4 划痕愈合实验 将经敲减处理过AGS 和SKGT-4 的si-NC 组和si-CBX4 组的细胞以5×105的细胞浓度均匀接种在 6 孔培养板中,培养至小孔长满。使用无菌移液枪枪头的尖端在每个孔中进行划痕处理。然后用PBS 进行洗涤以清除细胞碎片,然后在不含 FBS 的培养基中培养。在划痕0、24 h 时,在每孔的相同位置拍摄记录细胞的迁移状态。
2.5 CCK-8实验 将AGS和SK-GT-4细胞经敲减处理后,每孔吸取100 µL 的经敲减处理过的AGS 和SK-GT-4 细胞分别接种于96 孔板,调整细胞浓度到每孔2×103个细胞,每组设置3 个复孔。用同样的方法铺5 板96 孔培养板。取其中一板,在铺板后孵育约4 h,待细胞完全贴壁,向每个孔中加入 10 µL 的CCK-8 工作液,继续在培养箱中孵育2~4 h。然后应用酶标仪检测每个孔在450 nm 处的吸光度(A)值。其余4 板在连续4 d 的相同时间段每孔加入10 µL 的CCK-8 工作液以及测量A值,连续观察5 d AGS 和SK-GT-4细胞的si-NC组和si-CBX4组的细胞活力。
2.6 Transwell 实验 用不含血清的培养基重悬经敲减处理过细胞,采用特制的Matrigel Invasion Chamber,在上室加入200 µL 细胞悬液(无血清),在下室加入 600 µL 含10% FBS 的培养基。放入恒温孵箱中孵育48 h后,拿出培养板,用镊子小心取出细胞小室,吸干上室内的液体,移到预先加入约600 µL的4%的多聚甲醛的孔中,室温固定30 min 后用0.1%~0.2%结晶紫染色5~10 min,观察计数。
2.7 Western blot 将RIPA 裂解液与蛋白酶抑制剂按照100∶1 的比例配置。经干扰处理过的si-NC 组和si-CBX4组的细胞,用裂解液(含有蛋白酶抑制剂)从细胞中分离总蛋白30 min,随后在13 000 ×g下离心10 min后以收集蛋白质的上清液。使用BCA试剂盒测蛋白浓度后,各管蛋白用裂解液和loading buffer定量后金属浴变性10 min。每孔20 µg 蛋白上样,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量的蛋白质。电泳结束后,然后电转移到PVDF膜,用5%脱脂牛奶(TBST配制)封闭 2 h后,分别加入CBX4、c-MYC、cyclin D1、β-catenin、和β-actinⅠ抗,4 ℃孵育过夜。用TBST 洗膜3 次后,加入辣根过氧化物酶偶联的Ⅱ抗,在室温下摇床孵育 2 h。最后,加入电化学发光检测试剂,避光显影,凝胶成像系统曝光拍照。以β-actin 为内参照,并使用ImageJ软件分析目的条带的灰度值。
3 统计学处理
所有数据均采用GraphPad Prism 7.0 软件进行分析。计量数据采用均数±标准差(mean±SD)表示,两组均数比较使用独立样本t检验,多组间比较使用单因素方差分析。采用Kaplan-Meier 法绘制生存曲线,生存分析采用log-rank 检验。以P<0.05 为差异有统计学意义。
结 果
1 AEG 组织高通量测序得出CBX4 可能与肿瘤发生发展有关
对22 对山西肿瘤医院的AEG 患者组织进行高通量测序,对测序所得到的40 523 个RNA 转录本数据进行“基因权重共表达网络分析”,并将这22 例AEG 组织的临床样本的血清学的肿瘤标志物和WGCNA 分析所获得的modules 分别做相关性分析,分析结果表示研究目标将锁定在Blue module 和Brown module 两个基因群。对Blue module 和Brown module 这两个基因群进行功能富集分析,分析发现在Blue module 和Brown module 中排名前五的几种基因可能是这两个基因群组的核心基因(表3),选用Brown module 中前三个基因在AEG 组织中进行验证,发现与临近正常组织相比,TRIM28 和SLC3A2 在AEG 组织中表达无明显差异,而CBX4 在AEG 中表达增高。因而选用CBX4 进行后续实验,加以验证分析。

表3 Blue module(TOP1)和Brown module (TOP5)中的核心基因Table 3.core genes in Blue module (TOP1) and Brown module (TOP5)
2 CBX4在食管胃结合部腺癌组织和细胞中的表达
2.1 RT-qPCR 检测CBX4在食管胃结合部腺癌组织中的表达 为了确定CBX4 在AEG 发生中的作用,通过提取山西省肿瘤医院的40 对AEG 组织和匹配的相邻正常组织的样本RNA,逆转录成cDNA 后,使用RT-qPCR 检测CBX4 在食管胃结合部腺癌组织中的表达情况。与临近正常组织相比,AEG 组织中CBX4 的表达量显著上调(P<0.01)。使用GraphPad Prism 8.0 对患者手术后生存时间与CBX4 表达量的相关性进行分析,结果表明,当CBX4表达量高时,患者预后生存时间较短,具有统计学意义,见图1。

Figure 1.The expression of CBX4 in 40 pairs of AEG tissues and matched adjacent normal tissues was detected by RT-qPCR (A),and then the survival rate was analyzed (B).Mean±SD.n=40.**P<0.01 vs normal.图1 CBX4表达量及生存率分析
2.2 检测CBX4 在食管胃结合部腺癌细胞中的表达 利用RT-qPCR 和Western blot 实验进一步检测AEG细胞系中CBX4的表达情况。结果表明,相较于正常胃上皮细胞GES-1, CBX4在AEG细胞系中均呈高表达。数据表明,CBX4 表达的增高可能有助于AEG的发展。见图2。

Figure 2.Expression of CBX4 in GES-1, AGS, HGC-27, SK-GT-4 and TE-1 cell lines.Mean±SD.n=3.**P<0.01 vs GES-1.图2 CBX4在GES-1、AGS、HGC-27、SK-GT-4和TE-1细胞系中的表达情况
3 沉默CBX4 对食管胃结合部腺癌细胞的增殖、迁移和侵袭能力的影响
3.1 siRNA 敲低CBX4表达的效率 与对照组si-NC 相比,经过si-CBX4 敲减处理后的AGS 和SK-GT-4细胞中CBX4的mRNA和蛋白表达水平均明显下调(P<0.05),证实CBX4 敲减有效果。其中在AGS 和SK-GT-4 中,si-CBX4-1 的敲减效率最好,选择其对细胞进行敲减处理完成后续实验,见图3。

Figure 3.Verifying the knockdown efficiency of CBX4 siRNA using RT-qPCR (A) and Western blot (B).Mean±SD.n=3.**P<0.01 vs si-NC.图3 RT-qPCR和Western blot验证CBX4 siRNA的敲减效率
3.2 沉默CBX4对食管胃结合部腺癌细胞活力的影响 将用si-CBX4-1 处理过的AGS 和SK-GT-4 细胞铺进96 孔板中,利用CCK-8 实验测量细胞的活力。结果表明,与si-NC 组相比,当CBX4 的表达量降低后,AGS和SK-GT-4细胞的活力明显下降,见图4。

Figure 4.Effects of CBX4 silencing on the viability of AGS and SK-GT-4 cells.Mean±SD.n=3.*P<0.05, **P<0.01 vs si-NC.图4 沉默CBX4对AGS和SK-GT-4细胞活力的影响
3.3 沉默CBX4对食管胃结合部腺癌细胞迁移功能的影响 待6 孔板中的AGS 和SK-GT-4 长到70%~80%左右时,对 AGS 和SK-GT-4 细胞进行敲减处理,通过划痕愈合实验检测沉默CBX4对AGS 和SK-GT-4 细胞迁移能力的影响。结果显示,当CBX4基因表达量下降后,AGS 细胞和SK-GT-4 细胞的迁移能力明显下降,见图5。
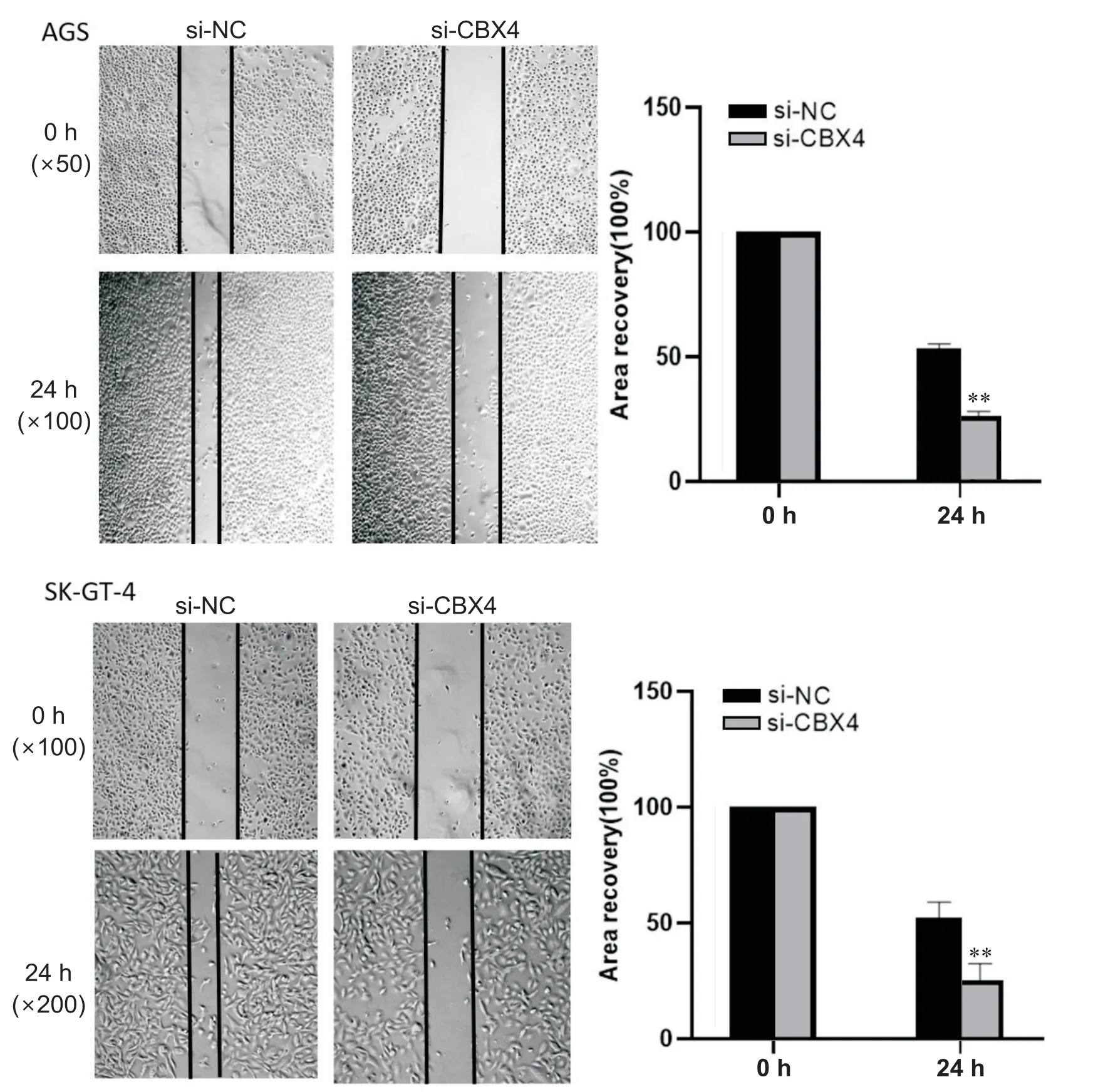
Figure 5.Effects of CBX4 silencing on the migration of AGS and SK-GT-4 cells.Mean±SD.n=3.**P<0.01 vs si-NC.图5 沉默CBX4对AGS和SK-GT-4细胞迁移能力的影响
3.4 沉默CBX4对食管胃结合部腺癌细胞侵袭功能的影响 通过Transwell 侵袭实验检测沉默CBX4对AGS 细胞和SK-GT-4 细胞侵袭能力的影响。结果表明,当CBX4敲低后,AGS 细胞和SK-GT-4 细胞侵袭能力明显下降,且具有统计学意义,见图6。
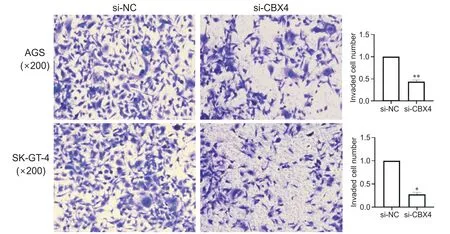
Figure 6.Effect of CBX4 silencing on the invasive ability of AGS and SK-GT-4 cells.Mean±SD.n=3.*P<0.05, **P<0.01 vs si-NC.图6 沉默CBX4对AGS和SK-GT-4细胞侵袭能力的影响
4 沉默CBX4 对Wnt/β-catenin 信号通路相关蛋白表达水平的影响
通过在线数据库GEPIA2 在线分析CBX4 与c-MYC存在正相关(P<0.05),如图7A所示。而c-MYC是Wnt/β-catenin 信号通路的重要分子,在多种肿瘤中 起 作 用[19]。因 而 探 究CBX4 是 否 通 过Wnt/β-catenin 信号通路来调节AEG。利用Western blot 实验检测沉默CBX4是否与Wnt/β-catenin 通路中相关蛋白的表达量相关。结果表明当CBX4基因敲低后,在AGS 和SK-GT-4 细胞中CBX4 的表达下降,β-catenin 以及下游靶基因c-MYC、cyclin D1 的蛋白表达水平明显下降,见图7。

Figure 7.The effect of CBX4 knockdown on the expression of Wnt/β-catenin signal pathway-related proteins.Mean±SD.n=3.*P<0.05, **P<0.01 vs si-NC.图7 沉默CBX4后Wnt/β-catenin信号通路相关蛋白表达的变化
讨 论
AEG 作为一种多因素导致的疾病,具体病因尚不明确[20],可能与遗传因素、环境因素、胃食管反流病、肥胖等多种因素有关[21]。但与其他部位的胃癌相比,食管胃交界处的肿瘤更容易出现胃壁深部浸润、淋巴结转移和术后复发[22]。因此将食管胃结合部腺癌作为一种独立的疾病进行研究[23]。目前基因靶向治疗已经逐渐成为很多疾病的治疗方向,而导致AEG 发展的确切机制仍不清楚,针对AEG 的靶向治疗仍未取得很好的进展。因此,研究新的治疗靶点对于为AEG提供新的治疗方向至关重要。
CBX4 是一种参与肿瘤发生和细胞周期调控的特异性PCG 蛋白[22],其在不同类型的肿瘤中表达有所不同,并具有不同的生物学功能。CBX4在肿瘤中的作用首次在肝细胞癌中发现,Wang 等[13]研究发现:CBX4 在肝细胞肝癌中表达增高; Jiang 等[14]研究发现在肾透明细胞癌中CBX4 表达显著增加;但是Xiong 等[24]研究发现在慢性粒细胞白血病中,发现CBX4表达量在患者外周血白细胞表达低于正常人。尽管如此,关于CBX4 在AEG 中的表达至今未有报道。在本研究中,通过对22 对AEG 组织进行高通量测序的结果进行分析,发现CBX4 可能是促进AEG发展的核心分子,因而后续实验中,利用RT-qPCR对40 对AEG 组织以及配对的正常组织进行CBX4 表达量的检测,结果表明,CBX4 在40 对AEG 组织中表达明显高于正常组织。说明CBX4 在AEG 中可能起促进发展的作用。
HU 等[10]研究提示与正常肺组织相比,CBX4 在肺肿瘤中高度表达。且CBX4表达高时,肿瘤细胞的增殖和迁移能力显著增强;相反,表达量下降时,人肺癌细胞生长和迁移明显受到抑制。因而本研究进一步检测正常细胞与AEG 细胞系中CBX4 的表达量,发现CBX4 在AEG 细胞系中表达均增高,且在检测的几种肿瘤细胞中,AGS 细胞和SK-GT-4 细胞中CBX4的表达量增高更为明显,因而选用这两种细胞完成后续实验。利用CCK-8 实验、划痕实验及Transwell 侵袭实验检测CBX4 的表达量与AEG 细胞增殖、迁移以及侵袭能力的关系,结果表明当CBX4敲低时,AEG细胞的增殖、迁移和侵袭能力显著减弱。
Wnt/β-catenin 信号通路是一种复杂的分子机制,它由一系列蛋白质组成[25],具有高度的保守性和严格的控制性,能够调节胚胎发育、细胞增殖和分化过程[26],并且在某些情况下会引起异常激活。其异常激活会导致细胞增殖失控,加速细胞的分化和迁移[27],因而经常与发病率的提高、疾病进一步恶化、预后不良,甚至包括肿瘤相关死亡率上升等因素密切相关[28]。β-catenin 是Wnt/β-catenin 通路的重要调控因子[29],当该信号通路被激活时抑制β-catenin 降解,导致细胞内β-catenin 大量聚集,进入到细胞核内,诱导下游靶基因c-MYC和cyclin D1的转录[30]。利用GEPIA2 数据库在线分析可得CBX4 与c-MYC正相关,而c-MYC 又是Wnt/β-catenin 信号通路重要分子。进而,我们推测在AEG 中,对于Wnt/β-catenin信号通路的调控,CBX4 可能参与其中。因而,通过Western blot 法检测CBX4沉默后,β-catenin、 c-MYC和cyclin D1 表达水平是否发生变化。结果表明,当CBX4 表达下降时,在AGS 细胞和SK-GT-4 细胞中β-catenin、c-MYC和cyclin D1的表达水平均有所下降,进而提示在AEG 中CBX4 能够活化Wnt/β-catenin 信号通路促进恶行表型。
综上所述,CBX4 在AEG 细胞系中以及在AEG组织中表达升高,当CBX4 表达下降时,AEG 细胞的增殖、迁移和侵袭能力显著减弱,并且CBX4 可能是通过Wnt/β-catenin信号通路促进AEG细胞的恶行表型。此研究结果表明,沉默CBX4可能对AEG 的发生发展具有抑制作用,为AEG 患者的靶向治疗以及早期诊断提供新的参考点。
