lncRNA SNHG4/miR-152-3p对HepG2细胞增殖、凋亡及免疫因子的影响*
2023-11-02熊明月谢喜科易廷庄
贺 娟 熊明月 谢喜科 易廷庄
1.右江民族医学院研究生院 (广西 百色, 533000) 2.百色人民医院血液科 3.右江民族医学院附属医院肿瘤科
肝癌是比较常见的恶性肿瘤,其死亡率、发病率居高不下,外科手术切除是肝癌治疗的主要途径,但是术后癌细胞复发、转移依然较高,这也是导致肝癌预后不良的原因[1]。肝癌细胞异常增殖分化、转移及凋亡阻碍是肝癌发生的原因,免疫逃避也是影响其恶性进展的原因,这些免疫系统可以识别癌细胞,通过调动免疫反应进而杀死肿瘤细胞,以达到抗肿瘤的目的[2,3]。长链非编码RNA(lncRNA)一种具有多功能特征的非编码RNA,在不同组织及细胞内差异表达,不仅与肿瘤细胞增殖、凋亡等过程有关,还与肿瘤免疫逃避有关[4]。研究报道显示,SNHG4可参与肿瘤恶性进展,在结直肠癌中表达上调,SNHG4可通过调控miR-144-3p表达抑制结直肠癌细胞增殖、迁移、侵袭和免疫逃避,及诱导细胞凋亡[5]。有报道发现,SNHG4在肝癌组织内高表达,与组织学分级、肿瘤分期、生存率相关,可作为肝癌预后独立因子[6],但其对肝癌细胞的具体作用机制不清楚。在线数据库预测显示,miR-152-3p是SNHG4靶基因,有报道显示,miR-152-3p可作为肝癌抑癌基因,miR-152-3p可通过靶向负调控ROBO1抑制肝癌细胞增殖和促进凋亡,且与免疫相关分子呈正相关[7]。关于SNHG4能否调控miR-152-3p对肝癌细胞的研究未经报道,鉴于此,本研究主要探究lncRNA SNHG4可能通过调控miR-152-3p对肝癌细胞增殖、凋亡及免疫因子的影响。
1 材料与方法
1.1 细胞和主要试剂 人肝癌细胞(HepG2、SNU-398、Hep3B)、人永生化正常肝细胞(THLE-2)购于美国ATCC公司;Lipofectamine 3000试剂盒、TRlzol试剂盒、逆转录试剂盒购于Thermo Fisher公司;胎牛血清、DMEM培养基购于美国Gibco公司;si-NC、si-SNHG4、miR-NC、miR-152-3p、anti-miR-NC、anti-miR-152-3p、pcDNA、pcDNA-SNHG4、引物购于上海吉玛公司;2×SYBR Green qPCR试剂盒购于大连宝丰生物公司;CCK8试剂盒、凋亡试剂盒购于上海碧云天公司;RIPA裂解液、双荧光素酶报告基因试剂盒、BCA试剂盒、化学发光试剂购于北京索莱宝公司;PCNA抗体、Bcl-2抗体、Bax抗体、GAPDH、HRP偶联二抗IgG购于美国Abcam公司;TNF-α试剂盒、IL-6试剂盒购于北京达科为生物有限公司。
1.2 细胞培养、分组 人肝癌细胞(HepG2、SNU-398、Hep3B)、THLE-2均培养在含有胎牛血清的DMEM培养基内,置于5% CO2、37℃培养箱内培养。取对数生长期HepG2细胞,接种于96孔板中,细胞融合为85%时,参照Lipofectamine 3000试剂盒说明书将si-NC、si-SNHG4、miR-NC、miR-152-3p、si-SNHG4与anti-miR-NC、si-SNHG4与anti-miR-152-3p转染细胞内,6 h更换细胞培养液,分别记为si-NC组、si-SNHG4组、miR-NC组、miR-152-3p组、si-SNHG4+anti-miR-NC组、si-SNHG4+anti-miR-152-3p组。
1.3 qRT-PCR法检测SNHG4、miR-152-3p表达水平 TRlzol法分离肝癌细胞(HepG2、SNU-398、Hep3B)、THLE-2以及各组HepG2细胞(培养24 h)内总RNA,然后合成cDNA模板,用2×SYBR Green qPCR试剂盒在ABI7000仪器上进行扩增反应。2-ΔΔCt方法计算SNHG4、miR-152-3p表达水平,以GAPDH和U6作为内参。SNHG4正向引物:5′-AGGTCGGCCGCAT-GCTACGG-3′,反向引物:5′-TCAAACGATCCGCGCTACGAG-CG-3′;GAPDH正向引物:5′-CTCAGCATCGACGATCAC-GC-3′,反向引物:5′-CTAGCTGCATCGATCAGCGTC-3′。miR-152-3p正向引物:5′-GCAGTCAGTGCATGACAGA-3′,反向引物:5′-GTCCAGTTTTTTTTTTTTTTTCCAAG-3′;U6 正向引物:5′-CTCG-CTTCGGCAGCACA-3′,反向引物:5′-ACGCTTCACGAATTT-GCGT-3′。
1.4 CCK8法检测细胞活性 将各组HepG2细胞以1×103个接种于96孔板中,培养48 h后加CCK8试剂(10 μl/孔),继续培养2 h,用酶标仪检测450 nm处吸光度值(A)。细胞活性(%)=A实验组/A对照组×100%。
1.5 流式细胞术检测细胞凋亡 各组HepG2细胞培养24 h后用PBS清洗,加胰酶消化后,使用结合缓冲液100 μl 制成单细胞悬液,并加入5 μl的Annexin V-FITC和PI试剂,避光反应20 min,最后加400 μl 结合缓冲液,上流式细胞仪检测细胞凋亡率。
1.6 Western blot法检测PCNA、Bcl-2、Bax蛋白表达 使用RIPA裂解液从各组HepG2细胞内提取细胞总蛋白,并进行定量分析,按照BCA法进行,用10% SDS-PAGE凝胶分离样品(30 μg),分离结束转移PVDF膜上,37℃封闭在脱脂奶粉中1.5 h,与一抗PCNA(1∶800稀释)、Bcl-2(1∶800稀释)、Bax(1∶500稀释)、GAPDH(1∶1 000稀释)4℃下过夜,次日37℃下与HRP偶联二抗IgG(1∶5 000稀释)孵育1.5 h,加化学发光试剂使其显色,曝光。用ImageJ分析蛋白条带灰度值。
1.7 ELISA法检测TNF-α、IL-6表达水平 各组HepG2细胞培养24 h,离心后按照TNF-α试剂盒、IL-6试剂盒操作步骤,检测上清液中TNF-α、IL-6表达水平。
1.8 双荧光素酶报告实验验证SNHG4和miR-152-3p靶向关系 在线数据库预测显示miR-152-3p与SNHG4存在互补的结合位点,并构建SNHG4野生型、突变型质粒,将其克隆至pGL3载体上,即为SNHG4 WT、SNHG4 MUT,然后分别与miR-NC、miR-152-3p共转染至HepG2细胞内,在24孔板中进行孵育,48 h收集细胞,使用双荧光素酶报告基因试剂盒检测各组荧光素酶活性。将pcDNA、pcDNA-SNHG4转染HepG2细胞内,培养48 h,按照qRT-PCR方法检测SNHG4、miR-152-3p表达水平。
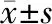
2 结果
2.1 肝癌细胞SNHG4和miR-152-3p中的表达 与THLE-2细胞比较,肝癌细胞HepG2、SNU-398和Hep3B内SNHG4表达水平显著增加(P<0.05),miR-152-3p表达水平显著降低(P<0.05),其中HepG2细胞SNHG4和miR-152-3p表达水平差异较大,故选择HepG2细胞进行实验。见表1。

表1 SNHG4和miR-152-3p在肝癌细胞中的表达
2.2 SNHG4调控miR-152-3p的表达 SNHG4和miR-152-3p互补核苷酸序列见图1。与miR-NC组比较,miR-152-3p组内SNHG4 WT荧光素酶活性显著降低(P<0.05)。见表2。与pcDNA组比较,pcDNA-SNHG4组内SNHG4表达水平显著增加(P<0.05),miR-152-3p表达水平显著降低(P<0.05)。见表3。

图1 SNHG4和miR-152-3p互补核苷酸序列

表2 双荧光素酶报告实验

表3 转染SNHG4在HepG2细胞中SNHG4、miR-152-3p表达
2.3 干扰SNHG4对HepG2细胞增殖、凋亡和免疫因子表达的影响 与si-NC组比较,si-SNHG4组内SNHG4表达水平、细胞活性、TNF-α、IL-6表达水平显著降低,细胞凋亡率显著增加(P<0.05),而PCNA、Bcl-2蛋白表达显著降低(P<0.05),Bax蛋白表达显著增加(P<0.05)。见图2,表4。

表4 沉默SNHG4对HepG2细胞增殖、凋亡和免疫因子表达的影响
2.4 过表达miR-152-3p对HepG2细胞增殖、凋亡和免疫因子表达的影响 与miR-NC组比较,miR-152-3p组内miR-152-3p表达水平、细胞凋亡率显著增加(P<0.05),细胞活性、TNF-α、IL-6表达水平显著降低,而PCNA、Bcl-2蛋白表达显著降低(P<0.05),Bax蛋白表达显著增加(P<0.05)。见图3,表5。

图3 过表达miR-152-3p对HepG2细胞增殖、凋亡的影响 (A.凋亡图;B.PCNA、Bcl-2、Bax蛋白表达)

表5 过表达miR-152-3p对HepG2细胞增殖、凋亡和免疫因子表达的影响
2.5 抑制miR-152-3p可逆转干扰SNHG4对HepG2细胞增殖、凋亡和免疫因子表达的影响 与si-SNHG4+anti-miR-NC组比较,si-SNHG4+anti-miR-152-3p组内miR-152-3p表达水平、细胞凋亡率显著降低(P<0.05),细胞活性、TNF-α、IL-6表达水平显著增加,而PCNA、Bcl-2蛋白表达显著增加(P<0.05),Bax蛋白表达显著降低(P<0.05)。见图4,表6。

图4 抑制miR-152-3p可逆转干扰SNHG4对HepG2细胞增殖、凋亡的影响 (A.凋亡图;B.PCNA、Bcl-2、Bax蛋白表达)

表6 抑制miR-152-3p可逆转干扰SNHG4对HepG2细胞增殖、凋亡和免疫因子表达的影响
3 讨论
lncRNA在真核细胞内广泛表达,已被确定是多种细胞的调节因子,从而发挥在肿瘤内的作用,其有望成为肿瘤诊断和治疗的生物作用靶点[8,9]。近年的研究结果显示,lncRNA可通过发挥分子海绵作用吸附下游miRNA进而调控mRNA表达,从而参与肿瘤细胞的恶性生物学过程及免疫逃避[10]。研究结果显示,非小细胞肺癌细胞中SOX2-OT高表达,SOX2-OT通过靶向调控miR-30d-5p/PDK1轴促进非小细胞肺癌细胞增殖、迁移、侵袭及免疫逃避,抑制细胞凋亡[11]。肺癌细胞中LINC01140表达下调,LINC01140可通过直接调控miR-33a-5p和miR-33b-5p促进肺癌细胞恶性生物学过程,及免疫逃避[12]。有报道显示,Hotair在喉鳞状细胞癌细胞中高表达,敲低Hotair可通过调控miRNA-30a/GRP78/PD-L1轴促进喉鳞状细胞癌凋亡,并抑制细胞增殖和免疫逃避[13]。SNHG4是lncRNASNHG家族成员,在胃癌、前列腺癌、结直肠癌、骨肉瘤等癌症中高表达,可参与多种肿瘤进展[14,15]。有报道发现,结直肠癌组织及细胞内SNHG4表达上调,SNHG4可通过调节miR-590-3p/CDK1轴促进结直肠癌组织和周期发展[16]。还有研究通过筛选肝癌细胞焦亡相关LncRNA发现,SNHG4表达增加[17],但是具体作用不清楚。本研究结果显示,SNHG4在HepG2细胞中高表达,干扰SNHG4能降低HepG2细胞活性、PCNA、Bcl-2蛋白表达,并增加凋亡率及Bax蛋白表达,提示干扰SNHG4可抑制HepG2细胞增殖和促进凋亡,其有望成为肝癌生物标志物。肿瘤免疫逃避也是肿瘤发生的主要因素之一,TNF-α、IL-6等细胞因子,可作为免疫抑制因子参与肿瘤细胞免疫逃避[18]。本研究显示,干扰SNHG4可降低HepG2细胞中TNF-α、IL-6表达水平,表明SNHG4可抑制HepG2细胞免疫因子表达。
本研究结果证实了SNHG4能靶向负调控miR-152-3p的表达。miR-152-3p在多种癌症中表达下调,并可通过调控下游mRNA或信号通路促进肿瘤细胞恶性进展[19-21]。研究结果显示,在肝癌组织中miR-152-3p表达下调,并与CDK8呈负相关,可通过靶向调控CDK8抑制肝癌细胞增殖和促进凋亡[22]。还有报道显示,在肝癌复发患者组织内miR-152-3p表达下调,并通过靶向AKAP1、FOXRED1等影响肝癌发展,提示miR-152-3p有望成肝癌作用靶点[23]。本研究显示,在HepG2细胞中miR-152-3p低表达,过表达miR-152-3p降低HepG2细胞活性、PCNA、Bcl-2蛋白表达,及TNF-α、IL-6表达水平,并增加凋亡率及Bax蛋白表达,提示过表达miR-152-3p抑制HepG2细胞增殖和免疫因子表达,并促进细胞凋亡。进一步实验显示,抑制miR-152-3p可减弱干扰SNHG4对HepG2细胞增殖、凋亡和免疫因子表达的影响,表明SNHG4能靶向负调控miR-152-3p发挥在肝癌中的作用。
综上所述,SNHG4在HepG2细胞内表达上调,干扰SNHG4抑制HepG2细胞增殖和免疫因子表达,促进细胞凋亡,其作用机制可能与调控miR-152-3p有关。
