糙皮侧耳PoEgt2基因克隆及不同发酵时期表达水平分析
2023-11-01夏海华胡基华闫更轩
田 缘,潘 钰,于 冲,夏海华,胡基华,毛 雪,闫更轩
黑龙江省科学院微生物研究所,黑龙江哈尔滨 150010)
糙皮侧耳(Pleurotusostreatus)又名平菇,为侧耳科侧耳属真菌,是一种价廉、味美、质优的食药兼用真菌[1],除含丰富的营养物质外,还具有抗氧化[2]、降血糖[3]、抗肿瘤[4]等多种药物功效。糙皮侧耳能产生丰富的生物活性代谢产物,包括甾体类、酚类等次生代谢产物及氨基酸、多糖等多种初生代谢产物[5-7],是洛伐他汀、木聚糖酶等多种活性物质的重要生产来源[8]。
作为糙皮侧耳合成的重要次级代谢产物,麦角硫因具有抗衰老、抗氧化、抗炎症、延长细胞生存周期、促进神经细胞形成等多种功效[9-12]。由于麦角硫因制备成本较高,因此其应用大多局限于高端化妆品和营养补充剂中。通过生物合成法制备麦角硫因具有原料易获取、产量可提升等优势,生产菌种的选择对于麦角硫因的制备至关重要[13]。研究发现,通过糙皮侧耳发酵生产麦角硫因的水平可达0.2 g/L以上[14],但其发酵产量仍有提升的空间。尽管糙皮侧耳在生产麦角硫因上具有一定优势,但糙皮侧耳中麦角硫因的合成关键酶基因尚不明确。结合已有研究,推测为可编码具有甲基转移酶与亚砜合酶活性的双功能酶EGT1与PLP结合型C-S裂解酶EGT2[15]。笔者拟利用逆转录-聚合酶链式反应(RT-PCR)扩增糙皮侧耳的PoEgt2基因,通过采用生物信息学方法进行序列功能分析,并探究其在糙皮侧耳不同发酵阶段的基因表达情况,旨在为高产麦角硫因的糙皮侧耳菌种改良提供理论基础。
1 材料与方法
1.1 材料
1.1.1菌种。糙皮侧耳选育自黑龙江省科学院微生物研究所菌种保藏中心“黑威平菇1号”。
1.1.2试剂和仪器。马铃薯葡萄糖水培养基购自海博生物技术有限公司,总RNA提取试剂盒、无缝克隆试剂盒购自Tiangen公司,反转录试剂盒PrimeScript RT Reagent Kit及PCR试剂盒PremixTaq购自Takara公司,DH5α大肠杆菌感受态细胞、胶回收试剂盒及质粒提取试剂盒购自康为世纪有限公司,SOC培养基、氨苄青霉素购自索莱宝公司,克隆载体pMD19-T购自Takara公司,引物合成及测序服务由上海生工生物工程有限公司提供。
1.2 试验方法
1.2.1糙皮侧耳的全基因组测序。糙皮侧耳培养选用马铃薯葡萄糖水液体培养基,挑取“黑威平菇1号”斜面菌种约 1 cm2接种至液体培养基,25 ℃160 r/min摇瓶培养5~7 d至可见明显菌丝。糙皮侧耳菌种的全基因组测序委托上海生工生物有限公司完成。
1.2.2基因的克隆。通过对糙皮侧耳基因组进行分析,筛选到一个egt2基因。使用Prime Premier 6.0软件设计蛋白编码区(CDS)全长引物,并委托上海生工生物有限公司合成。引物序列为F(5′-atgctacagtacttttcatttgagc-3′)、R(5′-ctagtccgcgaagaacttcga-3′),提取糙皮侧耳总RNA进行反转录。以反转录获得的cDNA作为模板,PCR扩增获得egt2全长。PCR反应条件为:94 ℃预变性3 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s,35个循环;最后72 ℃终延伸5 min。
PCR产物通过1.0%琼脂糖凝胶电泳检测,经胶回收纯化后,连接至pMD19-T克隆载体上。连接产物转化至大肠杆菌感受态细胞DH5α中,于含氨苄青霉素的SOC琼脂平板上培养,挑取单克隆进行菌落PCR鉴定,阳性菌落送至生工生物工程有限公司完成测序。
1.2.3生物信息学分析。基因的开放阅读框。用ProtParam(https://web.expasy.org/protparam/)预测基因编码蛋白的分子量和等电点等;利用ProtScale软件(https://web.expasy.org/protscale/)分析氨基酸序列的疏/亲水性;利用SWISS-MODEL(https://swissmodel.expasy.org/)绘制蛋白质的三维结构图;利用NCBI的BLASTP(https://blast.ncbi.nlm.nih.gov/)完成蛋白质的同源性分析。
1.2.4qRT-PCR检测PoEgt2在不同发酵时期的表达模式。利用试剂盒分别提取糙皮侧耳不同发酵时期(2、4、6、8、10 d)的菌丝体总RNA,反转录合成cDNA,然后利用qRT-PCR检测PoEgt2基因在不同发酵条件下的表达量。qRT-PCR的引物为qF(5′-TTCGCCTTACCTGAGTGTCTGTG-3′)、qR(5′-GCAATAGTCGTTGATCGCCTGTTC-3′),以糙皮侧耳β肌动蛋白(β-actin)基因作为内参基因,参照Takara TB GREEN I试剂盒说明书,利用ABI Step-one荧光定量PCR仪进行扩增。qRT-PCR反应条件为:95 ℃变性10 min;95 ℃变性15 s,55 ℃退火1 min,72 ℃延伸40 s,40个循环。基因相对表达量根据2-ΔΔCt方法计算。
2 结果与分析
2.1PoEgt2基因克隆提取糙皮侧耳菌丝体的总RNA,以糙皮侧耳“黑威1号”菌丝体提取的RNA反转录合成的 cDNA 为模板,以PoEgt2-F和PoEgt2-R为引物扩增获得约1 600 bp的目的片段(图1),PCR产物经胶回收后,与pMD19-T克隆载体连接,并转化至大肠杆菌DH5α感受态中。转化菌涂布于平板后,挑取单菌落进行测序分析,结果显示该片段大小为1 641 bp,编码氨基酸546个(图2)。
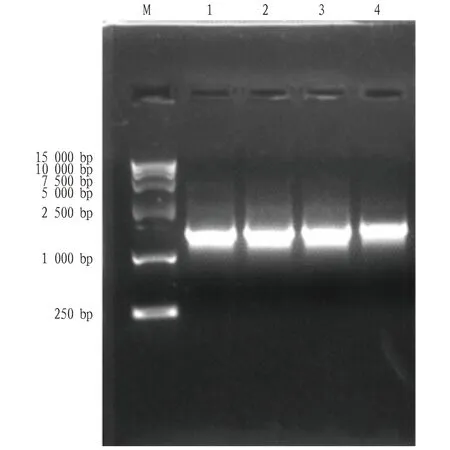
注:M.Marker;1~4. PoEgt2基因PCR产物。Note: M. Marker; 1-4. PoEgt2 gene PCR product.图1 糙皮侧耳PoEgt2扩增凝胶电泳图Fig.1 The identification results of PCR of PoEgt2

图2 PoEgt2基因序列和蛋白质序列Fig.2 PoEgt2 gene sequence and protein sequence
2.2PoEgt2基因生物信息学分析PoEgt2编码蛋白质的理化分析结果表明,推测分子质量为60.48 kD,其理论等电点为8.13,脂肪指数为90.37,亲水性的平均值是-0.030;带负电荷的残基总数是44,带正电荷的残基总数为48,不稳定性指数(Ⅱ)为51.36,该蛋白为不稳定蛋白,未预测到跨膜区和信号肽。用ProtScale在线程序对其亲疏水性、蛋白二级结构进行预测,推测其为亲水性蛋白(图3),其二级结构由40.82% α-螺旋、19.85% β-折叠构象延伸链和33.15%无规则卷曲组成(图4)。SWISS-MODEL构建的EGT2蛋白的三级结构(图5),可见糙皮侧耳EGT2蛋白与已报道的来源于粗糙脉孢霉的C-S裂解酶EGT2相似度为29.93%。
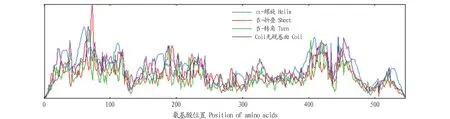
图3 EGT2蛋白亲疏水性预测结果Fig.3 Predicted hydrophobicity and hydrophilicity properties of EGT2 protein
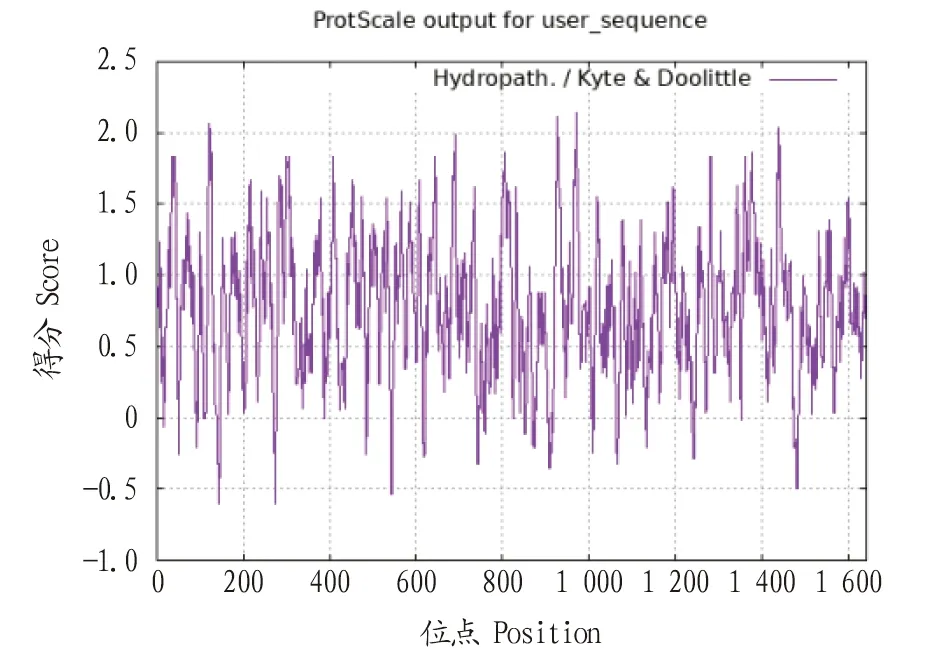
图4 EGT2蛋白的二级结构预测结果Fig.4 Predicted secondary structure of EGT2 protein
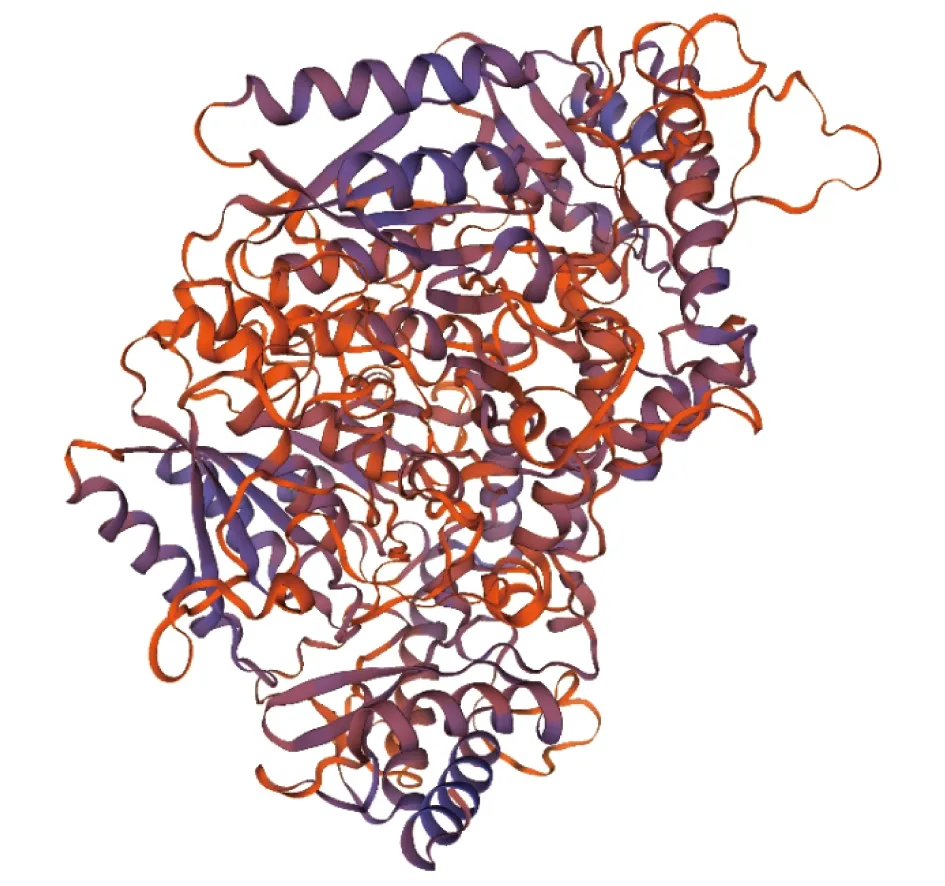
图5 EGT2蛋白的三级结构预测结果Fig.5 Predicted tertiary structure of EGT2 protein
在NCBI上利用BLASTP对糙皮侧耳的EGT2氨基酸序列进行同源序列分析,选择不同物种同源性较高的序列进行比对发现,与其同源性最高的是侧耳属下的真菌,如白黄侧耳(KAG9224528.1,62.45%),刺芹侧耳(KAF9493115.1,57.88%),而同源性最高的非侧耳属菌为白蛋巢属的平滑白蛋巢菌(TFK33142.1,40.58%)。然而,对PoEgt2的BLASTN结果显示,与其他属的真菌序列相似性较低。
2.3PoEgt2在不同发酵时期的表达模式为探究PoEgt2在糙皮侧耳发酵生产麦角硫因不同时期的表达情况,使用qRT-PCR方法对其进行定量分析(图6),结果发现,PoEgt2在糙皮侧耳发酵4 d时表达量最高,而在糙皮侧耳发酵10 d时表达量最低,且从发酵4 d开始,PoEgt2的表达水平随时间的延长逐渐下降。

图6 PoEgt2在糙皮侧耳生产麦角硫因不同发酵时期的表达模式Fig.6 Expression levels of PoEgt2 in the production of ergothioneine from Pleurotus ostreatus at different fermentation stages
3 结论与讨论
麦角硫因是一类具有较强抗氧化活性的次级代谢产物,主要来源于大型真菌和部分原核细菌,现已应用于保健食品和高端化妆品中,具有较强的市场潜力[16]。当前麦角硫因的获取来源主要为食用菌的子实体,但原材料制备和分离成本高昂,不宜进行产业化[17]。工业化生物发酵有望成为麦角硫因的主流生产方式,然而麦角硫因的生物合成途径相对复杂,不同物种的合成方式有较大差异[18],且由于麦角硫因主要存在于大型食用菌中,后者作为底盘菌株进行遗传改造的难度较大,发酵周期长,进一步限制了麦角硫因的低成本规模化生产[19]。糙皮侧耳是能够合成麦角硫因的常见食用菌之一,其培养成本低,未经改造发酵水平即可达到102 mg/L(培养4 d),因此有作为底盘菌株进行改良生产麦角硫因的潜力[20]。据报道,麦角硫因的合成主要涉及Egt1和Egt2两个关键酶,在Fe2+和O2存在的条件下,Egt1催化组氨酸甜菜碱和半胱氨酸合成组氨酸甜菜碱半胱氨酸亚砜,再由Egt2催化组氨酸甜菜碱半胱氨酸亚砜转化为麦角硫因[21]。该研究主要进行了PoEgt2基因的克隆、生物信息学和表达水平分析,以期为后期糙皮侧耳的菌种改良提供基因资源和科学依据。
该研究从糙皮侧耳内克隆获得了PoEgt2基因,生物信息学分析显示编码546个氨基酸,编码蛋白的分子质量为60.48 kD。理论等电点为8.13,为亲水性蛋白,且未预测到跨膜区或信号肽。二级结构由40.82% α-螺旋、19.85% β-折叠构象延伸链和33.15%无规则卷曲组成,由于信号肽是分泌性蛋白的决定性因子,结合Egt2生物学功能,故推测Egt2为非分泌性蛋白。糙皮侧耳Egt2蛋白和粗糙脉孢霉的C-S裂解酶Egt2相似度为29.93%,推测其生物学活性存在差异。通过BLASTP对Egt2蛋白进行比对分析发现,来源于糙皮侧耳的蛋白序列和其他侧耳属Egt2蛋白同源性较高,而与非侧耳属菌的Egt2蛋白同源性较低。糙皮侧耳的发酵生长时期对Egt2的表达存在影响,其中在糙皮侧耳发酵4 d时表达量最高,随后逐渐下降,反映麦角硫因在不同发酵时期的合成速率可能存在差异,后续将对底物利用率、组氨酸甜菜碱半胱氨酸亚砜水平进行测定,以明确麦角硫因的最佳合成时期,为发酵条件的优化提供科学依据。
