基于PI3K/AKT信号通路探讨琥珀散对子宫内膜异位症小鼠的影响及作用机制研究
2023-11-01孙新慧郭亚楠霍超越林陶秀ROBERTSSONGZE张文娟何甜甜张晨赛佳洋马小娜
孙新慧 郭亚楠 霍超越 林陶秀 ROBERTS SONG ZE 张文娟 何甜甜 张晨 赛佳洋 马小娜
子宫内膜异位症(endometriosis,EMs),简称内异症,是指具有活性的子宫内膜组织(间质和腺体)出现在子宫腔被覆内膜及宫体肌层以外的部位[1]。是临床中引起女性痛经、盆腔痛及不孕的主要原因之一。EMs的发病率为15%~20%,并且呈逐渐升高的趋势[2]。其归属于中医“痛经”“癥瘕”“月经过多”“不孕”等范畴[3]。
琥珀散出自《普济本事方》,又称“本事琥珀散”,原方由三棱、莪术、当归、赤芍、熟地黄、刘寄奴、丹皮、肉桂、菊花、蒲黄组成,另有去菊花、蒲黄,而用乌药、延胡索者,全方具有行气活血、温经止痛之功效,临床可作为治疗寒凝血瘀型EMs的有效方[4]。课题组前期的临床研究表明,琥珀散治疗子宫内膜异位症疗效确切[5]。前期实验研究表明琥珀散可降低内膜组织中的免疫因子(T helper cells,Th)1/Th2,降低基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)和组织基质金属蛋白酶抑制剂-2(tissue inhibitor of metalloproteinase-2,TIMP-2)的含量、改善局部微环境,抑制内膜细胞的粘附、侵袭、血管生成,以起到干预内异症的作用[6-9]。此外,有研究显示,在EMs模型中,异位的内膜磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/AKT)信号通路被激活,从而使得血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达得以增强,并且促进异位内膜的浸润及种植,推进EMs的发生和发展[10]。并且,我们通过网络药理学发现琥珀散治疗子宫内膜异位症与PI3K/AKT信号通路密切相关[11]。因此,本实验主要研究琥珀散是否通过影响该信号通路而发挥对EMs的多靶点调控作用,为中医药防治EMs提供新思路。
1 材料与方法
1.1 实验动物及实验环境
选择无特定病原体(specificpathogenfree,SPF)级,6~8周龄的雌性BALB/c小鼠60只,体质量18~22 g,性周期4~5天。购于京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2016-0006。饲养于北京中医药大学动物实验室。条件:室内温度设定在20℃,湿度设定为60%,清洁度Ⅱ级,常规适应性饲养1周。方案经北京中医药大学动物伦理委员会批准,伦理审批号:BUCM-4-2021021501-1098。
1.2 实验药物
中药琥珀散配方颗粒(三棱10 g、莪术10 g、赤芍15 g、刘寄奴10 g、牡丹皮10 g、肉桂6 g、当归10 g、熟地黄15 g、延胡索12 g、乌药15 g)购自北京中医药大学第三附属医院颗粒药房,由北京康仁堂药业有限公司提供,配成溶液(1 mL药液中约含1.6 g生药),4℃冰箱存用;西药将PI3K激酶抑制剂(LY294002,商品编号:A8250-50 mg),溶于二甲基亚砜(DMSO,商品编号:D2650-100 mL)中备用。
1.3 主要实验试剂与仪器
0.9%氯化钠溶液,碘伏,苏木素染液,伊红染液,4%多聚甲醛,二甲基亚砜(DMSO,商品编号:D2650-100 mL)、PI3K激酶抑制剂(LY294002,商品编号:A8250-50 mg),ELISA试剂盒:小鼠丝裂原激活蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)ELISA试剂盒(商品编号:MB-6481A)、小鼠血管内皮生长因子A(vascular endothelial growth factor-A,VEGF-A)ELISA试剂盒(商品编号:MB-6044A)、小鼠肿瘤蛋白p53(TP53)ELISA试剂盒(商品编号:MB-6476A)、小鼠RACa丝氨酸苏氨酸蛋白激酶B1(serine/threonine protein kinase 1,AKT1)ELISA试剂盒(商品编号:MB-6473A),由北京百诺威生物科技有限公司提供。免疫组化抗体:Anti-pan-AKT抗体(货号:60203-2-Ig),Anti-PI3Kinase p85 beta抗体(货号:67644-1-Ig),由北京百诺威生物科技有限公司提供。
病理切片机(德国徕卡公司,型号RM2235),组织摊片机(浙江省金华市科迪仪器设备有限公司,型号KD-P),冻台(武汉俊杰电子有限公司,型号JB-L7),烤片机(常州国华电器有限公司,型号DB-B2),烤箱[邦西仪器科技(上海)有限公司,型号101-1BS],倒置显微镜(日本尼康,型号Nikon Ci-S)。
1.4 建立小鼠模型
脱颈椎法处死捐赠BALB/c小鼠,将小鼠仰卧位固定于手术台,用酒精将腹部消毒后,沿小鼠腹部正中线剖开腹腔,完整将其子宫取出,将子宫的浆肌层及其周围的脂肪组织剔除,放入装有10 mL的37℃生理盐水的培养皿中,漂洗表面的血迹、浆肌层和脂肪碎屑后,将子宫一分为二,将两个子宫角分别放入培养皿中,将其直接剪碎成约1 mm3大小的小碎片,并将此小碎片溶于1 mL的37℃生理盐水中。酒精消毒接受鼠腹部后,于脐下0.5 cm偏正中线0.5 cm处的左下腹为进针点,将溶有子宫内膜碎片的1 mL生理盐水注入接受鼠的腹腔。手术全程在无菌条件下进行,全程操作在5分钟内完成[12]。造模后3周后将40只小鼠随机分成4组,在各组中随机挑选3只开腹观察异位病灶的位置、形态等情况。
1.5 动物分组及给药
将60只BALB/c小鼠随机分为捐赠鼠20只,实验鼠40只,再将40只实验鼠随机分为正常组、疾病模型组、琥珀散组、西药组,每组10只。琥珀散组按成人临床用药量等效量的2倍给予14.3 g/kg灌胃,连续给药4周;西药组将LY294002溶于DMSO后腹腔注射,以0.04 g/kg进行计算,每周腹腔注射一次,给药4周[13];正常组、模型组给予相同体积的生理盐水灌胃,连续给药4周。待灌胃结束后,由于小鼠存在个体差异、耐受性差等原因,取材时正常组小鼠余7只,疾病模型组小鼠余7只,琥珀散组小鼠余7只,西药组小鼠余6只。
1.6 取材及实验检测
在给药结束后的第2天进行实验取材。各组小鼠眼球后取血,3 000 r/min离心15分钟,取上层血清装入PE管,-80℃冰箱冻存。各组小鼠采用脊椎脱臼法处死后,开腹探查异位病灶生长情况,正常组取子宫,其余各小鼠取在位子宫内膜和异位病灶,各组组织标本分割后置入4%多聚甲醛中保存。
1.6.1 各组小鼠异位病灶观察 (1)异位病灶大体形态学比较:观察异位病灶形态并用游标卡尺测量异位病灶体积(长×宽×高,单位:mm3)并进行称重比较。(2)苏木精—伊红(hematoxylin-eosin staining,HE)染色观察在位及异位内膜组织病理学变化:取多聚甲醛固定的在位或异位内膜组织常规包埋,切片,HE染色后使用中性树胶封片,置于光学显微镜下观察、记录并拍照。
1.6.2 ELISA法检测各组小鼠血清TP53、AKT1、VEGF-A和MAPK3水平变化 参考ELISA试剂盒操作流程:以标准物的浓度为横坐标,OD值为纵坐标,计算出标准曲线的直线回归方程式,计算样品浓度,乘以稀释倍数后即可得实际样品浓度。
1.6.3 免疫组化法检测各组小鼠内膜组织中PI3K、AKT的表达 待实验结束后,每组随机选取5只小鼠进行免疫组化检测,经固定、脱水、透明、石蜡包埋后,做5 μm连续切片,操作及染色步骤均严格按照免疫组化检测试剂盒说明书进行。采用病理图像分析仪对切片进行拍照,在相同视野下对每张切片随机选取5个高倍镜视野,然后利用IPP软件进行免疫组化吸光度表达分析,测定内膜组织中PI3K、AKT的表达。
1.7 统计学方法

2 结果
2.1 各组异位EMs小鼠异位病灶观察
EMs主要病理性增殖的外在表现为异位病灶的生长及体积的变化。造模后的第21天,于各组中随机挑选 3 只子宫内膜异位症模型小鼠开腹观察,除正常组以外,其余各组均见移植物生长,造模成功率为100%。大体观察可见模型组的异位病灶体积明显增大,重量增加,异位病灶呈单个或多房样葡萄,大多数为透明样,内含大量透明或淡黄色清亮液体,质地柔软,囊泡表面覆盖着丰富的血管网,与周围组织粘连明显。与模型组相比,各治疗组异位病灶的体积减小、重量减少、内含液体减少、血管形成不明显、粘连情况也较少。见图1。

注:A为疾病模型组,B为西药组,C为琥珀散组。
2.2 各组小鼠内膜组织病理形态学变化
正常组小鼠子宫内膜结构完整、上皮细胞呈长柱状排列、整齐连续,多数为间质细胞,含有丰富的腺体和血管;疾病模型组小鼠可见异位内膜上皮细胞以低柱状细胞或立方状细胞为主,呈环形或锯齿状生长,部分区域内膜也可呈乳头状生长,且有炎性细胞的浸润,其间质层可见血管丰富,腺体数量减少,甚至消失,肌层结构不清晰。西药组和琥珀散组的异位内膜均可见不同程度的上皮细胞变薄,多为扁平状或低立方状,呈现出萎缩性改变,部分异位内膜腺上皮明显被破坏甚至消失。见图2。

注:A为正常组子宫内膜,B为疾病模型组异位灶,C为西药组异位灶,D为琥珀散组异位灶。
2.3 各组小鼠血清TP53、AKT1、VEGF-A和MAPK3的含量
与正常组相比,疾病模型组小鼠血清TP53、AKT1、VEGF-A和MAPK3的含量均显著升高(P<0.01),琥珀散组、西药组血清TP53、AKT1、VEGF-A和MAPK3的含量无明显差异(P>0.05);与疾病模型组相比,琥珀散组、西药组小鼠血清TP53、AKT1、VEGF-A和MAPK3的含量显著降低(P<0.01);与琥珀散组相比,西药组小鼠血清TP53、AKT1、VEGF-A和MAPK3的含量无明显差异(P>0.05)。见表1。

表1 各组小鼠血清TP53、AKT1、VEGF-A和MAPK3的含量
2.4 各组小鼠在位内膜组织PI3K、AKT免疫组织化学染色结果
2.4.1 各组小鼠在位内膜组织PI3K表达比较 PI3K阳性颗粒呈棕黄色,主要表达在子宫内膜、腺腔细胞核及胞浆中,少量表达在周围间质细胞中。与正常组相比,疾病模型组在位子宫内膜组织PI3K的蛋白含量表达无明显差异(P>0.05);琥珀散组、西药组小鼠在位子宫内膜组织PI3K、的蛋白含量表达无明显差异(P>0.05);与疾病模型组相比,琥珀散组、西药组小鼠在位子宫内膜组织PI3K的蛋白含量表达无明显差异(P>0.05)。结果见表2、图3。
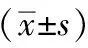
表2 各组小鼠在位内膜组织PI3K、AKT的表达

注:A为正常组;B为疾病模型组;C为西药组;D为琥珀散组。
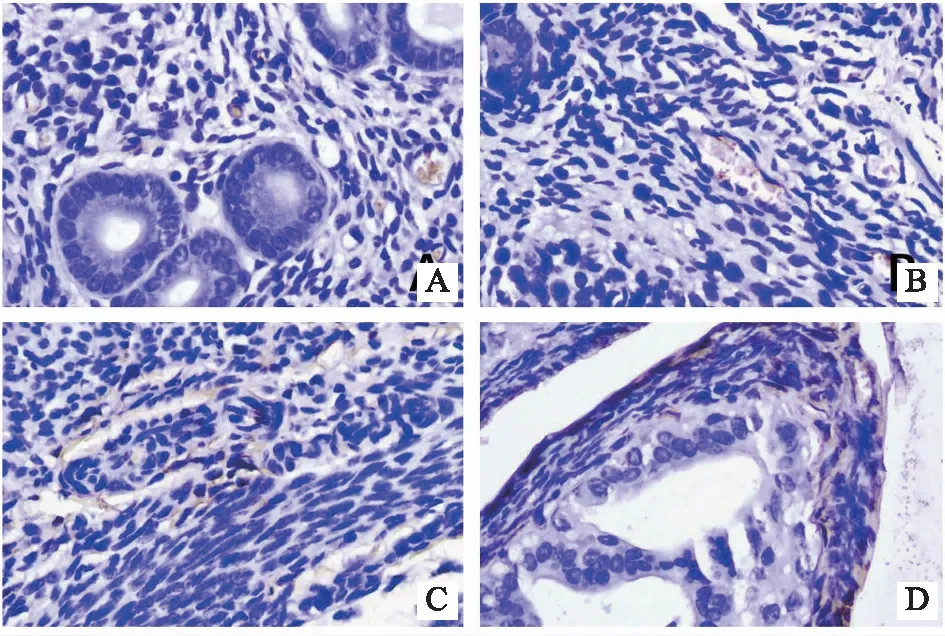
2.4.2 各组小鼠在位内膜组织AKT表达比较 AKT阳性颗粒呈棕黄色,主要表达在子宫内膜、腺腔细胞核及胞浆中,少量表达在周围间质细胞中。与正常组相比,疾病模型组在位子宫内膜组织AKT的蛋白含量表达无明显差异(P>0.05);琥珀散组、西药组在位子宫内膜组织AKT的蛋白含量表达无明显差异(P>0.05);与疾病模型组相比,琥珀散组、西药组在位子宫内膜组织AKT的蛋白含量表达无明显差异(P>0.05)。结果见表2、图4。
注:A为正常组,B为疾病模型组,C为西药组,D为琥珀散组。
2.5 琥珀散对EMs小鼠在位、异位子宫内膜组织PI3K、AKT表达的影响
2.5.1 各组小鼠在位、异位内膜组织PI3K表达比较 PI3K阳性颗粒呈棕黄色,主要表达在子宫内膜、腺腔细胞核及胞浆中,少量表达在周围间质细胞中。与正常组相比,疾病模型组异位子宫内膜组织PI3K的蛋白含量表达显著升高(P<0.01);西药组异位子宫内膜组织PI3K的蛋白含量表达无明显差异(P>0.05);琥珀散组异位子宫内膜组织PI3K的蛋白含量表达显著降低(P<0.01)。与疾病模型组相比,琥珀散组、西药组异位子宫内膜组织PI3K的蛋白含量表达显著降低(P<0.01);琥珀散组较西药组异位内膜PI3K表达显著降低(P<0.05)。结果见表3、图5。
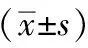
表3 各组小鼠在位、异位内膜组织PI3K、AKT的表达
注:A为正常组,B为疾病模型组,C为西药组,D为琥珀散组。
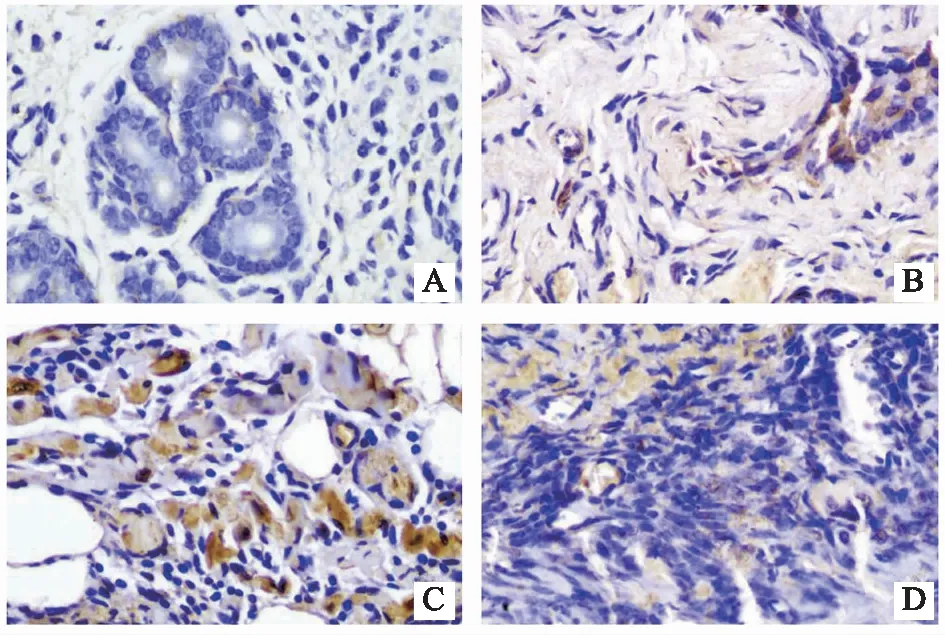
2.5.2 各组小鼠在位、异位内膜组织AKT表达比较 AKT阳性颗粒呈棕黄色,主要表达在子宫内膜、腺腔细胞核及胞浆中,少量表达在周围间质细胞中。与正常组相比,疾病模型组异位子宫内膜组织AKT的蛋白含量表达显著升高(P<0.05);西药组、琥珀散组异位子宫内膜组织AKT的蛋白含量表达无明显差异(P>0.05)。与疾病模型组相比,琥珀散组、西药组异位子宫内膜组织AKT的蛋白含量表达显著降低(P<0.01)。结果见表3、图6。

注: A为正常组,B为疾病模型组,C为西药组,D为琥珀散组。
3 讨论
中医学认为,EMs是以“正气不足”为内因,“血瘀”为外在表现的一种疾病,“瘀血”贯穿发病的始终,是其主要病理实质[14]。瘀阻胞宫,不通则痛,发为痛经;瘀阻胞络,两精不能相合,遂成不孕;瘀血日久不去,积聚腹中,固定成型,则为癥瘕[15]。基于EMs“寒凝血瘀成癥”的中医病机,课题组认为对本病的治疗应消癥散结的同时应注意调补正气,以活血化瘀、消癥散结为主,辅以疏肝解郁、温经散寒、养血益气等,如此才能使血瘀得化,寒热平调,邪去正复。
琥珀散是本课题组临床治疗EMs的常用方剂,方中三棱、莪术破血散结;官桂、乌药温里散寒,行气止痛;赤芍、当归、熟地、丹皮、延胡索养血活血,通经止痛;刘寄奴味苦性温,可破瘀除癥、活血通经、消痈散结。诸药相和,共奏温里散寒、破瘀消癥之效[11]。现代药理研究表明,EMs的病理过程与免疫炎症、氧化应激、自噬、凋亡和血管生成密切相关[16]。有研究表明,三棱具有造血功能,抗炎活性和免疫学特性[17];作为赤芍的主要药理学成分的黄芩苷可通过核因子-κB(nuclear factor kappa B,NF-κB)途径抑制人子宫内膜基质细胞的活力治疗EMs,还可显著增加G0/G1期的细胞数量,显著减少S和G2/M期的细胞数量[18-19]。本实验基于课题组的前期研究基础,主要研究琥珀散是否通过影响AKT1、TP53、VEGF-A、MAPK3细胞因子、PI3K/AKT信号通路而发挥对EMs的多靶点调控作用。
近年来有研究发现,AKT为PI3K下游的主要信号分子,亦是PI3K/AKT通路下游的重要的靶激酶,能够被PI3K诱导磷酸化蛋白激酶B(Phosphorylated-AKT,P-AKT)而被激活,P-AKT诱导核因子E2相关因子2(nuclear factory erythroid-2 related,Nrf2)与Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein,Keap1)解离并促进Nrf2核转位,然后与抗氧化响应元件(Antioxidant response element,ARE)结合而诱导抗氧化酶(SOD、CAT等)和血红素加氧酶-1(Heme oxygenase-1,HO-1)转录表达,进而抑制氧化应激反应和线粒体损伤[20],在调节细胞生长,增殖,抗凋亡,细胞侵袭和转移方面起重要作用[21]。TP53可明显调控细胞周期,与EMs有密切的相关性[22-23]。MAPK家族和其下游信号通路在调控细胞有丝分裂、迁移、代谢、粘附、侵袭、雌激素表达、细胞凋亡抑制、炎症和血管生成中具有重要地位,尤其在EMs的侵袭和转移中发挥中介和信号放大的作用,因此MAPK1和MAPK3亦是本事琥珀散的重要的干预靶点[24-25]。此外,有研究表明,PI3K/AKT途径是一种密切参与到细胞增殖、运动、凋亡、代谢和免疫应答调节的信号通路[26-27],与肿瘤的发生发展密切相关[28]。同时,亦有研究表明,EMs虽是良性妇科疾病,但其特点与恶性肿瘤的转移侵袭能力相似,子宫内膜间质细胞的活性随着AKT的活化而增强,随着AKT的抑制而减弱[29],而PI3K途径的激活可诱导血管内皮细胞生长,加速EMs的发展进程[30]。
本实验采用同种异体移植中腹腔注射法造模,操作简单,少有出血、感染死亡,有利于维持病灶组织形态和各类生化指标,使实验结果更有临床意义[31]。实验研究发现:疾病模型组血清TP53、AKT1、VEGF-A和MAPK3的含量的表达较正常组相比,均显著升高,可能与细胞周期的调控有关[22-23],琥珀散组、西药组血清TP53、AKT1、VEGF-A和MAPK3的含量表达与正常组相比无明显差异;琥珀散组、西药组血清TP53,AKT1,VEGF-A和MAPK3的含量与疾病模型组相比显著降低,这可能与诱导血管内皮细胞增长[32]、激活细胞外信号调节激酶(Extracellular signal-regulated kinase,ERK)1和ERK2,调节TSC2磷酸化[33],进而调控细胞的粘附、侵袭、转移相关[24]。此外,疾病模型组异位内膜组织PI3K、AKT的蛋白含量表达较正常组相比均显著升高,琥珀散组、西药组异位内膜组织PI3K、AKT的蛋白含量与疾病模型组相比,表达显著降低。亦有研究表明,抑制PI3K/AKT信号通路活性可能对EMs有抑制作用[34],这与本实验的研究结果相一致。
综上所述,琥珀散可下调TP53、AKT1、VEGF-A和MAPK3的表达,抑制PI3K/AKT信号通路,作用于细胞增殖、凋亡等过程,而发挥对EMs的多靶点调控作用。
