基于LC-MS技术非酒精性脂肪肝病痰湿证大鼠肝脏的脂质组学分析
2023-11-01张浩然李毓秋田琪于晗王翔宇徐琬梨
张浩然 李毓秋 田琪 于晗 王翔宇 徐琬梨
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤疾病[1],流行病学显示,NAFLD全球患病率为25%[2],严重威胁人类健康。因其关键致病因素为“痰”和“瘀”,故痰湿证是NAFLD的一种主要证型[3],且在已有的对NAFLD中医证型的临床研究中,痰湿证尤为常见。辨证论治是中医诊断学的基本原则,也是中医临床诊治的特色及核心,对个体的精准辨证与脂质组学的微观探索有异曲同工之妙。机体的生理病理改变往往伴随着代谢过程及成分的变化[4],NAFLD痰湿证的致病机制与代谢物紊乱密切相关[5],而脂质组学作为代谢组学的重要分支之一,为现代疾病的诊断提供了更有利的条件[6]。且中医证型具备多样性,根据脂质代谢在NAFLD病程中的参与作用可推断其代谢标志物可能是区别NAFLD中医证型的微观物质基础及客观化依据。但目前国内有关对NAFLD痰湿证的脂质组学分析相对较少。本研究通过液相色谱—质谱联用(liquid chromatography-mass spectrometry,LC-MS)技术检测正常组大鼠与造模后痰湿组大鼠肝脏脂质代谢物,探讨NAFLD痰湿证大鼠肝脏脂质代谢规律及特点,发现脂质代谢标志物,并探索痰湿证NAFLD证型的脂质代谢机制,有助于对NAFLD痰湿证进行精准辨证,为NAFLD痰湿证的诊断及有效防治提供新的科学依据。
1 材料与方法
1.1 仪器与试剂
仪器:液相色谱仪(Thermo Vanquish)、质谱仪(Thermo QE Focus)、冷冻离心机(湘仪 H1850-R)、混匀仪(其林贝尔 BE-2600)、真空浓缩仪(eppendorf 5305)、滤膜(Jin Teng 0.22 μm PTFE)、组织研磨器(美壁 MB-96)
试剂:甲醇(色谱纯,Thermo)、乙腈(色谱纯,Thermo)、甲酸(色谱纯,TCI)、甲酸铵(色谱纯,Sigma)、氯仿(色谱纯,沃凯)、异丙醇(色谱纯,Thermo)。
1.2 实验动物
SPF级雄性8周龄SD大鼠,16只,购自济南朋悦实验动物繁育有限公司,合格证号:370726210100095071;许可证号:SCXK(鲁)2019 0003。动物实验遵守实验动物伦理学要求。
1.3 模型制备分组及验证
大鼠适应性喂养7天后,以随机数字的方法分成两组,每组8只,每笼饲养数量不超过3只,光照12小时/天,饲养温度(24±1)℃,相对湿度45%~70%,自由摄食和摄水。模型组采用高脂饲料(基础饲料+2%胆固醇、10%猪油)喂养诱导造模[7],正常对照组采用普通饲料喂养,喂养8周。造模期间每天观察各组大鼠毛发、摄食、饮水、粪便、精神状态及整体行为活动等情况,每4周测体质量并记录。
模型制备结果:模型组大鼠的体质量、肝重、血清总胆固醇、血清甘油三酯、谷丙转氨酶、谷草转氨酶较正常组明显偏高,且体质量、血清总胆固醇、血清甘油三酯(triglyceride,TG),差异有统计学意义(P<0.01),肝重、谷丙转氨酶升高,差异有统计学意义(P<0.05)。提示NAFLD模型制备成功。NAFLD大鼠嗜睡,毛松散暗淡无光,活动量减少,大便黏腻臭秽等症状符合人的痰湿证的特征[8],认为NAFLD痰湿证模型建立成功。
1.4 样本取材
取材前一晚对大鼠禁食不禁水12小时,取浓度为10%水合氯醛溶液对大鼠进行腹腔注射麻醉(0.25 mL/100 g),下腔静脉取血后摘取肝组织,称重后置于超低温-80℃保存。
1.5 肝脏脂质样品处理
称取肝脏组织100 mg于2 mL管中,加入750 μL氯仿:甲醇混合溶液(2∶1,-20℃),涡旋振荡30秒;冰上放置40分钟,加入190 μL蒸馏水,涡旋振荡30秒,冰上静置10分钟;离心(12 000 rpm,4℃,5分钟),向下层液体中加入500 μL氯仿:甲醇混合溶液(2∶1,-20℃),涡旋振荡30秒;离心(12 000 rpm,4℃,5分钟)取400 μL下层液体用真空离心浓缩仪浓缩;用200 μL异丙醇溶解样品,0.22 μm膜过滤,得到待测样本。每个待测样本中各取20 μL混合成质量控制(quality control,QC)样本。
1.6 脂质组学检测条件
1.6.1 色谱条件 仪器使用ACQUITY UPLC®BEH C18 色谱柱(2.1×100 mm×1.7 μm,购自美国赛默飞世尔科技公司),自动进样器温度为8℃,流速为0.25 mL/min,柱温为50℃,流动相C相为乙腈∶水=60∶40(0.1%甲酸+10 mM甲酸铵),D相为异丙醇∶乙腈=90∶10另加(0.1%甲酸+10 mM甲酸铵)。梯度洗脱程序为0~5分钟,70%~57%C;5~5.1分钟,57%~50%C;5.1~14分钟,50%~30%C;14~14.1分钟,30%C;14.1~21分钟,30%~1%C;21~24分钟,1%C;24~24.1分钟,1%~70%C;24.1~28分钟,70%C。
1.6.2 质谱条件 仪器使用电喷雾离子源(ESI),正负离子模式采集,正离子喷雾电压为3.50 kV,负离子喷雾电压为2.50 kV,鞘气30 arb,辅助气10 arb。毛细管温度325℃,以分辨率35 000进行全扫描,扫描范围150~2 000,并采用HCD进行二级裂解,碰撞电压为30 eV,同时采用动态排除去除无必要的MS/MS信息。
1.7 数据处理与分析
1.7.1 数据稳定性 所有待测样本各取20 μL,等量配置,混合制成QC样本,处理方法如“1.5”。
1.7.2 数据处理 脂质组学数据通过LipidSearch软件(v4.0)将获得的原始数据进行脂质注释,得到包括质荷比和保留时间及峰响应值等信息的数据矩阵。将所有样本的注释结果,通过LipidSearch软件(v4.0)进行alignment,对所有单个数据的注释结果进行峰对齐、峰过滤等工作,主要参数有bR.T.Tolerance=0.25,m-Score Threshold=3。为使不同量级的数据能够进行比较,对数据进行峰响应值的总峰归一化。归一化后,进行多元统计分析,对所有样本进行主成分分析(Principal Component Analysis,PCA)。采用Simca-P 13.0(Umetrics AB,Umea,Sweden)软件进行处理。采用Pareto数据变换,首先进行无监督的PCA分析,观察各族数据的聚类并去除离群样本;然后用偏最小二乘判别分析(Partial Least Squares-Discriminant Analysis,PLS-DA)和正交—偏最小二乘判别分析(orthogonal- Partial Least Squares-Discriminant Analysis,OPLS-DA)进行有监督的数据分析,并采用置换检验防止PLS-DA模型的过度拟合差异脂质。设置第一主成分的变量投影重要度(Variable Importance in the Projection,VIP)>3.5,P<0.001,倍数变化(fold change,FC)>2或<0.5来寻找差异的脂质。根据获得的潜在脂质标志物检索HMDB(https://hmdb.ca)等数据库,参考相关信息和文献对生物标志物进行进一步筛选及确认。
2 结果
2.1 脂质组学数据处理
2.1.1 总离子流图(total ion chromatogram,TIC) 使用LC-MS在正离子模式和负离子模式对肝脏进行脂质组学分析。肝脏中提取物的TIC图显示代谢物存在显著差异性。代表性的色谱图如图1所示。

图1 正负离子模式下TIC图
2.1.2 数据质量评价 对QC样本进行主成分分析,由图可见QC样本聚集,重复性良好,表明系统稳定,样本数据可靠。见图2。
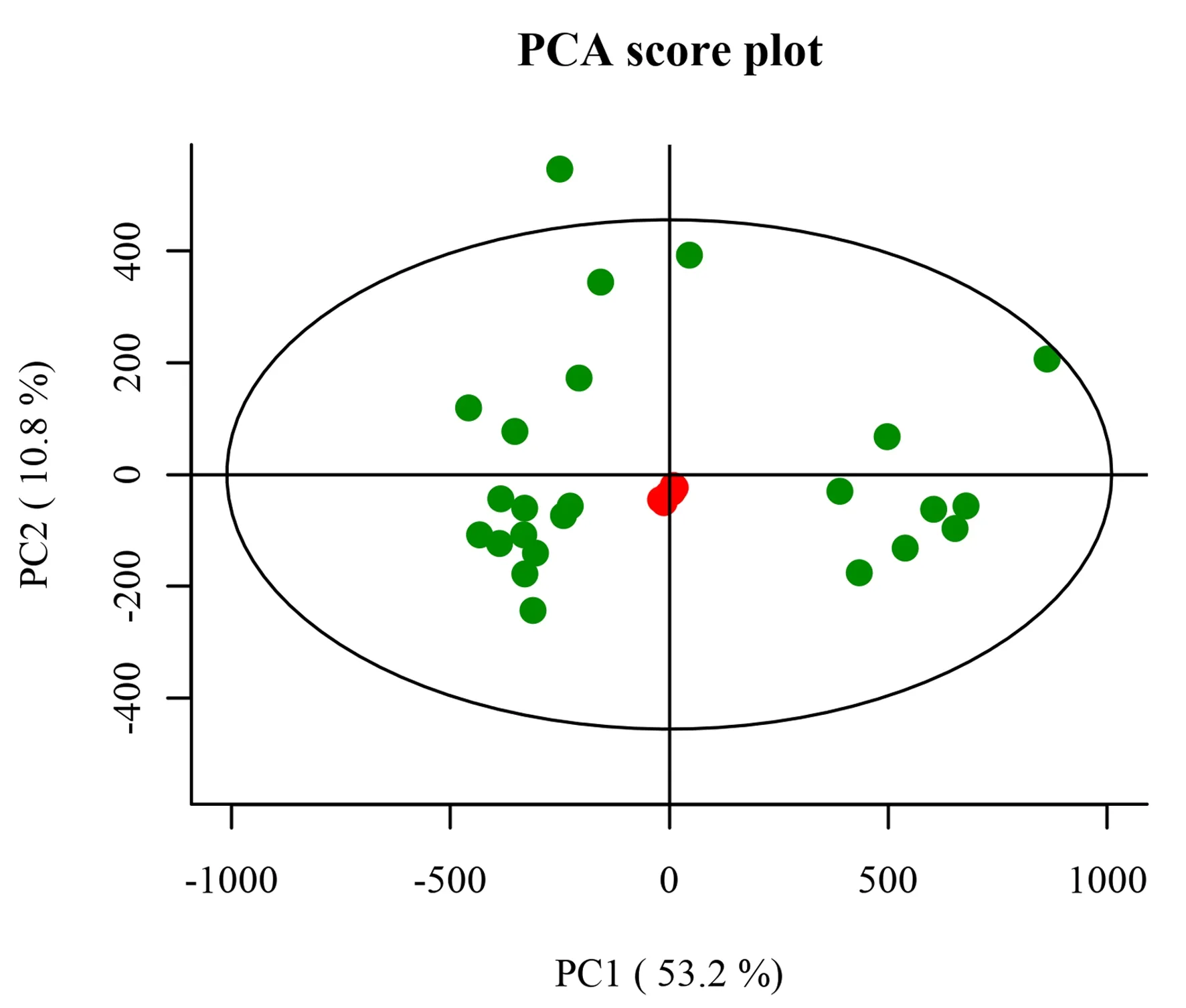
图2 QC样本PCA得分图
2.1.3 数据验证分析 将数据预处理后进行PCA分析、PLS-DA分析,同时采用OPLS-DA模型验证。
见图3。结果可见模型组与正常组大鼠组间明显聚集,分离良好,表明模型组肝脏脂质代谢出现较为明显的紊乱。模型拟合指数R2=0.59,预测指数Q2=-0.45,表明所建立模型的拟合能力和预测能力良好。见图4。

注:A为正常对照组,B为NAFLD痰湿证组;①为正常组与模型组的PCA得分图,②为PLS-DA得分图,③为PLS-DA置换检验图,④为OPLS-DA得分图。
2.2 脂质差异分析与标志物筛选
根据OPLS-DA的结果,参数设置VIP>3.5,P<0.001且FC>2或<0.5的筛选条件,得到23个变量结果作为NAFLD痰湿证潜在的脂质代谢的生物标志物,与正常对照组相较,12个TG、一个甘油二酯(diacylglycerol,DG)、磷脂酰胆碱(phosphatidylcholine,PC)(15∶0_20∶3)升高,其余9个PC、一个双—甲基化磷脂酸(bis-methyl phosphatidic acid,BisMePA)、一个溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)、一个甲基化磷脂酰胆碱(methyl phosphatidylcholine,MePC)、一个溶血磷脂酰乙醇胺(lysophosphatidylethanolamine,LPE)降低,详细数据见表1。
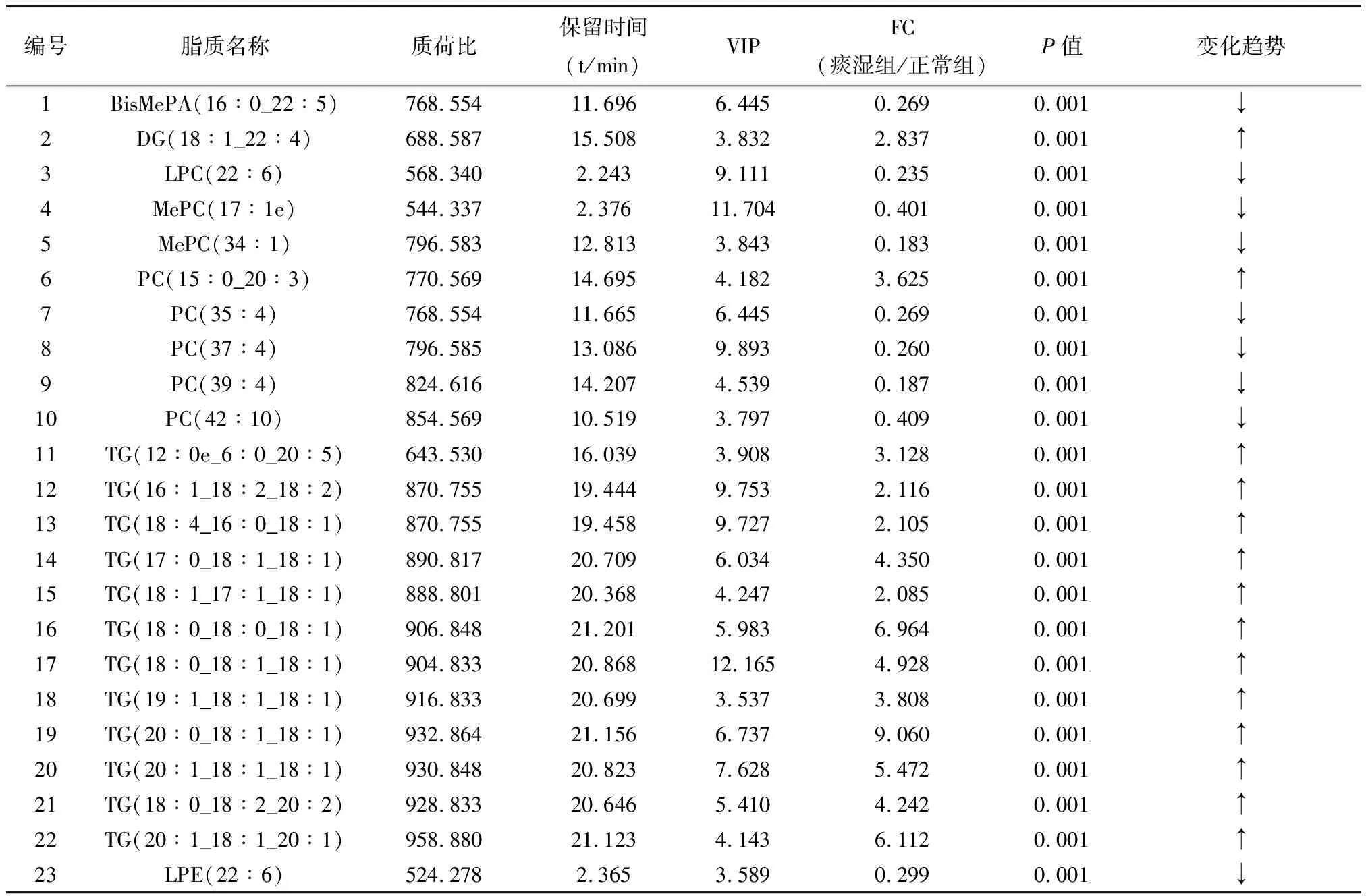
表1 NAFLD痰湿证组与正常对照组潜在脂质代谢生物标志物结果
3 讨论
NAFLD同多数代谢疾病一样存在诱发原因多样性的特点,而肝脏作为最重要的人体代谢器官,与脂类的代谢合成关系密切,尤其是参与内源性脂肪的合成及转运[9]。脂质代谢紊乱是NAFLD的重要特征之一,且其发生和发展程度与中医痰湿证密切相关[5,10-11]。通过脂质组学对生物脂质进行筛选和分析,探索脂质生物标志物及其相关的代谢通路,对于本病以及相关证型的诊断和发病机制进行深入研究有着及其重要的临床指导意义。本研究以探索NAFLD中医临床最常见证型痰湿证的脂质代谢差异物为研究目标,补充了脂质组学对NAFLD痰湿证的研究空白。质谱分析一般是脂质组学研究的首选分析技术,在对脂质的结构鉴定能力和灵敏度、精确度上体现了其绝对优势。因此本研究采用了LC-MS技术正负离子相结合的电离模式进行检测,以获得覆盖率更大、更准确的差脂质异代谢物。
痰湿证为NAFLD最为常见的中医证型。NAFLD虽无明确的中医病名,但根据其临床特性一般将其归于“肝胀、肝痞、肝癖、肝着、鼓胀、痞满、积聚、湿阻、痰浊、痰证、肥气”等相关疾病[12]。其病位主要在肝脾,久则及肾。各医家认为其病因病机为肝郁气滞或脾胃受损,内生湿浊;肝郁气滞,肝病及脾,脾失健运,湿浊内停;湿邪日久,郁而化热,导致湿热内蕴;聚湿则生痰,痰阻则血瘀,遂成痰瘀互结[13],可认为NAFLD发病与疾病进程与湿证关系最为密切,其关键致病因素为“痰”和“瘀”,而其中湿邪的程度也反应了疾病的轻重程度,符合中医的“聚湿成痰、痰瘀互结”理论特点。本病证主要表现为形体肥胖、腹部肥大松软、皮肤油腻、喜食肥甘厚腻、素体痰多而黏、时感口甜、身重不爽、容易困倦、舌体肥大、舌苔白腻、脉滑等[14]。
目前临床上虽存在较多降血脂药物可供选择,但尚缺乏对NAFLD靶点明确的有效治疗药物,且其副作用极易加重肝脏损伤及脂肪沉积[15]。通过对NAFLD痰湿证的脂质组学分析,结合中医基于“整体观念”思想指导下进行精准“辨证论治”,充分发挥中医药多靶点的治疗优势,补充现代医学之局限,护肝、降脂、抗肝纤维化并降低西药所造成的毒副作用损害[16-17],基于此优势,有关于运用中医药治疗NAFLD的思路及有效研究案例相继涌现[18-20]。本研究通过分析NAFLD痰湿证与正常对照组大鼠之间的脂质成分的变化情况,发现在NAFLD痰湿证中发生改变的主要是甘油酯类、磷脂类等共计23种脂质代谢物,其中12个TG、一个DG呈上调趋势;PC类脂质PC(15∶0_20∶3)呈上调趋势,其余均呈下调趋势。
甘油磷脂是构成细胞膜的重要成分[21],可协助脂肪运输,其缺失会致使脂肪外运障碍从而形成脂肪肝,因此磷脂中PC、PE的水平对在肝脏单纯性脂变NASH中的进展进行提示,并对细胞膜的完整性起着关键的调节作用。Anjani K等[22]研究结果表明在女性肥胖脂肪肝病患者的血液中PC、PE等脂类水平升高,可认为在NAFLD中肝脏及血清的甘油磷脂改变可对NAFLD痰湿证病程下肝脏脂质合成代谢异常起到提示作用。PC合成受阻时,体内极低密度脂蛋白胆固醇会受到抑制,无法结合TG从肝组织中转出从而导致TG在肝组织堆积,推动NAFLD病程,因此PC含量降低在NAFLD发病机制中发挥了重要作用。同时,甘油磷脂磷可在特定酶的作用下水解成脂肪酸和溶血磷脂,而溶血磷脂顾名思义具有强溶血作用,其机制会破坏红细胞膜或其他细胞膜。Wang S[23]研究发现Gln/Glu比值、支链氨基酸和LPC与高血糖发展和代谢性疾病危险因素显著相关。由此可推断LPC、LPE的含量异常与NAFLD发病机制及疾病进展密切相关。
TG参与NAFLD的发病机制。TG以二酰基甘油(DG)为基础通过二酰基甘油酰基转移酶(DGAT1和2)合成,肝TG积累是NAFLD的主要决定因素。TG分子代表了脂肪酸在细胞内和血浆中储存和运输的主要形式,在营养过剩和肥胖的情况下,肝脂肪酸代谢被改变,通常导致肝细胞内TG积累,并导致NAFLD发病[24]。Gorden DL等[21]采用ESI-MS/MS的“目标”脂质组学研究肝脏脂质水平,结果显示NAFLD患者的磷脂和DAG水平与正常组比较差异有统计学意义。此外,在肝硬化患者的肝脏提取物中鉴定出来新的磷脂类(乙醚结合的磷脂酰肌醇)。氧化应激在NAFLD进展中起着核心的作用,Feldstein AE等[25]利用LC/ESI/MS/MS的脂质组学技术研究NAFLD患者的血浆脂质氧化产物水平及这些产物的来源,评估它们在循环中的水平是否反映肝脏的组织学改变。Puri P等[26-27]研究发现,在正常人、NAFL及NASH的脂质组学分析中,NAFL及NASH组的TG、DG水平较正常组呈现明显的升高趋势,且TG/DG值与肝损程度呈正相关,这与本研究的结论有一定相似性。DG的增加是NAFLD的标志,Gorden DL等[21]研究表明正常与脂肪肝病患者中DG存在显著差异,可认为DG转移酶在NAFLD的疾病进程中发挥作用,并认为其参与可能会影响TG、PC、PE等脂类水平的改变。同时脂肪肝病患者的PC水平低于正常人也与DG的合成增加有关。Yetukuri L等[28]利用超高效液相色谱—质谱(UPLC/MS)技术的脂质组学方法对肥胖相关的ob/ob小鼠的肝脏脂质进行研究,也发现TG、DAG类上调,而鞘磷脂在ob/ob小鼠肝脏的含量下调,认为酰基甘油的增加可能是导致ob/ob小鼠脂肪肝进展的标志。路晓茅[29]研究得出,ALT与TG(60∶6)在多因素相关性分析中呈负相关,在存在组间差异的8个TAG中检出TG(52∶1)[TG(18∶0/16∶0/18∶1)]、TG(54∶2)[TG(18∶1/16∶0/20∶1)]呈现升高趋势,其性质及脂肪酸链含键数不同,故TAG水平差异可能与其上包含的脂肪酸链性质有关,可认为脂质分子的种类和水平可能会对NAFLD痰湿证的病程和发展有一定的提示作用,且甘油酯类的变化趋势有极大可能对应NAFLD痰湿证病程发展,DG可能是NAFLD病程发展的重要信号,TG相关的脂质分子性质可能与NAFLD病程进展中肝脏的炎症反应有关。
以上可佐证本研究表明NAFLD患者肝脏及血清中甘油三酯、甘油二酯、磷脂与肝脏DNL过程及氧化应激反应、线粒体和过氧化酶功能性异常存在相关性,推测这些脂质有可能作为NAFLD痰湿证的重要标志物,且随各脂质间差异的升高与降低,有可能反应疾病的进程及痰湿证的程度。
总之,本研究通过LC-MS技术对正常大鼠与造模后NAFLD痰湿证大鼠进行脂质组学研究,揭示中医痰湿证的脂质代谢基础,发现痰湿证NAFLD大鼠较正常对照组的肝脏脂质代谢发生了显著改变,鉴定发现23个差异脂质代谢标志物包括甘油脂类、磷脂类等多种脂质信号分子,或可将其作为潜在的NAFLD痰湿证新的治疗靶点,为诊断及防治NAFLD痰湿证提供新的依据。未来对NAFLD痰湿证基于大样本人群和临床试验人群的脂质组学研究,无疑会产生大量相关信息,有利于开发无创性的诊断方法及新的治疗方法,并进一步将脂质组学方法应用于NAFLD痰湿证的临床研究中。但由于目前针对NAFLD痰湿证研究的论述较少,具体发病机制仍需进一步探索,同时,在脂质组学分析中对于样品的处理及数据处理无法完全统一,因此生物标志物可能存在一定差异,因此将在本研究基础上,着重其与临床的联系,从“病证结合”到“证症结合”进一步探索[30],真正从微观的角度揭示其发病机制,以进一步为NAFLD痰湿证的诊治提供新的依据。
