温度和光照对莫索湾地区两种典型短命植物光合系统的损伤特征研究
2023-11-01付慧蓉程模香谢双全王秀爽郝兴明庄丽
付慧蓉 程模香 谢双全 王秀爽 郝兴明 庄丽


摘 要:為探究莫索湾地区2种优势短命植物对光照和温度的光合适应机制,该文测定了卷果涩芥(Malcolmia scorpioides)和硬萼软紫草(Arnebia decumbens)在不同温度下(25~60 ℃)及恒定常温(25 ℃)与胁迫高温(50 ℃)下不同光强间(80~400 μmol·m-2·s-1)的叶绿素荧光参数,以探讨其光损伤情况和光合活性变化。结果表明:(1)随温度升高,2种短命植物的光合效率和电子传递速率先升后降,40 ℃时达到最高值,其后快速下降,并伴随着光系统Ⅱ(PS Ⅱ)非调节性能量耗散的量子产量 [Y(NO)]和光系统I(PS I)受体端热耗散效率 [Y(NA)]的上升,受体端激发压积累,光合系统受损。(2)在80~400 μmol·m-2·s-1的光照范围内,常温下,光合效率随光照强度增加而增加;而高温下,光照与高温对植物产生了联合胁迫,造成光合活性下降,PS Ⅱ调节性能量耗散的量子产量 [Y(NPQ)]降低,并且当光强达320 μmol·m-2·s-1时,环式电子传递流逐渐消失。综上所述,一定范围内的光照和温度能够提升2种短命植物的光合活性,激活热耗散和环式电子传递流,减少光抑制,但温度增加及高温下光强的增加会使2种短命植物的适应能力减弱,光保护机制消失,其主要原因为PS I受体侧激发压积累和调节性热耗散保护能力不足使植物光合系统受损。
关键词: 短命植物, 光合作用, 光保护, 光抑制, 联合胁迫
中图分类号:Q945.79
文献标识码:A
文章编号:1000-3142(2023)09-1611-11
收稿日期:2022-09-30
基金项目:荒漠与绿洲生态国家重点实验室开放基金项目(KH0054)。
第一作者: 付慧蓉(1998-),硕士研究生,主要从事荒漠植物生态生理方面的研究,(E-mail)2498701911@qq.com。
*通信作者:庄丽,博士,教授,主要从事植物生态方面的研究,(E-mail)2585463349@qq.com。
Damage characteristics of photosynthetic system of
two typical ephemeral plants in Mosuowan
area caused by temperature and light
FU Huirong1, CHENG Moxiang1, XIE Shuangquan1, WANG Xiushuang1,
HAO Xingming2, ZHUANG Li1*
( 1. College of Life Sciences, Shihezi University, Shihezi 832003, Xinjiang, China; 2. State Key Laboratory of Desert and
Oasis Ecology, Xinjiang Institute of Ecology and Geography, Chinese Academy of Sciences, Urumqi 830011, China )
Abstract:To explore the photosynthetic system adaptation mechanism of two dominant ephemeral plants, including Malcolmia scorpioides and Arnebia decumbens, to light and temperature, this study measured the chlorophyll fluorescence parameters and discussed their light damage and the change of photosynthetic activities under different temperatures (25-60 ℃) and constant room temperature (25 ℃) and high temperature and different illumination (80-400 μmol·m-2·s-1). The results were as follows: (1) The photosynthetic efficiency and electron transport rate increased first and then decreased with the increase of temperature, reached the highest value at 40 ℃ and then rapidly decreased,the quantum yield of non-regulated energy dissipation in PS Ⅱ[Y(NO)] and PS I receptor side heat dissipation efficiency[Y(NA)] increased, and the photosynthetic system was damaged due to the accumulation of excitation pressure at the receptor terminal. (2) Under the light range of 80-400 μmol·m-2·s-1 and room temperature, the photosynthetic efficiency increased with the enhancement of light intensity; under high temperature, the combined stress of light and high temperature on plants descended the photosynthetic activities of plants and the quantum yield of regulatory energy dissipation in PS Ⅱ[Y(NPQ)], and when the light intensity reached 320 μmol·m-2·s-1, the ring electron transport flow disappeared. In conclusion, light and temperature within a certain range can improve the photosynthetic activity, activate heat dissipation and ring electron transport flow and reduced photoinhibition. However, with the increase of temperature and light intensity at high temperature, the adaptation ability of the two ephemeral plants decrease and the photoprotective mechanism disappeared. The main reason isthe accumulation of PS I receptor side excitation pressure and the failure of regulatory heat dissipation.
Key words: ephemeral plants, photosynthesis, photoprotection, photoinhibition, combined stress
近年来,全球气候变暖,植物生长繁殖受到严重影响。有研究者表示,如果全球平均气温升高超过1.5~2.5 ℃,将会有20%~30%的物种面临灭绝(郑立平,2009),这使环境脆弱的荒漠生态系统受到了巨大威胁。荒漠生态系统生物多样性单一,结构简单,生境破碎化严重,导致荒漠化程度进一步加剧(Peng et al., 2022)。短命植物作为荒漠区初夏的主要植被类群,对控制土壤荒漠化扩张,维持生态系统稳定有着重要作用。据统计,古尔班通古特沙漠中短命植物种类数量占该地植物总数的37.1%,春季绿色产量占群落产量的60%以上(张立运和陈昌笃,2002)。因此,探究短命植物光合生理生态特性,对荒漠生态环境植被的保护与恢复具有重要意义。
短命植物是一类利用雪水或春季雨水于每年3—5月迅速完成生活周期,具有特殊生态型的草本植物群体(毛祖美和张佃民,1994),在我国新疆和东北等地多有分布(杨公甫和赖晓辉,2020)。常年来短命植物为适应恶劣的荒漠环境,逐渐缩短生命周期,其解剖结构和生理特性也进化出了独特的适应方式——高光效性(毛美祖,1992;司雯等,2020)。有研究者表示,短命植物虽属于C3植物,但叶片具有与C4植物类似的维管束鞘结构,光合速率较其他植物高,且叶绿体富含电子传递成分和光合酶(John et al., 1983;刘彭,2007;齐鲁壮,2007)。另外,Recchia等(2017)表示短命植物有着较高的电子传递速率(electron transport rate, ETR)和半饱和光子通量密度;在胁迫环境下,高的PsbS蛋白含量和非光化学淬灭机制(non-photochemical quenching, NPQ)能够很好地保护光合系统(Correa-galvis et al., 2016;Son et al., 2020);高光环境下光系统内天线(CP47)可调节其能量分配,避免光系统损伤(Wu et al., 2020)。以上研究对短命植物的光合适应性有了很好的解释,但相对其他非短命植物而言,短命植物光合作用方面的研究依然很少,并且不同植物对不同环境条件的光合适应机制存在差异,卷果涩芥(Malcolmia scorpioides)和硬萼软紫草(Arnebia decumbens)作为莫索湾地区的优势短命植物,其对光照和温度的光合特性和光合适应机制尚不清楚。因此,本文可概括其光合特性,拓宽人们对短命植物光合适应机制的认识,为保护和利用短命植物资源,恢复荒漠植被提供关键信息。
本研究以莫索湾地区2种优势短命植物卷果涩芥和硬萼软紫草为研究对象,利用叶绿素荧光技术分别对低光处理下不同温度间及恒定常温和胁迫高溫下不同光照间的叶绿素荧光参数进行测定,拟探讨:(1)莫索湾地区2种优势短命植物在不同温度与光照下的光合适应机制;(2)2种短命植物光系统对光照与温度的敏感程度;(3)胁迫条件下2种短命植物的光合效率和能量分配规律,明确热耗散和循环电子传递流是否能有效保护光合系统免受温度和光照的伤害。旨在为荒漠环境植被恢复提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于新疆维吾尔自治区古尔班通古特沙漠南缘(86°03′36″ E,45°18′00″ N,海拔364~359 m)的莫索湾研究站。夏季干旱少雨,冬季寒冷少雪,年降水量为115 mm,年潜在蒸发量为1 942 mm,年平均气温为4~6 ℃,4—5月的平均气温为27 ℃,极端温度可达36 ℃,昼夜温差极大,年平均日照时间为3 100~3 200 h(王永兵和李亚萍,2020),光热资源丰富,属于典型的干旱或半干旱大陆性气候;土壤类型以风沙土和灰漠土为主;主要分布物种有梭梭(Haloxylon ammodendron)、沙拐枣(Calligonum mongolicum)等木本植物及卷果涩芥(Malcolmia scorpioides)、硬萼软紫草(Arnebia decumbens)和牻牛儿苗(Erodium stephanianum)等草本短命植物。其中卷果涩芥和硬萼软紫草经过前期野外物种调查发现分别占该地区短命植物总数的56.5%与16.6%,是该区典型的优势短命植物。
1.2 试验材料和设计
于2021年5月9日、5月11日和5月13日的清晨,在莫索湾沙漠研究站附近随机选择长势良好且叶片完整的卷果涩芥和硬萼软紫草植株,挖取植株及距植株根部5 cm以内的所有根际土壤,一并放入铺有湿润滤纸的黑色塑料袋中,并用隔热箱带回实验室,其后将待测植株和湿润滤纸分装到适宜器皿中,放入设置好相应温度与光照强度的光照培养箱中进行试验处理。
采样植株用于3组试验,分别为温度处理组、常温光照处理组和高温光照处理组。第一组(温度处理组):光照强度设置为恒定的80 μmol·m-2·s-1,温度分别为25、30、40、50、60 ℃;第二组(常温光照处理组):温度设置为恒定的25 ℃,光照强度分别为80、160、240、320、400 μmol·m-2·s-1;第三组(高温光照处理组):将第一组试验中测定得到的数据进行初步整理分析,得到2种短命植物受温度胁迫的温度点(50 ℃),将此温度点作为第三组试验的恒定高温,光强梯度与第二组的设定保持一致。其上每一组的每一梯度均处理1 h,且每一梯度均重复3次。
1.3 光系统Ⅱ(PS Ⅱ)和光系统I(PS I)量子产率的测定
植株经温度、光照处理后,选择完全伸展且成熟、健康的叶片,夹上暗适应专用夹,暗适应20 min,使用德国Walz公司的脉冲调制双通道叶绿素荧光仪(Dual-PAM-100),参照Dual-PAM-100使用说明及Kramer等(2004)的方法,测定相关的叶绿素荧光参数。先设定参数,点击ML,打开测量光,记录暗适应后的初始荧光(Fo),之后打开饱和脉冲光(10 000 μmol·m-2·s-1)持续600 ms测定暗适应后的最大荧光(Fm),打开光化光,并在光化光开始后每隔20 s给予一个持续时间为300 ms的饱和脉冲光,以确定光化光下最大荧光信号(Fm′)和最大P700信号(Pm′)。Pm与Pm′的测定方法相似,但需用远红光代替光化光,等待光系统达到动态平衡时,关闭光化光。根据以上参数使用计算机自动计算光系统Ⅱ(PS Ⅱ)与光系统I(PS I)的量子产量及PS Ⅱ最大光化学效率(Fv /Fm),公式如下。
1.4 PS Ⅱ的相对电子传递速率的测定
叶绿素荧光参数测定完成后,更换Light Curve模式进行PS Ⅱ相对电子传递速率的测定,设定10个光合有效辐射(photosynthetic active radiation, PAR)梯度,分别为29、37、55、113、191、233、349、520、778、1 197 μmol·m-2·s-1,每个梯度持续30 s,饱和脉冲光设为10 000 μmol·m-2·s-1,照射300 ms,5 min后得到快速光響应曲线,保存图像,记录数据,并通过计算机自动计算PS Ⅱ的相对电子传递速率 [rETR(Ⅱ)]。计算公式为rETR(Ⅱ)=PAR× Y(Ⅱ)× 0.84× 0.5。
1.5 数据处理
用 Microsoft Excel 2019软件整理数据,用SPSS 26.0软件进行数据的单因素方差分析(one-way ANOVA),LSD法进行多重比较,差异显著性为P<0.05,用Origin 2018软件制图。
2 结果与分析
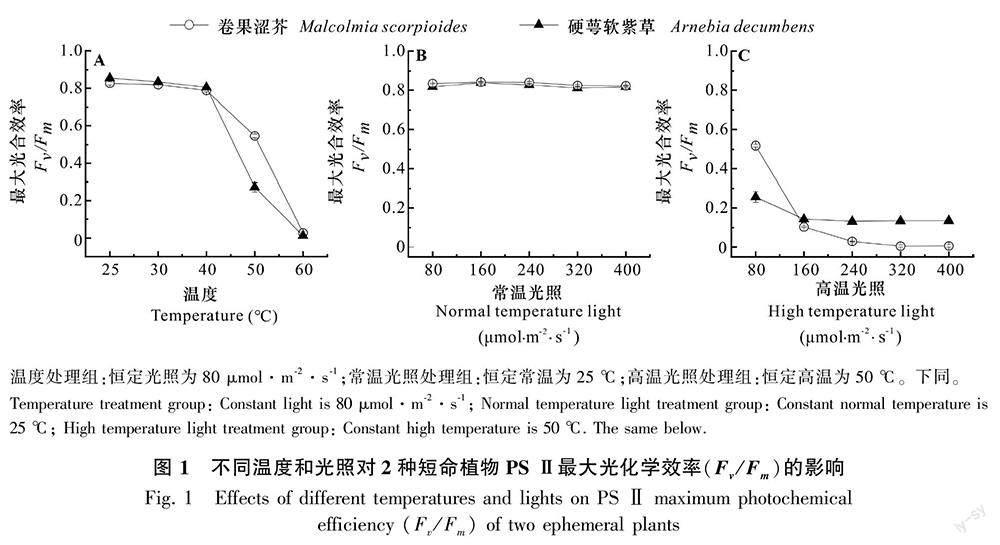
2.1 不同光照与温度对2种短命植物PS Ⅱ最大光合效率(Fv /Fm)的影响
由图1可知,2种短命植物Fv/Fm受温度影响较大。在80 μmol·m-2·s-1的光强下,25~30 ℃的温度间, Fv/Fm均大于0.8;但当温度超过40 ℃时,Fv/Fm显著下降,50 ℃时卷果涩芥和硬萼软紫草分别下降了30.9%和66.26%,是Fv /Fm下降率最高的温度点(图1:A),为2种短命植物的温度敏感点。
相同光照范围内(80~400 μmol·m-2·s-1),恒定常温(25 ℃)下,2种短命植物Fv/Fm对光照变化不敏感,均大于0.8(图1:B);恒定高温(50 ℃)下,随着光照强度的增加2种短命植物Fv/Fm显著下降,且当光强超过240 μmol·m-2·s-1时,卷果涩芥Fv/Fm趋于0(图1:C)。以上结果表明相同光照范围内,处于常温的植株不会伴随光照强度的增加而受到影响;但高温下,植株会受到温度与光照的协同作用,加速Fv/Fm的下降。
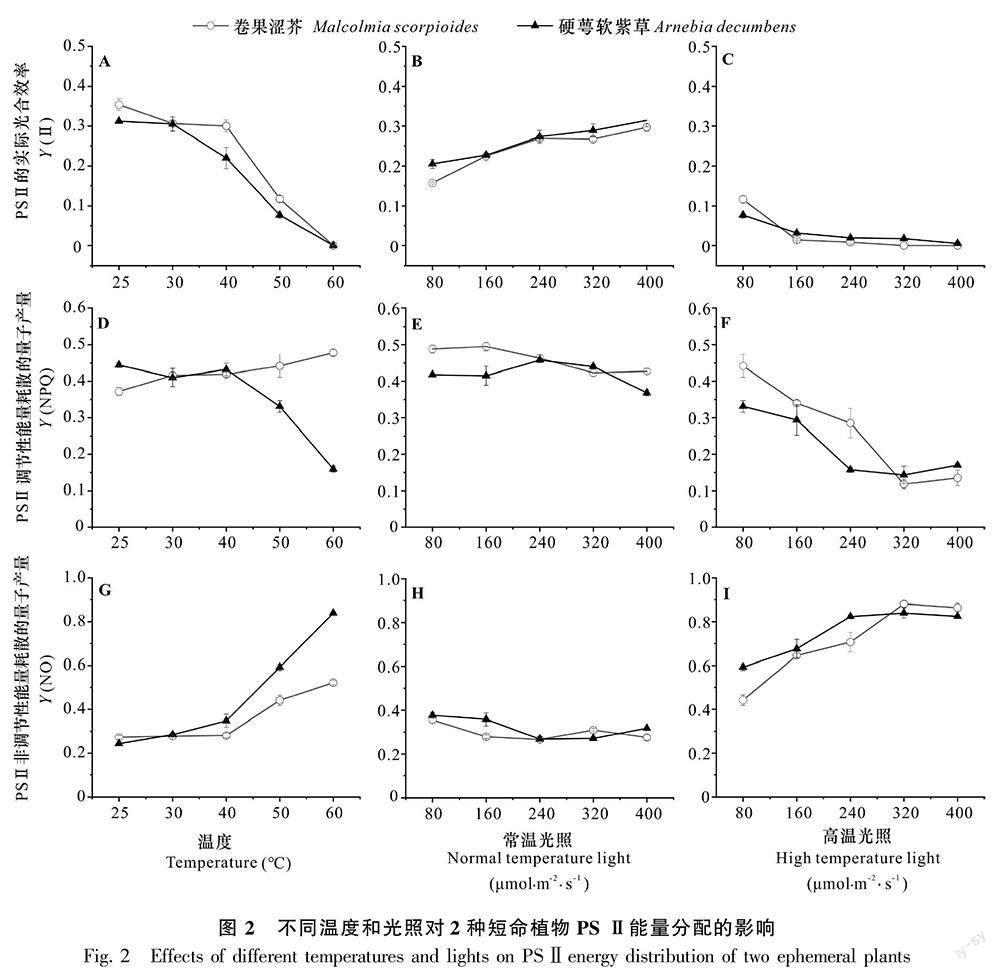
2.2 不同光照和温度对2种短命植物PS Ⅱ激发能分配的影响
在温度持续增加的处理下,2种短命植物的Y(Ⅱ)逐渐降低,Y(NO)增加,即用于光化学反应的能量递减(图2:A,G);而2种短命植物的Y(NPQ)呈2种不同趋势(图2:D),硬萼软紫草Y(NPQ)在25~40 ℃时上升,其后显著下降,卷果涩芥Y(NPQ)随温度上升而持续上升。表明当温度超过40 ℃时硬萼软紫草调节性热耗散的量子产量下降,光保护能力降低,而卷果涩芥持续上升。进一步观察在恒定高温下80~400 μmol·m-2·s-1的光照范围内卷果涩芥Y(NPQ)可发现,此时卷果涩芥的Y(NPQ)从图2:D中的增加转变为下降,且2种短命植物的Y(NO)均增加(图2:F,I),Y(Ⅱ)降低(图2:C)。表明光照和高温产生了协同作用,促使2种短命植物光合效率进一步下降,并且卷果涩芥的热耗散保护能力也在光强增加的情况下逐渐下降。另外将2种短命植物Y(Ⅱ) 和Y(NPQ)的下降速率进行比较可发现,硬萼软紫草的光合效率下降速率比卷果涩芥快,说明卷果涩芥的光保护能力较硬萼软紫草强。
常温(25 ℃)下,2种短命植物Y(Ⅱ)随光照强度的增加而增加(图2:B),Y(NPQ)和Y(NO)总体趋于平稳(图2:E,H),表明常温下,80~400 μmol·m-2·s-1内的光照强度增加促进了2种短命植物的光化学反应;然而,高温下,光照强度的增加会增加2种短命植物的胁迫程度,Y(Ⅱ)会进一步下降(图2:C),Y(NO)增加(图2:I)。表明2种短命植物对温度较光照敏感,且进一步证实了高温胁迫下光照强度的增加会加剧光合速率的下降。
2.3 不同光照、温度对2种短命植物PS I激发能分配的影响
PS I能量分配与PS Ⅱ能量分配规律相似,受温度影响较大。2种短命植物Y(I)随着温度升高呈先上升后下降趋势,在25~30 ℃下,卷果涩芥和硬萼软紫草Y(I)逐渐上升,分别在40 ℃和30 ℃时达到最高,其后显著下降,且Y(NA)显著增加(图3:A,G),表明适宜温度内温度的增加提高了2种短命植物PS I的光合效率,但当温度超过一定值时(卷果涩芥:40 ℃,硬萼软紫草:30 ℃),PS I光合效率下降。
常温下,随着光照强度的增加2种短命植物的Y(I)逐渐增加,Y(ND)减少,Y(NA)一直保持较小数值(图3:B,E,H),卷果涩芥和硬萼软紫草在400 μmol·m-2·s-1光强下的Y(I)相较80 μmol·m-2·s-1下分别增加了41.5%和34%,表明常温下,光照强度的增加提高了2种短命植物的PS I光合效率; 进一步观察,高温下,随着光照强度的增加Y(I)进一步下降,Y(NA)增加(图3:C,I),说明2种短命植物的PS I与PS Ⅱ相同,高温下光照强度的增加会加大PS I光合效率的下降程度。
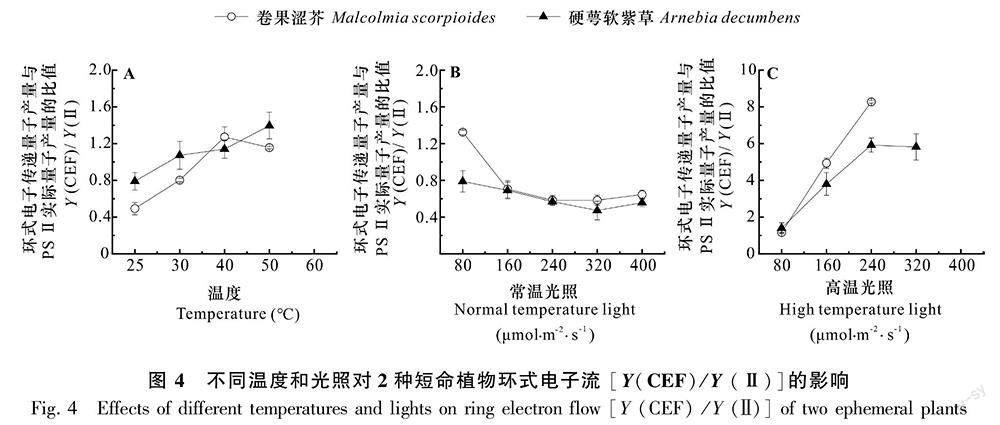
2.4 不同光照和温度对2种短命植物PS I环式电子传递流的影响
由图4:A可知,2种短命植物环式电子传递量子产量与PS Ⅱ 实际量子产量的比值 [Y(CEF)/Y(Ⅱ)]随温度升高而升高。当温度达50 ℃时,卷果涩芥和硬萼软紫草Y(CEF)/Y(Ⅱ)分别升高至1.16和1.40,表明PS I环式电子传递速率随温度上升被逐渐提高;60 ℃时,2种短命植物Y(CEF)/Y(Ⅱ)出现异常(图4:A)。常温下2种短命植物的Y(CEF)/Y(Ⅱ)曲线在80~400 μmol·m-2·s-1的光照范围内波动微小,随光照强度的增加而缓慢下降(图4:B),表明此范围内光照强度的增加促进了PS Ⅱ实际光合效率和线性电子传递速率的增加。进一步观察可知,在高温50 ℃下,Y(CEF)/Y(Ⅱ)随光照强度的增加而增加,当光强增加到320 μmol·m-2·s-1和400 μmol·m-2·s-1时,卷果涩芥和硬萼软紫草的Y(CEF)/Y(Ⅱ)相继出现异常(图4:C),说明在恒定高温(50 ℃)下,光照强度的增强可促进环式电子传递速率升高,但当光强增加到一定阈值时,光照与高温会产生协同作用,使环式电子传递流速率下降直至消失(图4:C)。
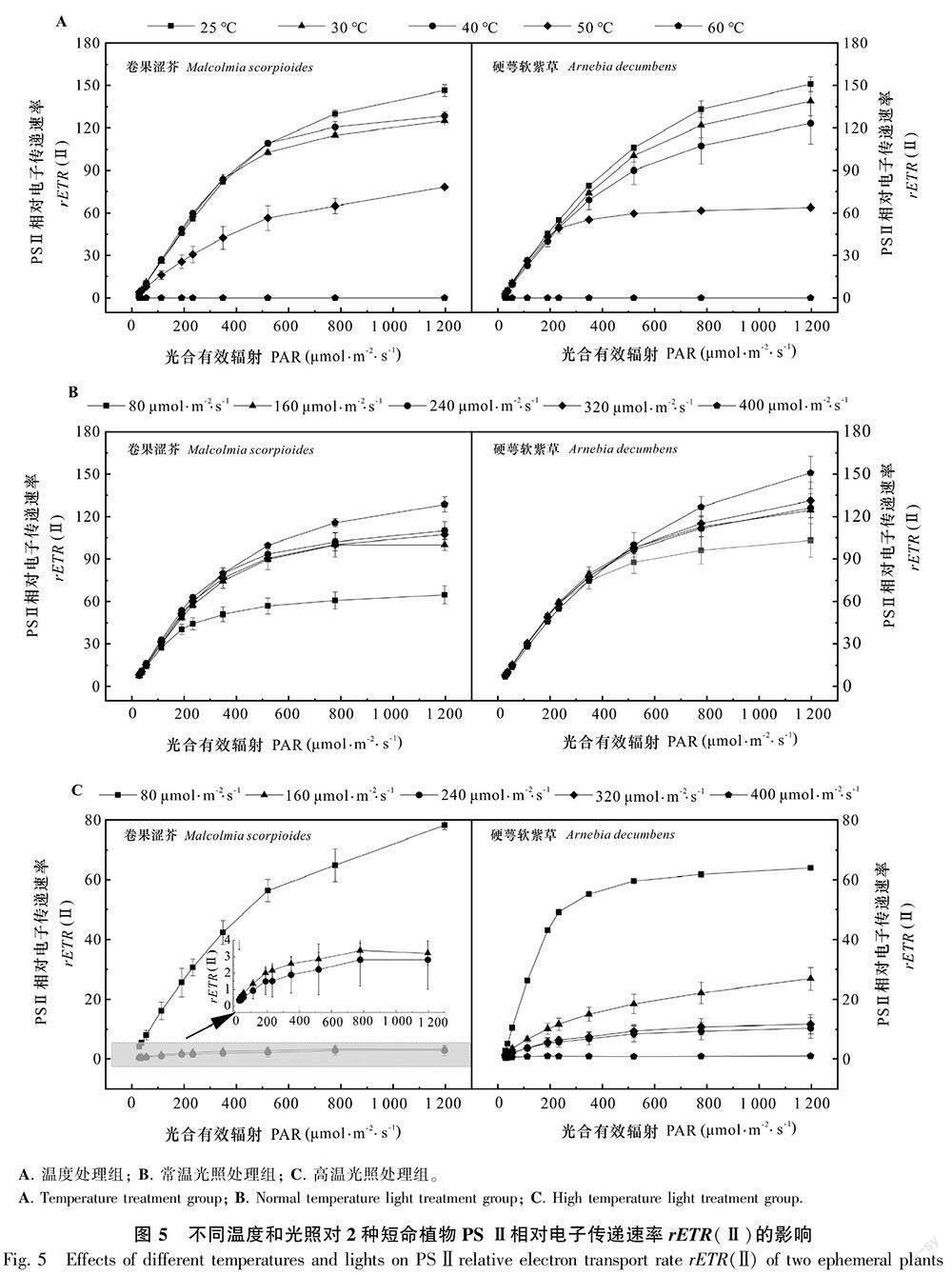
2.5 不同光照和温度对2种短命植物PS Ⅱ的相对电子传递速率 [rETR(Ⅱ)]的影响
温度与光照对2种短命植物PS Ⅱ相对电子传递速率 [rETR(Ⅱ)]的影响与对光合效率的影响相似,rETR(Ⅱ)随着温度增高而下降,温度上升至60 ℃时,2种短命植物rETR(Ⅱ)下降至0(图5:A),说明温度升高使2种短命植物的电子传递速率降低,60 ℃时,下降至0。进一步比较常温和高温下光照強度的变化对rETR(Ⅱ)的影响,常温下2种短命植物rETR(Ⅱ)随着光照强度增加而增加(图5:B),但高温下,rETR(Ⅱ)随光照强度的增加而下降,且当光照升至320 μmol·m-2·s-1时,卷果涩芥rETR(Ⅱ)降为0(图5:C),说明常温下光照强度的增加可提高2种短命植物的相对电子传递速率,而高温下光强的增加使PS Ⅱ电子传递受阻,相对电子传递速率下降,且植株受严重胁迫时降至0。
3 讨论
3.1 不同温度和光照下2种短命植物的光抑制情况
高温导致植物光抑制,而光照与高温的协同作用会加剧光抑制,造成光系统不可逆损伤(张强皓等,2020)。Fv/Fm是衡量植物光抑制的典型指标,可以反映植物潜在的最大光能转换效率(刘丽娟和高辉,2018),值常处于0.8~0.85之间,在受环境胁迫时会显著降低(唐钢梁等,2013;武洪敏等,2021)。在本研究中,光照强度的增加未引起Fv/Fm的变化,Y(Ⅱ)和Y(I)随着光照强度的增加而增加,说明该光照强度为2种短命植物的适宜光照条件,可利于电子传递速率和光合活性的提升。Y(Ⅱ)和Y(I)是PS Ⅱ和PS Ⅰ的实际原初光能捕获效率,可作为植物光合电子传递速率快慢的相对指标(董益等,2021),这可在本研究中rETR(Ⅱ)的变化趋势得到充分证实。在温度处理中,高温使Fv/Fm、Y(I)和Y(Ⅱ)显著降低,植物叶片光化学反应受到抑制,且抑制程度在光照和高温的协同作用下逐渐加大,这与在高温环境下PS Ⅱ和PS I损伤指标Y(NO)和Y(NA)显著升高结果一致(Kim et al., 2005;Lu et al., 2017)。
PS Ⅱ的损伤主要由Y(NPQ)的下降引起。Y(NPQ)是PS Ⅱ调节性能量耗散的量子产量,可以反映PS Ⅱ通过调节性非光化学淬灭机制耗散的热量比例及植物耗散过剩光能的能力,即光保护能力(张翼飞等,2013)。在25~40 ℃间,2种短命植物的Y(NPQ)均维持在较高水平,Y(Ⅱ)和rETR(Ⅱ)也未受温度变化影响,说明2种短命植物的光合活性在热耗散机制的保护下均较高,且光合系统未受损伤。但温度超过40 ℃及50 ℃时,光照强度的增加使Y(NPQ)下降,Y(NO)增加,植物光保护能力下降,PS Ⅱ超复合物受损程度加大,光合活性急速降低。这与陈梅和唐运来(2013)对苋菜的研究结果一致,该研究表示高温导致苋菜光合活性下降,造成光合系统损伤,其主要原因可能是高温导致植物光系统捕光天线和反应中心结构发生改变或分离,引起能量传递受阻。董连清等(2014)曾对野生型拟南芥、PsbS缺失的突变体npq4以及PsbS过表达的L17进行NPQ的测定发现,高光条件下植物激发能的淬灭与PsbS含量呈正相关,高PsbS含量,可提高电子传递速率,降低光破坏,维持PS Ⅱ活性(Dong et al., 2015)。而NPQ的激活依赖于植物类囊体腔酸化产生的质子梯度(ΔpH),此梯度可诱导光保护蛋白PsbS的激活和叶黄素循环产物玉米黄质的产生,这对Y(NPQ)的提高起着重要作用(陈玮,2003;Leuenberger et al., 2017;Son et al., 2020)。因此,推测本研究中Y(NPQ)下降的原因可能是试验处理中温度过高造成了PsbS的降解或叶黄素循环关键酶VDE(紫黄质脱环氧化酶)的失活。另外,观察光照与温度对PS I的影响可发现,PS I的活性变化和能量分配规律与PS Ⅱ相似。但PS I的损伤主要由Y(NA)升高所致。高温胁迫下,Y(I)降低,PS I光合活性受到抑制,而此时Y(ND)一直维持在较低水平,Y(NA)明显升高,说明PS I供体端未受光损伤,而受体端结构可能因为激发压的过度积累而受损。Zhao等(2022)曾表示Y(NA)的升高原因除供体端和受体端的结构改变或受损以外,还可能受Calvin-Benson循环和循环关键酶活性的影响(袁世力等,2018)。这与PS Ⅱ中Y(NPQ)下降原因相似,但高温下短命植物各循环关键酶活性变化情况还需进一步研究。
3.2 高温下2种短命植物PS I环式电子传递流被高度激活
环式电子传递流是高等植物正常生长必需的光保护机制之一,可参与ATP的合成,降低PS Ⅱ和PS I的光抑制(Campbell et al., 1998)。在本研究中,温度上升初期环式电子传递流被逐渐激活,对光合系统产生了良好的保护作用,Y(Ⅱ)和Y(I)被维持在较高水平。Rumeau等(2007)研究表明,环式电子传递流的激活可稳定放氧复合体的结构,缓解PS I电子受体的过度还原。然而,在温度上升后期和高温下光照强度逐渐增加时,Y(Ⅱ)和Y(I)逐渐下降,环式电子传递速率的增加也无法保证PS Ⅱ和PS I的高光合活性,这与Y(NPQ)的下降有关。研究表明,在胁迫环境下,环式电子传递流可通过电子从PS I传递至PQ处建立高的类囊体膜质子梯度(ΔpH),而这一梯度可促进调节性能量耗散,提高Y(NPQ),保护PS Ⅱ、PS I免受伤害(Munekage et al., 2002;肖飞等,2017),并诱导更多ATP的合成,便于光损伤的PS Ⅱ亚单位修复(Deng et al., 2014)。但在本研究中,温度上升后期环式电子传递流的激活并未引起Y(NPQ)的上升,因此结合讨论3.1中提到的PS Ⅱ损伤原因,推测2种短命植物光合活性下降主要原因为调节性热耗散保护能力不足。另外,当温度达到60 ℃和50 ℃及光照达到320 μmol·m-2·s-1时,Y(Ⅱ)趋于0,Y(CEF)/ Y(Ⅱ)出现异常,说明可能是试验处理中温度过高,植株已死亡。
4 结论
综上所述,80~400 μmol·m-2·s-1为2种短命植物的适宜光照范围,卷果涩芥和硬萼软紫草的适宜温度范围分别为25~40 ℃与25~30 ℃,当温度超过此范围后2种短命植物的光合效率与电子传递速率快速下降,发生明显的光抑制,并在50 ℃高温环境下,PS Ⅱ和PS I受到严重损伤,且热耗散和环式电子传递流无法有效保护光合系统,其主要原因是调节性热耗散保护能力不足及PS I受体端激发压积累。在野外环境中,虽然短命植物常受正午短时间内高温强光的胁迫,但植株依然能正常存活,这可能与植物的光修复有关,因此,可在高温强光下对短命植物光损伤的核心原因,如VDE活性和PsbS降解等,以及光修复机制等方面进行进一步的研究,有助于更加全面了解短命植物光合适应机理。
参考文献:
CAMPBELL D, HURRY V, CLARKE AK, et al., 1998. Chlorophyll fluorescence analysis of cyanobacterial photosynthesis and acclimation[J]. Microbiol Mol Biol Rev, 62(3): 667-683.
CHEN M, TANG YL, 2013. Chlorophyll fluorescence characteristics of Amaranthus tricolor L. under high temperature stress[J]. Chin J Ecol, 32(7): 1813-1818.[陳梅, 唐运来, 2013. 高温胁迫下苋菜的叶绿素荧光特性[J]. 生态学杂志, 32(7): 1813-1818.]
CHEN W, 2003. Studies on violaxanthin de-epoxidase activity in wheat plants and its relations to the xanthophylls-cycle-depending thermal dissipation under environmental stress[D]. Taian: Shandong Agricultural University.[陈玮, 2003. 逆境条件下小麦紫黄质脱环氧化酶活性及其与叶黄素循环热耗散关系的研究[D]. 泰安: 山东农业大学.]
CORREA-GALVIS V, POSCHMANN G, MELZER M, et al., 2016. PsbS interactions involved in the activation of energy dissipation in Arabidopsis[J]. Nat Plants, 2(2): 15225.
DENG CN, PAN XL, WANG SZ, et al., 2014. Cu2+ inhibits photosystem Ⅱ activities but enhances photosystem I quantum yield of Microcystis aeruginosa[J]. Biol Trace Elem Res, 160(2): 268-275.
DONG Y, CHEN JW, XIE SQ, et al., 2021. Adaptation of Pinellia ternate photoreaction system to diurnal changes of light and temperature[J]. Guihaia, 41(9): 1486-1496.[董益, 陈军文, 谢世清, 等, 2021. 半夏光系统对光照和温度日变化的适应[J]. 广西植物, 41(9): 1486-1496.]
DONG LQ, 2014. Study on the regulating function of PsbS on the dynamic lattice structure of photosystem Ⅱ supramolecular complex[D]. Beijing: University of Chinese Academy of Sciences.[董连清, 2014. PsbS对光系统Ⅱ超分子复合物动态晶格结构的调节功能研究[D]. 北京: 中国科学院大学.]
DONG LQ, TU WF, LIU K, et al., 2015. The PsbS protein plays important roles in photosystem Ⅱ supercomplex remodeling under elevated light conditions[J]. J Plant Physiol, 172: 33-41.
HAILIANG Z, ZICUN Z, YI Z, et al., 2022. Melatonin reduces photoinhibition in cucumber during chilling by regulating the Calvin-Benson Cycle[J]. Sci Hortic, 299: 111007.
JOHN WS, JOSEPH AB, JEFFREY RS, 1983. Tolerance of photosynthesis to high temperature in desert[J]. Plant Physiol, 74(84): 786-790.
KIM JH, KIM SJ, CHO SH, et al., 2005. Photosystem I acceptor side limitation is a prerequisite for the reversible decrease in the maximum extent of P700 oxidation after short-term chilling in the light in four plant species with different chilling sensitivities[J]. Phy Plantarum, 123(1): 100-107.
KRAMER DM, JOHNSON G, KIIRATS O, et al., 2004. New fluorescence parameters for the determination of QA redox state and excitation energy fluxes[J]. Photosynth Res, 79(2): 209-218.
LEUENBERGER M, MORRIS JM, CHAN AM, et al., 2017. Dissecting and modeling zeaxanthin- and lutein-dependent nonphotochemical quenching in Arabidopsis thaliana[J]. Proc Natl Acad Sci, 114(33): E7009-E7017.
LIU LJ, GAO H, 2018. Photosynthesis and chlorophyll fluorescence characteristics of Ophiopogon japonicus (L.F.) ker-gawl under different shade conditions[J]. Biotechnol Bull, 34(6): 96-101.[刘丽娟, 高辉, 2018. 不同遮阴条件下麦冬光合和叶绿素荧光特性研究[J]. 生物技术通报, 34(6): 96-101.]
LIU P, 2007. Comparative studies on dissection structure and localization of key photosynthetic enzyme among two ephemeral plants, C3 and C4 plant[D]. Urumqi: Xinjiang University.[刘彭, 2007. 两种短命植物与典型的C3和C4植物在结构及光合关键酶定位方面的比较研究[D]. 乌鲁木齐: 新疆大学.]
LU T, MENG Z, ZHANG G, et al., 2017. Sub-high temperature and high light intensity induced irreversible inhibition on photosynthesis system of tomato plant (Solanum lycopersicum L.)[J]. Front Plant Sci, 8: 365.
MAO ZM, 1992. Floristic characteristics of spring ephemeral[J]. Arid Zone Res, 9(1): 11-12. [毛祖美, 1992. 早春短命植物区系特点[J]. 干旱区研究, 9(1): 11-12.]
MAO ZM, ZHANG DM, 1994. The conspectus of ephemeral flora in northern Xinjiang[J]. Arid Zone Res, 11(3): 1-26. [毛祖美, 张佃民, 1994. 新疆北部早春短命植物区系纲要[J]. 干旱区研究, 11(3): 1-26.]
MUNEKAGE Y, HOJO M, MEURER J, et al., 2002. PGR5 is involved in cyclic electron flow around photosystem I and is essential for photoprotection in Arabidopsis[J]. Cell, 110(3): 361-371.
PENG MW, HE H, WANG ZK, et al., 2022. Responses and comprehensive evaluation of growth characteristics of ephemeral plants in the desert-oasis ecotone to soil types[J]. J Environ Manage, 316: 115288.
QI LZ, 2007. Comparative studies on photosynthesis of two desert ephemeral plants Eremurus inderiensis (M. Bieb) Regel and E. anisopterus (Kar. et Kir) Regel[D]. Shihezi: Shihezi University.[齐鲁壮, 2007. 沙生短命植物粗柄独尾草和异翅独尾草光合特性的比较[D]. 石河子: 石河子大学.]
RECCHIA I, SPARLA FS, PUPILLO P, 2017. Photosynthetic properties of spring geophytes assessed by chlorophyll fluorescence analysis[J]. Plant Physiol Biochem, 118: 510-518.
RUMEAU D, PELTIER G, COURNAC L, 2007. Chlororespiration and cyclic electron flow around PS Ⅰ during photosynthesis and plant stress response[J]. Plant Cell Environ, 30(9): 1041-1051.
SI W, ZHUANG DL, ZHANG YW, et al., 2020. Ecological adaptability of ephemeral plants and evolutionary significance[J]. Guangdong Sericult, 54(10): 13-17.[司雯, 莊达淋, 张彦文, 等, 2020. 短命植物的生态适应性及其进化意义[J]. 广东蚕业, 54(10): 13-17.]
SON MJ, PINNOLA A, SCHLAU-COHEN GS, 2020. Zeaxanthin independence of photophysics in light-harvesting complex Ⅱ in a membrane environment[J]. BBA-Bioenergetics, 1861(5-6): 148115.
TANG GL, LI XY, LIN LS, et al., 2013. Effects of short-term phloem girdling on physiology in two desert plants in the southern edge of the Taklimakan Desert[J]. Chin J Plant Ecol, 37(12): 1101-1113.[唐钢梁, 李向义, 林丽莎, 等, 2013. 短期环割对塔克拉玛干沙漠南缘两种荒漠植物的生理影响[J]. 植物生态学报, 37(12): 1101-1113.]
WANG YB, LI YP, 2020. Soil particle size differentiation of Haloxylon ammodendron sand-break forest in southern margin of Gurbantunggut Desert[J]. Bull Soil Water Conserv, 40(3): 75-80.[王永兵, 李亚萍, 2020. 古尔班通古特沙漠南缘梭梭固沙林土壤粒度的分异规律[J]. 水土保持通报, 40(3): 75-80.]
WU HM, SHUANG SP, ZHANG JY, et al., 2021. Photodamage to photosystem in a typically shade-tolerant species Panax notoginseng exposed to a sudden increase in light intensity[J]. Chin J Plant Ecol, 45(4): 404-419.[武洪敏, 双升普, 张金燕, 等, 2021. 短期生长环境光强骤增导致典型阴生植物三七光系统受损的机制[J]. 植物生态学报, 45(4): 404-419.]
WU LS, ZHANG L, TU W, et al., 2020. Photosynthetic inner antenna CP47 plays important roles in ephemeral plants in adapting to high light stress[J]. J Plant Physiol, 251: 153189.
XIAO F, YANG YL, WANG YT, et al., 2017. Effects of low temperature on PS I and PS Ⅱ photoinhibition in cotton leaf at boll stage[J]. Acta Agron Sin, 43(9): 1401-1409. [肖飞, 杨延龙, 王娅婷, 等, 2017. 棉花花铃期低温对叶片PS I和PS Ⅱ光抑制的影响[J]. 作物学报, 43(9): 1401-1409.]
YANG GP, LAI XH, 2020. Research progress on cold resistance of spring ephemeral[J]. Mod Agric Sci Technol, 13(2): 167-168.[杨公甫, 赖晓辉, 2020. 早春短命植物抗寒性研究进展[J]. 现代农业科技, 13(2): 167-168.]
YUAN SL, LIU XC, FAN NN, et al., 2018. Effects of magnesium on growth and photosynthetic system of alfalfa (Medicago sativa L.) under aluminum stress[J]. Chin J Grassl, 40(5): 29-35.[袁世力, 刘星辰, 樊娜娜, 等, 2018. 镁对铝胁迫紫花苜蓿幼苗生长和光合系统的影响[J]. 中国草地学报, 40(5): 29-35.]
ZHANG LY, CHEN CD, 2002. On the general characteristics of plant diversity of Gurbantunggut Sandy Desert[J]. Acta Ecol Sin, 22(11): 1923-1932.[张立运, 陈昌笃, 2002. 论古尔班通古特沙漠植物多样性的一般特点[J]. 生态学报, 22(11): 1923-1932.]
ZHANG QH, ZHANG JY, CUN Z, et al., 2020. Effect of light and temperature on photosystem activitivies of Panax notoginseng[J]. Plant Physiol J, 56(5): 1064-1072.[张强皓, 张金燕, 寸竹, 等, 2020. 光强和高温对三七光系统活性的影响[J]. 植物生理学报, 56(5): 1064-1072.]
ZHANG YF, YU S, LI CF, et al., 2013. Response characteristics of plant growth and leaf photochemical activity of sugar beet seedlings to different nitrogen application levels[J]. J Nucl Agric Sin, 27(9): 1391-1400.[張翼飞, 于崧, 李彩凤, 等, 2013. 甜菜幼苗生长及叶片光化学活性对氮素的响应特征[J]. 核农学报, 27(9): 1391-1400.]
ZHENG LP, 2009. Low carbon economy: the inevitable choice of scientific development[J]. Jiangnan Forum, 8(1): 4-6.[郑立平, 2009. 低碳经济:科学发展的必然选择[J]. 江南论坛, 8(1): 4-6.]
(责任编辑 周翠鸣)
