EMS诱导红阳猕猴桃耐寒突变体的筛选及转录组分析
2023-11-01杨娜叶琴霞魏卓张汉尧
杨娜 叶琴霞 魏卓 张汉尧








摘 要:紅阳猕猴桃(Actinidia chinensis var. chinensis ‘Hongyang’)具有较高的经济价值和营养价值,以及较好的市场开发前景。但近年红阳猕猴桃产区如云南、四川等多地多次遭遇倒春寒等极端天气,其抗寒性差的缺点限制了发展空间。该研究通过在组培的过程中使用甲基磺酸乙酯(EMS)诱导红阳猕猴桃突变体,进而筛选出耐寒突变体,并通过转录组分析探究其胁迫响应机制。该研究以红阳猕猴桃叶片为实验材料,在组培时(4.4 g·L-1 MS+4.5 g·L-1 琼脂+1.5 mg·L-1 6-BA+0.1 mg·L-1 NAA+15 g·L-1蔗糖+0.01~0.10 g·L-1 EMS)利用EMS诱导技术诱导突变体,并在低温环境下筛选出耐寒突变体。选出的耐寒突变体和正常红阳猕猴桃组培苗先进行4 ℃ 12 h寒胁迫处理,再进行转录组测序分析。结果表明:(1)通过初步的表型鉴定,当EMS处理浓度为0.06 g·L-1时诱导的部分突变体具有一定的耐寒性;(2)在转录组测序数据GO功能富集分析中,富集条目最多的是生物学过程;(3)利用KEGG数据库分析时,共筛选到21个差异表达基因在15条通路中得到注释且均为上调表达,其中内质网中的蛋白质加工通路(ath04141)中富集的差异表达基因最多,并且该通路内的sHSF、Hsp70和NEF可能与耐寒机制调控有关。综上研究结果为红阳猕猴桃耐寒种质资源的研究与利用提供了材料基础及理论依据。
关键词: 猕猴桃, 甲基磺酸乙酯(EMS), 耐寒突变体, 转录组, 热激蛋白
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2023)09-1700-10
收稿日期:2022-07-10
基金项目:国家自然科学基金(32160556)。
第一作者: 杨娜(1999-),硕士研究生,主要从事遗传育种研究,(E-mail)yangna1999@swfu.edu.cn。
*通信作者:张汉尧,教授,博士生导师,从事植物和微生物分子遗传研究,(E-mail)zhanghanyao@swfu.edu.cn。
Screening and transcriptome analysis of EMS-induced
cold-tolerant mutants in Hongyang kiwifruit
YANG Na, YE Qinxia, WEI Zhuo, ZHANG Hanyao*
( Key Laboratory of Forest Resources Conservation and Utilization of the Ministry of Education in
Southwest China, Southwest Forestry University, Kunming 650224, China )
Abstract:The Hongyang kiwifruit (Actinidia chinensis var. chinensis ‘Hongyang’) has high economic and nutritional values and good prospects for market development. However, in recent years Hongyang kiwifruit production areas such as Yunnan and Sichuan have been subjected to extreme weather such as inversions on several occasions, and its poor cold resistance has limited its scope for development. In this study, ethyl methanesulfonate (EMS) was used to induce mutants of Hongyang kiwifruit in a tissue culture process, which led to the screening of cold-tolerant mutants and the investigation of their stress response mechanisms through transcriptome analysis. In this study, mutants were induced using EMS induction technology using Hongyang kiwifruit leaves as experimental material in tissue culture (4.4 g·L-1 MS + 4.5 g·L-1 agar + 1.5 mg·L-1 6-BA + 0.1 mg·L-1 NAA + 15 g·L-1 sucrose + 0.01-0.10 g·L-1 EMS) and screened for cold-tolerant mutants under low temperature. Selected cold-tolerant mutants and normal Hongyang kiwifruit tissue culture seedlings were subjected to 4 ℃ 12 h cold stress treatment, while later, transcriptome sequencing analysis was performed. The results were as follows: (1) According to the preliminary phenotypic identification, some of the mutants induced by the 0.06 g·L-1 EMS were phenotypically resistant to cold; (2) In the GO functional enrichment analysis of transcriptome sequencing data, the most enriched entries were in the biological processes; (3) When using KEGG database analysis, a total of 21 differentially expressed genes (DEGs) were annotated in 15 pathways, and which were all up-regulated. The protein processing pathway (ath04141) in the endoplasmic reticulum had the most DEGs, and sHSF, Hsp70, and NEF in this pathway may be related to the regulation of cold-tolerantmechanisms. The above findings provide a material basis and theoretical rationale for the research and utilization of cold-tolerant germplasm resources of Hongyang kiwifruit.
Key words: kiwifruit, ethyl methanesulfonate (EMS), cold-tolerant mutant, transcriptome, heat shock protein
红阳猕猴桃(Actinidia chinensis var. chinensis ‘Hongyang’)果心呈血红色放射状,味甜可口,含有较高的维生素C、维生素E、多种游离氨基酸及矿物质成分,且含有独特的花青素,是兼具保健及美容功能于一体的重要经济作物(张维等,2021)。红阳猕猴桃属于早熟型品种,对低温尤为敏感(马秋诗,2014)。红阳猕猴桃对种植区环境要求较高,需要达到夏季无酷暑、冬季无严寒(黄永红等,2016)。南方多省市近年日降温幅度都超过10 ℃,不断刷新历史气温最低值,这些气候变化导致温度骤降,对猕猴桃产业产生一定影响,严重时导致猕猴桃树体直接冻死(李化龙等,2021)。随着红阳猕猴桃生产的迅速发展和种植面积的不断扩大,气候的异常变化严重制约其发展,低温胁迫成为影响其生长、果实质量和产量的主要因素之一。因此,培育出耐寒性强的红阳猕猴桃种质资源已成为生产中的重要研究内容之一。
近年来,耐寒诱变育种已经被广泛运用于各个植物遗传育种中的抗寒品种选育中,技术也趋于成熟(陈祥韦,2017)。其中,甲基磺酸乙酯(ethyl methanesulfonate, EMS)是目前世界上公认最有效的用于抗性品种选育的化学诱变剂之一,其具有使用方便、特殊性较好、诱变所产生的后代遗传性状比其他诱变育种的后代更稳定等优点(王元东等,1999;彭波等,2007)。王小华等(2010)对柱花草愈伤组织进行化学诱变处理,并通过筛选抗寒突变体选育出优良种质资源。陈祥韦(2017)利用EMS诱变技术处理海雀稗愈伤组织,并对再生植株进行耐寒性鉴定,进而筛选出耐寒材料获得海雀稗耐寒突变体。曹冠男(2018)筛选出EMS诱变小麦的最适处理组合,在所构建的突变群体中筛选出丰富的表型变异。孙慧(2019)以海滨木槿为材料,利用不同浓度EMS进行诱变处理,选择合适的诱变浓度和时间,通过对后期幼苗变异表型的观察、生理指标的测定以及亚显微结构的比较進行抗寒性的筛选与鉴定,获得了海滨木槿抗寒新品种。胡松梅等(2019)在设置0 ℃的光照培养箱中培养经EMS诱导后的铁皮石斛突变体,筛选出20株耐寒能力较高的突变体。
植物转录组学研究是基于RNA水平对某一特定植物器官或组织在某种特定条件下进行其细胞内发生的基因转录、转录后调控、调控后表达的研究,是目前研究基因组水平变化最直接和最常用的方式(崔凯等,2019)。周鹤莹(2020)利用冬枣和金丝小枣冷冻胁迫的转录组数据分析差异表达基因,揭示了ZJDREB1和ZJSOD1在提高枣抗冻过程中的作用。杨宁等(2020)利用EMS诱导技术与转录组测序技术相结合,对矮化性状及其调控的相关基因进行了一系列分析。如今,RNA测序方法已成为分子生物学研究植物抗性功能的重要手段,达到商业化水平并广泛应用于我国相关农林业的研究中,但采用EMS诱导技术与转录组测序技术相结合运用到猕猴桃中还鲜有报道。
红阳猕猴桃营养丰富,经济价值高,但抗寒性差限制了其发展空间,因此通过EMS诱变及筛选,选育出红阳猕猴桃耐寒种质资源,有利于红阳猕猴桃种植产业的发展。中华猕猴桃基因组序列的公布使得深入研究红阳猕猴桃耐寒生物学成为可能。基于已知基因组序列基础上的转录组测序,在基因的挖掘及表达调控方面具有强大的功能,也是研究猕猴桃生长发育及优良性状形成过程中相关基因科学高效的方法。为解决当前红阳猕猴桃抗寒性差,及相关抗寒相关机理不清的问题,本研究拟在组织培养过程中的低温环境下筛选出红阳耐寒突变体并进行转录组水平分析,为选育红心猕猴桃优良种质资源及研究耐寒机理提供了科学依据。
1 材料与方法
1.1 实验材料
本研究采用西南林业大学温室大棚种植的红阳猕猴桃植株健康叶片为实验材料。
1.2 实验方法
1.2.1 组织培养体系建立 按照师万源等(2021)的方法取红阳猕猴桃幼嫩叶片作为外植体,经流水冲洗30 min,于超净工作台内用75% C2H5OH 消毒20 s,再用0.1% HgCl2溶液消毒5 min。叶片切成约1 cm × 1 cm的大小放到4.4 g·L-1 MS + 4.5 g·L-1琼脂 + 15 g·L-1蔗糖 + 2.0 mg·L-1 TDZ + 0.5 g·L-1 IBA培养基中培养诱导愈伤组织,每瓶放置3~4片切好的叶片。待愈伤组织诱导分化不定芽时培养基更换为4.4 g·L-1 MS + 4.5 g·L-1 琼脂 + 15 g·L-1蔗糖 + 0.3 mg·L-1 NAA + 3.0 mg·L-1 6-BA。
1.2.2 EMS诱导与筛选体系建立 突变体诱导时将EMS溶液经0.22 μm的过滤器抽滤灭菌,过滤灭菌后将EMS加入高温灭菌后的培养基(4.4 g·L-1 MS+4.5 g·L-1 琼脂+1.5 mg·L-16-BA+0.1 mg·L-1 NAA+15 g·L-1 蔗糖)中,EMS培养基配制成0.01~0.10 g·L-1诱变浓度,并以不含EMS的培养基为对照组。每个处理分别接种45瓶,接种后将全部培养瓶放置于光照强度2 000 lx、培养温度(26 ± 1) ℃、日照15 h的培养室内,观察并记录统计外植体存活率,以及筛选出50%半致死剂量(LD50)。将EMS诱变的红阳猕猴桃植株与未经诱变植株放在4 ℃冰箱中处理12 h,取出后开始观察其生长状况及进行形态鉴定,初步筛选出耐寒突变植株。
1.3 转录组测序
设置对照组A1、A2、A3 3瓶正常红阳猕猴桃植株组培苗和实验组B1、B2、B3 3瓶红阳猕猴桃耐寒突变植株组培苗经过4 ℃下12 h寒胁迫处理,对其进行取样并用锡箔纸包装并标号,将6个样品寄达陕西博瑞德公司进行转录组测序分析。
1.3.1 测序数据处理 根據实验材料的基因信息和参考基因组,按照过滤标准过滤原始转录组数据中的低质量序列(质量≤20的碱基数占整个Reads的50%以上的低质量Reads)、杂质和接头。
1.3.2 参考基因组序列对比 将RNA- Seq测序所得Clean reads与其参考基因组序列进行序列对比,得到Reads定位信息。通过对比可以得到测序数据利用率及测序样品与参考基因组亲缘关系的远近。
1.3.3 基因表达量分析及差异表达基因检测 通过bowtie2工具将获得的Clean reads与参考转录组序列进行对比,并统计基因对比率。使用RSME分析统计对比结果,获得每个样注释到参考转录组序列的Reads数目,并计算其FPKM值,计算Fragment统计转录并通过FDR检验差异表达基因P value数值,并检验校正P value阈值。差异检验的FDR值越小,其差异倍数越大,所表达差异越显著。
1.3.4 差异表达基因的GO功能富集分析 GO (Gene Ontology)富集分析按照国际标准分类分为3大类,即生物学过程、细胞组成和分子功能。把差异表达基因注释到GO数据库中,将FDR值≤0.05的差异表达基因作为显著富集的基因本位条目。
1.3.5 差异表达基因KEGG富集分析 KEGG(Kyoto Encyclopedia of Genes and Genomes)是关于Pathway的公共基因库,其全称为京都基因与基因组数据库,KEGG主要包括KEGG Pathway、KEGG基因、KEGG基因组、KEGG反应过程等分类。Pathway富集分析是以KEGG途径为单位,将差异表达基因进行注释分类,并运用超几何检验,使用R语言进行富集分析及P value矫正。
1.4 数据处理
生理指标数据采用Excel 2003软件进行数据比较分析,差异表达基因表达量使用SPSS 22.0 软件进行显著性检验(P<0.05)。
2 结果与分析
2.1 EMS诱导体系
2.1.1 不同EMS 处理对红阳猕猴桃愈伤组织死亡率的影晌 红阳猕猴桃叶片经愈伤组织诱导后,对其进行不同浓度10个梯度EMS培养,并设置未添加EMS培养基作为对照组。由表1可知,EMS对红阳猕猴桃生长的抑制作用随EMS浓度增加而增强。当 EMS浓度为 0.06 g·L-1时,死亡率为51.1%,与50%半致死率最为接近,作为LD50进行下一步诱变试验。
2.1.2 突变结果分析 红阳猕猴桃叶部的突变:将EMS共培养后存活的红阳猕猴桃愈伤组织培养30 d,选取不同类型的突变性状进行统计。在叶片中观察到,与CK(图1:A)相比,突变类型有叶形、叶柄、叶色、叶缘和被毛共5种突变,具体见图1。
红阳猕猴桃株形突变:经EMS处理后的红阳猕猴桃的生长能力与对照组相比较弱,表现在株高较矮、叶片发黄等方面。由图2可知,EMS红阳猕猴桃株型突变主要有株高变矮突变、株型稀疏突变、株型紧凑突变和株型松散突变。株高变矮突变植物生长过程较缓慢,叶片颜色较正常植株叶片颜色绿(图2:J);株型稀疏突变和松散突变植株株型较为松散,叶片数量有所减少(图2:K,M);株型紧凑突变植株叶片呈包裹状,无法伸展开来,叶片数量较多(图2:L)。
2.1.3 红阳猕猴桃耐寒突变体筛选及鉴定 将3瓶EMS诱变的红阳猕猴桃植株与3瓶未经诱变植株放在4 ℃冰箱中处理12 h后取出。培养7 d时,发现红阳猕猴桃突变体叶片与对照组叶片相比,红阳猕猴桃突变体叶片仍能保持绿色,对照组叶片边缘部分出现褐化现象,具体见图3:N。
经15 d后,3瓶EMS诱变的红阳猕猴桃植株(表2序号1、2、3)叶片有部分复绿,有新芽长出,而未经诱变处理植株(表2序号4、5、6)枯萎死亡,无新芽长出,具体见图3:O和表2,由此可推测经EMS诱变的部分红阳猕猴桃植株获得了一定的耐寒性。
2.2 转录组测序
2.2.1 测序数据处理 为了保证能够有效保证数据分析的信息准确性和数据质量及其数据可靠性,需要对原始数据进行过滤。由表3可知,共获得43.27 G的Clean bases,其中6个样品的Q20和Q30 的碱基在Clean data中所占的百分比均超过94%,Clean reads中G与C各项碱基之间的百分比均在46%~47%之间;6个样品均未检测到未知碱基。综合分析证明测序质量良好,符合建库要求,可进行下一步分析。
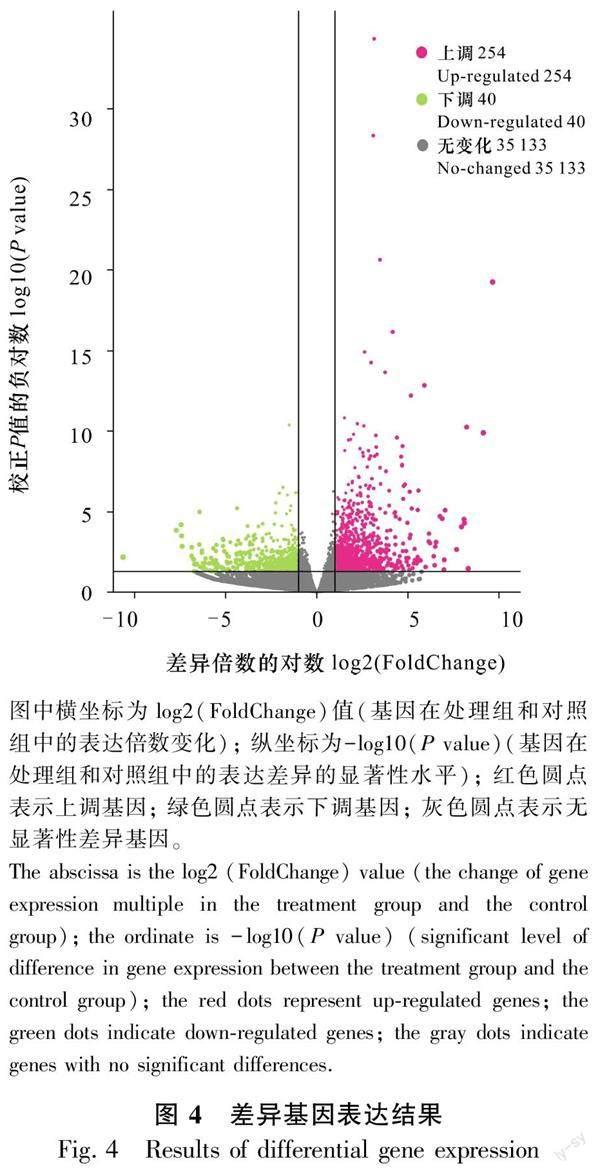
2.2.2 差异表达基因的筛选 同一生物在不同环境条件下其基因表达存在显著差异。由图4可知,结果共筛选出294条差异表达基因,其中上调差异表达基因为254条,占比为86.4%,下调差异表达基因为40条,仅占比13.65%。由此可见,低温胁迫12 h内有大量的冷胁迫响应基因被成功激活,而一部分基因则受到抑制。
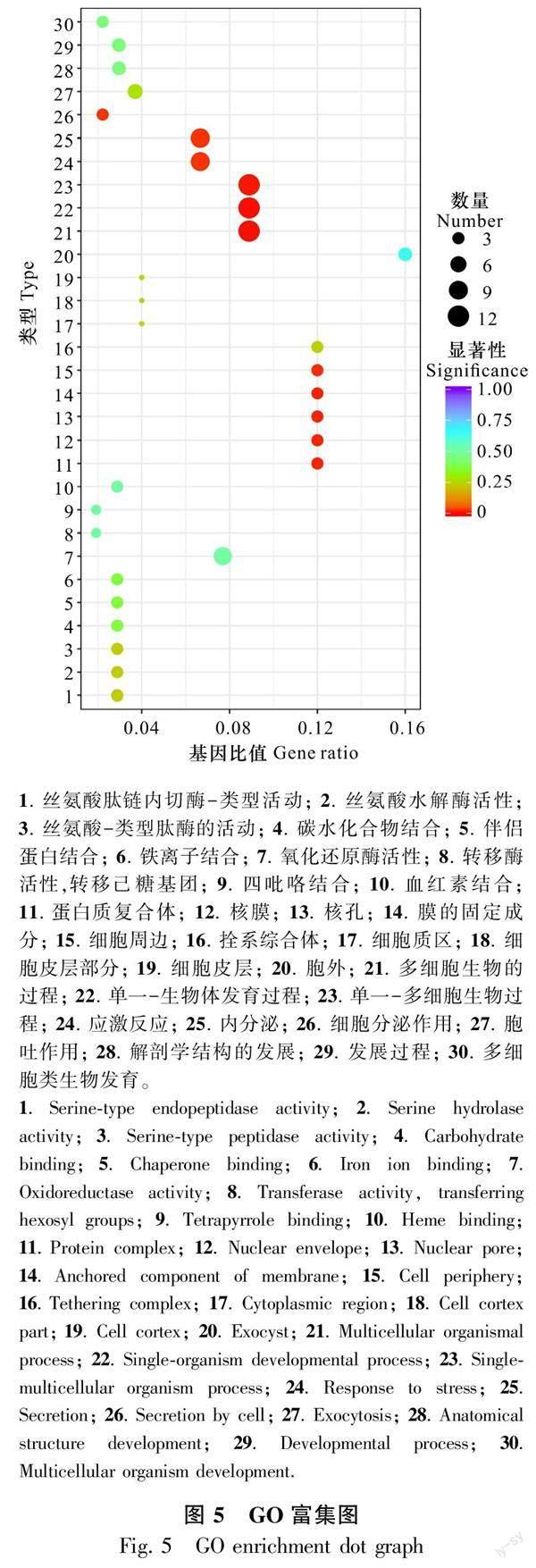
2.2.3 GO功能分析 对红阳猕猴桃处理组与对照组进行GO功能性的分类以及丰富性的分析。GO功能分析主要划分为生物学过程、分子功能和细胞组成3个方面。GO功能富集以显著性值<0.05作为显著性富集的阈值,结果见图5。从GO富集的数据分析统计结果可知,生物学过程部分富集127个功能分类,分子功能部分为104个功能分类,细胞组成部分共富集19个功能分类,3个方面的差异表达基因分别为104条、135条、25条,共264条。其中生物学过程部分富集功能分类最多,位于前五的富集差异表达基因序列条目为多细胞类生物发育、发展过程、解剖学结构的发展、胞吐作用、细胞分泌作用;其次是分子功能部分,位于前五的富集差异表达基因序列条目为活性血红素酶的结合机理作用示例、四吡咯酶的结合机理作用、 转移氧化酶活性作用、 氧化酶的还原酶活性、铁离子的氧化结合机理作用;富集条目最少的是细胞组成部分。这些富集差异表达基因的条目均可能与红阳猕猴桃突变体耐寒性相关。
2.2.4 差异表达基因Pathway功能分析 进行KEGG生物通路分类及富集分析可以确定差异表达基因主要参与的信号传导及生化代谢途径。本研究以P<0.05作为显著性富集的阈值,利用KEGG数据库对红阳猕猴桃两个处理组合中的差异表达基因进行生物通路分析,结果见图6。21个差异表达基因在KEGG通路中得到注释,共富集到15条通路中,且都为上调差异表达基因。其中呈极显著富集(P<0.01)的通路是内质网中的蛋白质加工,共富集9条差异表达基因,呈显著富集(P<0.05)的通路是硫代谢和激素信号转导,分别富集2个和3个差异表达基因;其次为MAPK信号传导途径—植物,共富集2个差异表达基因;只富集1个差异表达基因的通路为色氨酸代谢、2-氧代羧酸代谢、甘油酯代谢、半胱氨酸和甲硫氨酸代谢、RNA降解、mRNA监测途径、胞吞作用、RNA转运、剪接体、碳代谢和氨基酸的生物合成。由于内质网中的蛋白质加工通路呈极显著富集,推测其富集的差异表达基因与耐寒性相关性较高。
2.2.5 内质网中的蛋白质加工通路分析 在紅阳猕猴桃突变体与对照组应答冷胁迫中,内质网蛋白质加工通路中差异表达基因富集最多,这9个基因全部富集在内质网相关降解(endoplasmic reticulum associated degradation, ERAD)过程中且均为上调表达。通路富集差异表达基因表达量见表4,其中与植物温度胁迫相关的热激转录因子(small Heat Shock Factor,sHSF)富集了7个差异表达基因,其表达量最高增加了25.65倍,显著高于未诱导耐寒突变体的对照组(P<0.05);与蛋白质聚合有关的热激蛋白70B(Heat shock protein 70,Hsp70)富集了1个差异表达基因,其表达量高于未诱导处理的3.8倍,差异达显著水平(P<0.05);Hsp70互作蛋白(NEF)富集了1个差异表达基因,其表达量高于未诱导处理的1.86倍,差异达显著水平(P<0.05)。
3 讨论
由于温室气体排放等原因,近年地球气候变化加剧,植物受到高温、低温胁迫的情形更加普遍。低温胁迫通常会致使植物细胞酶活性的降低、膜系统的破坏和细胞的失水等,进而导致其细胞代谢紊乱,甚至是细胞死亡,对作物的产量乃至其生存造成重大影响。因此,选育抗寒或耐寒品种及进行耐寒机理研究成了当今研究的热点(孙慧,2019;胡松梅等,2019;周鹤莹,2020)。近年来在选育优良品种的过程中,使用植物组织培养与诱变技术相结合的离体诱变技术开始逐渐受到人们的关注(王小华等,2010;陈祥韦,2017;胡松梅等,2019)。本研究利用EMS诱变剂处理红阳猕猴桃愈伤组织,发现EMS诱变剂处理可加大植物变异范围,丰富种质资源,通过筛选也获得了耐寒突变体,这与前人的研究结果一致(陈祥韦,2017;孙慧,2019)。
此外,本研究对红阳猕猴桃愈伤组织进行不同浓度梯度的EMS诱变时,观察到部分突变体的生长能力比对照组弱,主要表现在株高较矮、叶片发黄等方面。这可能是由于EMS是非定向诱变剂所致。突变可分为有害突变、有利突变和中性突变,本研究中观察到部分突变体的生长能力变弱,应是有害突变。本研究将EMS诱变的红阳猕猴桃植株与未经诱变植株进行寒胁迫处理,结果表明EMS诱变的部分红阳猕猴桃植株叶片有新芽长出,而对照植株全部枯萎死亡,说明部分经EMS诱变的红阳猕猴桃突变植株具有一定的抗寒性,这应是有利突变。这也进一步证实了EMS诱导的突变是不定向的,有可能导致有害突变,也可以导致有利突变,要得到有用的突变,关键在于筛选。
当植物在遭受寒冷胁迫时,低温会促进细胞内活性氧的产生,同时生物大分子也会受到破坏(张健等,2020)。如在内质网中,蛋白质可以通过内腔伴侣发生折叠,正确折叠后,蛋白质经过包装后进入运输小泡,然后运输到高尔基体中,而在胁迫下发生错误折叠后,蛋白质和分子伴侣作用使之在内质网腔内保留下来(Meusser et al., 2005;李瑞,2015)。随后内质网膜上的“分子伴侣”重链结合蛋白(Bip)和错误折叠后的蛋白质相结合,并在ERAD过程中的蛋白酶体发生降解(Mccracken & Brodsky, 2010)。在本研究的内质网加工通路中,猕猴桃植株在受到冷胁迫后,差异基因在ERAD过程呈上调状态,则可能说明该植物分解末端错误折叠的蛋白质功能增强,压力扰乱蛋白质折叠,从而导致错误折叠或聚集蛋白质的超积累,这种被破坏的蛋白质沉积导致损害细胞组成的蛋白毒性应激,因此生物体必须重新折叠或移除错误折叠的蛋白质才能维持健康生长(Izumi, 2019)。已知,sHSF最初在高温响应中被发现,参与应激反应和“记忆”,而现在普遍认为它们也参与低温响应(Stief et al., 2014)。根据张宁等(2019)通过对比过表达小热激蛋白的番茄(Lycopersicon esculentum)植株和正常植株,发现小热激蛋白能够积极调动起来以对抗逆境胁迫,达到提高番茄耐寒性的目的。史洁玮等(2020)发现低温胁迫下,诱导番茄小热激蛋白基因CI-HSP17.7含量上升,并通过糖含量的变化使番茄果实的耐寒性增强。Waters等(1996)证实了寒胁迫能诱导植物Hsp70的mRNA与蛋白质的合成。宫伟娜等(2009)发现紫茎泽兰(Ageratina adenophora)在冷胁迫下,不同分子量热激蛋白基因通过保护功能蛋白的活性进而增强紫茎泽兰的低温适应能力。同时,在水稻(Oryza sativa)的相关研究中发现,冷胁迫前后热激水稻幼苗的胚根可以明显提升幼苗胚根的耐寒性(Saltveit, 2001)。而NEF是一种Hsp70结合蛋白,通过介入体内分子伴侣体系使之具有稳定细胞质Hsp70的功能,其缺失可导致Hsp70的降解(刘霞霞等,2017)。进一步推测出,受到冷胁迫后的红阳猕猴桃耐寒突变体植株蛋白酶体降解能力加强,这可能是由于蛋白质与在胁迫下形成的热激蛋白大分子寡聚物sHSF相互作用,从而使蛋白质的进一步聚合得到抑制,并与Hsp70、NEF等其他分子伴侣在一定条件下帮助蛋白重新折叠,进而维持蛋白质的正常结构和功能,从而达到增强其抗寒性的目的。结合EMS诱导红阳猕猴桃耐寒突变体及转录组分析,以上研究结果为红阳猕猴桃耐寒种质资源选育及耐寒分子机制研究提供了一定的实验材料及理论参考依据。
4 结论
本研究利用EMS诱导出叶型和株型共12种突变体,最终通过寒胁迫处理筛选出耐寒突变体。进一步将初步筛选出的耐寒突变体与正常红阳猕猴桃植株进行转录组技术分析,结果表明,进行寒胁迫处理的红阳猕猴桃耐寒突变体与对照组红阳猕猴桃正常植株相比,共有差异表达基因294条,其中上调表达254条,下调表达40条。差异表达基因注释到250个GO功能分类和15条KEGG通路中,分析结果显示,内质网中蛋白质加工通道呈极显著富集了9条差异表达基因,且均为上调表达,发现了3类耐寒相关基因,通过分析推测出红阳猕猴桃通过提升sHSF、Hsp70、NEF的表达量来提升其耐寒性。
参考文献:
CHEN XW, 2017. Obtaining cold-tolerant mutants of Puffin tares using EMS mutagenesis[D]. Nanjing: Nanjing Agricultural University.[陳祥韦, 2017. 利用EMS诱变技术获得海雀稗耐寒突变体 [D]. 南京: 南京农业大学.]
GONG WN, 2009. The role of heat stress protein genes in the invasive plant Zingiber officinale during low temperature stress[D]. Beijing: Chinese Academy of Agricultural Sciences.[宫伟娜, 2009. 低温胁迫过程中入侵植物紫茎泽兰热激蛋白基因的作用 [D]. 北京: 中国农业科学院.]
HU SM, ZHOU YS, KANG HY, 2019. Mutagenesis screening of cold-tolerant mutants in Dendrobium ferruginum by diethyl sulfate [J]. Jiangxi Agric, (18): 114-115.[胡松梅, 周永胜, 康和英, 2019. 硫酸二乙酯诱变筛选铁皮石斛耐寒突变体的研究 [J]. 江西农业, (18): 114-115.]
HUANG YH, SHI XZ, LI GY, et al., 2016. Investigation and analysis of freezing damage to kiwifruit at the southern foot of Taishan in 2016[J]. Deciduous Fruits, 48(6): 17-19.[黄永红, 史修柱, 李桂云, 等, 2016. 2016年泰山南麓猕猴桃冻害调查与分析 [J]. 落叶果树, 48(6): 17-19.]
IZUMI M, 2019. Heat shock proteins support refolding and shredding of misfolded proteins [J]. Plant Physiol, 180(4): 1777-1778.
LI HL, WANG JH, ZHANG WM, et al., 2021. Frost damage indicators of fruiting mother branches of the dominant variety kiwifruit under simulated low temperature[J].J Appl Meteorol Climatol, 32(5): 618-628.[李化龙, 王景红, 张维敏, 等, 2021. 模拟低温下主产品种猕猴桃结果母枝冻害指标 [J]. 应用气象学报, 32(5): 618-628.]
LI R, 2015. The regulatory effect ofGAAP1 to endoplasmic reticulum stress in Arabidopsis [D]. Shanghai: East China Normal University.[李瑞, 2015. 拟南芥GAAP1对内质网胁迫的调控作用 [D]. 上海: 华东师范大学.]
LI W, 1996. Study on the mechanism of cold resistance of citrus protoplasts and the screening and culture of cold-resistant protoplasts[D].Wuhan: Huazhong Agricultural University.[李卫, 1996. 柑桔原生质体抗寒机理及抗寒原生质体筛选培养的研究 [D]. 武汉: 华中农业大学.]
LIU FX, 2018. Polyploidy induction and cold resistance mutant screening in Xinjiang Kulle balsam pear[D]. Yangling: Northwest A & F University.[刘凤霞, 2018. 新疆库尔勒香梨多倍体诱导和抗寒突变体筛选 [D]. 杨凌: 西北农林科技大学.]
LIU XX, YANG Y, FU C, et al., 2017. C-terminal is an essential functional domain of plant Fes1 protein[J]. J Univ Jinan (Sci Nat Ed), 31(4): 304-310. [刘霞霞, 杨颖, 付灿, 等, 2017. C末端是植物Fes1蛋白的必需功能域 [J]. 济南大学学报(自然科学版), 31(4): 304-310.]
MA QS, 2014. Effect of temperature pretreatment on postharvest
chilling injury and the expression of CBF transcription factorin ‘Hongyang’ kiwifruit [D]. Yangling: Northwest A & F University.[马秋诗, 2014. 温度预处理对采后‘红阳’猕猴桃果实冷害及其冷诱导转录因子CBF表达的影响 [D]. 杨凌: 西北农林科技大学.]
MEUSSER B, HIRSCH C, JAROSCH E, et al., 2005. ERAD: the long road to destruction [J]. Nat Cell Biol, 7(8): 766-772.
MCCRACKEN AA, BRODSKY JL, 2010. Evolving questions and paradigm shifts in endoplasmic-reticulum-associated degradation (ERAD) [J]. Bioessays, 25(9): 868-877.
PENG B, XU QG, LI HL, et al., 2007. Advances in crop chemical mutagenesis breeding research [J]. Crop Res, 21(B12): 517-519.[彭波, 徐庆国, 李海林, 等, 2007. 农作物化学诱变育种研究进展 [J]. 作物研究, 21(B12): 517-519.]
SALTVEIT ME, 2001. Chilling injury is reduced in cucumber and rice seedlings and in tomato pericarp discs by heat-shocks applied after chilling [J]. Postharvest Biol Technol, 21(2): 169-177.
SHI JW, 2020. Functional study of CI-HSP17.7 in tomato under low temperature stress[D]. Shenyang: Shenyang Agricultural University.[史洁玮, 2020. 低温胁迫下番茄中CI-HSP17.7的功能研究 [D]. 沈阳: 沈阳农业大学.]
SHI WY, XU HD, WEI ZH, et al., 2021. Leaf induction into seedling expansion technology of ‘XU XIANG’ kiwifruit[J]. N Horticul, (24): 16-22.[师万源, 徐红达, 魏卓, 等, 2021. ‘徐香’猕猴桃叶片诱导成苗扩繁技术 [J]. 北方园艺, (24): 16-22.]
宋扬, 1994. 北国抗寒大果桃的新星——血寒一号桃 [J]. 北京农业, (3): 5.
STIEF A, ALTMANN S, HOFFMANN K, et al., 2014. Arabidopsis miR156 regulates tolerance to recurring environmental stress through SPL transcription factors[J]. Plant Cell, 26: 1792-1807.
SUN H, 2019. Preliminary study on EMS mutagenesis of seaside hibiscus and screening of cold-resistant mutants[D]. Jinan: Shandong Normal University. [孙慧, 2019. EMS诱变海滨木槿及抗寒突变体筛选的初步研究 [D]. 济南: 山东师范大学.]
WANG XH, ZHUANG NS, WANG Y, et al., 2010. Combination of DES mutagenesis and in vitro culture for screening of cold-resistant mutants in columnaris[J]. Acta Pratac Sin, 19(1): 263-267.[王小华, 庄南生, 王英, 等, 2010. DES诱变与离体培养结合筛选柱花草抗寒突变体的研究 [J]. 草业学报, 19(1): 263-267.]
WANG YD, ZHAO JR, GUO JL, et al., 1999. Application of mutagenesis breeding in creating new maize germplasm[J]. Beijing Agric Sci, 17(2): 12-16.[王元东, 赵久然, 郭景伦, 等, 1999. 诱变育种在创造玉米新种质中的应用 [J]. 北京农业科学, 17(2): 12-16.]
WATERS ER, LEE GJ, VIERLING E, 1996. Evolution, structure and function of the small heat shock proteins in plants [J]. J Exp Bot, 47(3): 325-338.
YANG N, 2020. Analysis of EMS mutagenic dwarf mutants of‘Heinz 1706’ tomato[D]. Shenyang: Shenyang Agricultural University.[杨宁, 2020. ‘Heinz 1706’番茄EMS诱变矮化突变体分析 [D]. 沈阳: 沈阳农业大学.]
ZHANG J, TANG L, RAN QF, et al., 2020. Advances in transcriptome sequencing of plants in response to low temperature stress[J].Mol Plant Breed, 18(6): 1849-1866.[张健, 唐露, 冉启凡, 等, 2020. 植物响应低温胁迫转录组测序研究进展 [J]. 分子植物育种, 18(6): 1849-1866.]
ZHANG N, 2019. Functional analysis of small heat stress protein SlHSP17.7 in tomato fruits in response to low temperature stress[D]. Shenyang: Shenyang Agricultural University.[張宁, 2019. 小热激蛋白SlHSP17.7在番茄果实响应低温胁迫中的功能分析 [D]. 沈阳: 沈阳农业大学.]
ZHANG W, FU FH, LUO SN, et al., 2021. Quality evaluation and comprehensive analysis of Hunan red heart kiwifruit varieties [J]. Food Ferment Ind, 47(5): 201-210.[张维, 付复华, 罗赛男, 等, 2021. 湖南红心猕猴桃品种品质评价及综合分析 [J]. 食品与发酵工业, 47(5):201-210.]
ZHOU HY, 2020. Transcriptome analysis of jujube freezing stress and functional study of related genes [D]. Beijing: Beijing Forestry University.[周鹤莹, 2020. 枣冷冻胁迫转录组分析及相关基因的功能研究 [D]. 北京: 北京林业大学.]
(责任编辑 周翠鸣)
