基于TLR4/NF-κB 信号通路探讨乙肝宁颗粒对肝纤维化模型大鼠的作用机制
2023-10-31陈思源彭馥芝刘建军朱健芳余望贻刘旺华
陈思源,彭馥芝,刘建军,朱健芳,余望贻,刘旺华*
1.湖南中医药大学科技创新中心,湖南 长沙 410208;2.湖南中医药大学医学院,湖南 长沙 410208;3.湖南中医药大学中医学院,湖南 长沙 410208
肝纤维化(hepatic fibrosis, HF)是肝脏纤维结缔组织异常增生,从而导致肝脏弥漫性细胞外基质异常大量沉积的病理过程,其作为所有慢性肝病的共同病理阶段,是肝硬化与肝癌发生、发展的中间环节[1-2],严重影响患者的日常生活及预后,是临床研究的难点与热点[3]。 随着人们对本病认识的不断深入,具有中医证型特色的HF 动物模型是目前HF的基础研究的主流方向[4-5],对临床治疗具有重要的指导作用。
HF 病理过程复杂,目前临床尚无疗效确切的抗HF 联苯双酯,联苯双酯是临床最常用的药,可保护肝细胞,增加肝脏的解毒功能,疗效令人满意[6-7]。 中医药具有多途径、多靶点、副作用小的特点,在改善HF 方面具有独特优势[8]。 乙肝宁颗粒由白花蛇舌草、白芍、白术、川楝子、丹参、党参、茯苓、黄芪、金钱草、茵陈等药物组成,具有调气健脾、清热利胆、活血化瘀的功效,主要用于慢性迁延性肝炎、慢性活动性肝炎,对HF 也有一定的治疗作用[7-9]。 目前,乙肝宁颗粒对于HF 模型是否有治疗作用,其潜在分子机制如何,尚未相关报道。 Toll 样受体-4(Toll-like receptor 4, TLR4)/核因子κB(nuclear factor-κB, NFκB)信号通路参与炎症的反应过程,TLR4 激活后,介导下游NF-κB 因子活化,诱导单核/巨噬细胞产生免疫炎性细胞因子,引起肝细胞炎性浸润,刺激转化生长因子-β1(transforming growth factor-β1,TGF-β1)大量产生,导致HF的发生[10-11]。 本实验通过建立HF 大鼠模型,从TLR4/NF-κB 通路探讨乙肝宁颗粒抗HF 的疗效机制,为其临床应用提供实验依据。
1 材料与方法
1.1 实验动物
SPF 级SD 大鼠,体质量(160±20) g,64 只(结合课题组前期研究和样本量估算方法[12]所得),雌雄各半,购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0004],饲养于湖南中医药大学实验动物中心[SYXK(湘)2019-0009],自由饮水与摄食,参照GB 14925—2010 标准配备大鼠的生存环境及饲养条件,饮用水要求符合GB-5749 标准。 饲养环境温度为24~26 ℃、湿度为50%~70%,背景噪声30~50 db、光暗周期为12 h/1 d。 所有实验大鼠均适应性喂养1 周后进行实验研究。实验过程中遵照《关于善待实验动物的指导性意见》对实验大鼠进行处置[13],伦理审批号为:LL2019101008。
1.2 主要药物与试剂
乙肝宁颗粒(国药准字Z20064179,规格:17 g/袋×12 袋,九芝堂股份有限公司,批号:20190820);联苯双酯片(规格:25 mg/粒×100 片,购自北京协和药厂,批号:20200322);四氯化碳(上海泰坦化学有限公司,批号:20191027);丙氨酸转氨酶(alanine transaminase, ALT)试剂盒(批号:192442)、谷草转氨酶(aspartate transaminase, AST)试剂盒(批号:192251)、白蛋白(albumin, ALB)试剂盒(批号:201133)、总蛋白(total protein, TP)试剂盒(批号:200534)均购自中生北控生物科技公司;Masson 试剂盒(北京索莱宝科技公司,批号:G1340);兔抗大鼠TLR4 抗体(批号:ab22048)、兔抗大鼠NF-κB抗体(批号:ab288751)均购自英国Abcam 公司;DAB 显色试剂盒(批号:AR1021)、山羊抗兔二抗(批号:BA1039)均购自武汉博士德公司。
1.3 主要仪器
高速冷冻离心机(型号:TGL16,长沙英泰仪器有限公司);全自动血液分析仪(型号:RT-7300,深圳雷杜生命科学股份有限公司);轮转式切片机(型号:RM2235,德国Leica 公司);光学显微镜(型号:Primo Vert,德国Carl Zeiss 公司)。
1.4 动物分组与造模
1.4.1 造模方法 动物适应性饲养5 d 后,将64 只SD 大鼠随机分为空白组(12 只)和造模组(52 只)。造模组采用CCl4皮下注射联合慢性夹尾应激的方法建立肝纤维化(hepatic fibrosis, HF)模型[14],具体方法如下:将CCl4与橄榄油按4∶6 比例配成40%油剂,以3 mL/kg 剂量进行皮下注射,2 次/周,持续注射6 周,并从第5 周开始每笼随机选取一只大鼠进行夹尾刺激,每次刺激30 min,2 次/d,令其与其他大鼠撕打以激怒全笼大鼠。
1.4.2 成模及剔除标准 造模6 周后,随机选择3只大鼠,取肝组织进行病理切片,光镜下观察HF 程度,Metavir 分期均需在F2 以上[15]。 以出现肝细胞损伤、炎症浸润、胶原纤维增生等病理现象判定模型建立成功[16]。
1.4.3 分组方法 将48 只造模成功的大鼠随机分为模型组、乙肝宁颗粒高剂量、乙肝宁颗粒低剂量组和联苯双酯组,每组12 只。
1.5 动物给药及处理
1.5.1 给药 参照《中药药理实验方法学》中动物与人体表面积等效剂量比值表,根据成人的用量,依照公式“大鼠药量=成人剂量×0.018”[17-18],换算得出大鼠灌胃等效剂量。 将乙肝宁颗粒研成细粉末,溶于蒸馏水中,配制成溶液备用。 根据临床药量及预实验结果,设置乙肝宁颗粒高、低剂量组,分别灌胃9.18、4.59 g/kg 乙肝宁颗粒配制后的水溶液,联苯双酯组灌胃50 mg/kg 剂量的联苯双酯水溶液,模型组灌胃等体积生理盐水,每天灌胃1 次,持续4 周。
1.5.2 取材及处理 实验结束后,2%戊巴比妥溶液3 mL/kg 腹腔注射麻醉大鼠,腹主动脉采血,3 000 r/min离心10 min(半径为6.5 cm),分离血清。分离肝脏组织,称量,计算脏器系数,剪取同一叶置于4%多聚甲醛溶液中固定,另取同一叶其他组织采用-80 ℃冰箱进行冻存,用于Western blot 检测。
1.6 指标检测
1.6.1 肝功能指标检测 采用全自动生化分析仪检测血清中肝功能指标ALT、AST、TP、ALB 的水平。
1.6.2 HE 染色观察肝组织病理形态 取固定的肝组织标本,常规梯度乙醇脱水、二甲苯透明,浸入石蜡中包埋,包埋完全后切片,厚度约5 μm,切片脱蜡至水,先后用苏木素、伊红浸染,脱水透明后采用中性树胶封片,光镜下观察肝组织病理形态。
1.6.3 Masson 染色 选取大鼠的肝脏组织,切片制作完成后,浸泡于重铬酸钾溶液中,放置于4 ℃冰箱过夜,然后用双蒸水冲洗,按1∶1 的比例将铁苏木素A 液和B 液混合配制染液,将切片置于染液中染色并冲洗:使用返蓝液进行返蓝,双蒸水冲洗:酸性品红染液浸染切片双蒸水漂洗;然后使用磷铂酸水溶液染色,不漂洗直接将切片放入苯胺蓝染液中;最后使用分化液分化,无水乙醇脱水,二甲苯透明,中性树胶封闭。 染色完成后将切片置于显微镜下观察并采集图像,使用软件进行图像分析。 正常情况下,膀胱组织呈红色,蓝色的胶原纤维分布于平滑肌肌束间和膀胱组织黏膜下等部位。
1.6.4 免疫组织化学法检测大鼠TLR4、NF-κB、TGF-β、Smad3 阳性表达 将肝组织石蜡切片脱蜡、水化,用0.01 mol/L 的枸橼酸钠缓冲液进行抗原热修复,PBS缓冲液冲洗,滴加山羊血清封闭液,室温孵育30 min,加相应一抗(1∶100)孵育过夜;PBS 漂洗3次,每次5 min,反应增强液孵育10 min,二抗(1∶200)稀释液孵育10 min;冲洗,滴加DAB 显色剂,冲洗以终止显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。 将切片置于显微镜下进行拍摄,并采用Image J 软件分析积分光密度(integrated optical density, IOD)值。
1.6.5 Western blot 法检测肝脏TL R4、NF-κB、TGF-β、Smad3 相对表达量 提取肝组织蛋白样本,BCA 试剂盒法测定总蛋白含量。 根据目的蛋白分子量制备分离胶和浓缩胶,上样,12% SDS-PAGE 凝胶电泳至溴酚蓝跑出分离胶后,将蛋白转移至PVDF膜上,5%脱脂奶粉室温下封闭2 h,根据分子量裁剪条带,加入稀释后的一抗[TLR4(1∶1 000)、NF-κB(1∶1 000)、TGF-β(1∶500)、Smad3(1∶800)],4 ℃孵育过夜。 次日用TBST 液洗涤条带4 次,每次10 min,加入二抗(1∶8 000)室温下孵育4 h,TBST 液洗4次,每次10 min,化学发光法显影。应用Image J 软件分析条带灰度值,根据目的蛋白和内参蛋白对应灰度值的比值计算蛋白相对表达水平。
1.7 统计学分析
2 结果
2.1 乙肝宁颗粒对肝郁HF 大鼠肝功能指标的影响
与空白组比较,模型组大鼠肝脏指数及血清AST、ALT 含量均增加(P<0.05,P<0.01),ALB、TP 含量显著下降(P<0.05,P<0.01);与模型组比较,乙肝宁颗粒高、低剂量组大鼠肝脏指数及血清AST、ALT 含量均明显降低(P<0.01),ALB、TP 水平均显著升高(P<0.01);与乙肝宁颗粒高剂量组相比,低剂量组肝脏指数与AST、ALT 水平均升高(P<0.05),ALB、TP水平均降低(P<0.05);与联苯双酯组相比,乙肝宁颗粒高剂量组肝脏指数及血清AST、ALT、ALB 含量差异无统计学意义(P>0.05),TP 水平明显增高(P<0.05)。 详见表1。
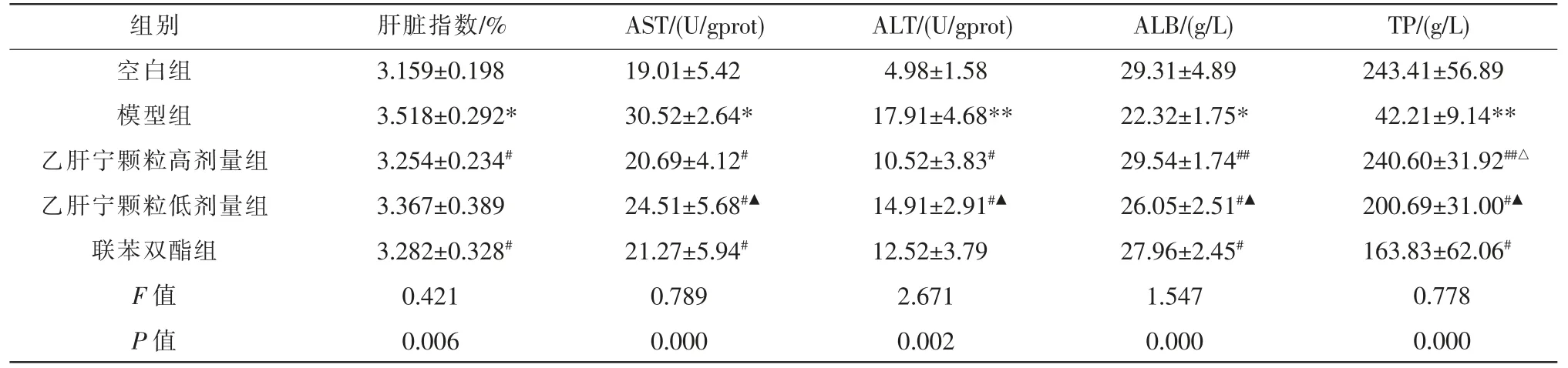
表1 各组大鼠肝脏指数及肝功能指标比较(n=12)
2.2 乙肝宁颗粒对肝郁HF 大鼠组织形态学的影响
HE 染色显示,空白组大鼠肝小叶结构完整且排列整齐,中央静脉清晰可见,无明显组织纤维增生,未见肝组织病变。与空白组相比,模型组大鼠肝细胞排列紊乱,有部分细胞出现变性肿胀坏死,细胞内有大量不规则的脂肪空泡形成,且中央静脉周围可见炎性细胞浸润,纤维结缔组织增生,甚至形成纤维间隔。 与模型组相比,乙肝宁颗粒高、低剂量组及联苯双酯组肝细胞变性情况均改善,空泡现象及炎症细胞浸润减少,肝组织纤维化程度改善,肝细胞少见肿胀和坏死;其中,乙肝宁高剂量组和联苯双酯组改善较为明显,乙肝宁低剂量组肝细胞变性情况仅轻微改善,且有少量的肝细胞出现水肿变性。 详见图1。

图1 乙肝宁颗粒对肝郁HF 大鼠组织形态学的影响(HE 染色,×100)
Masson 染色显示,空白组大鼠肝细胞排列整齐,肝小叶完整。与空白组相比,模型组大鼠有大量胶原纤维沉积在肝小叶和肝窦内,形成纤维间隔包绕肝细胞;与模型组相比,乙肝宁颗粒高、低剂量组及联苯双酯组肝组织损伤程度均有明显改善,脂肪空泡明显减少,胶原纤维沉积程度减轻。 详见图2。
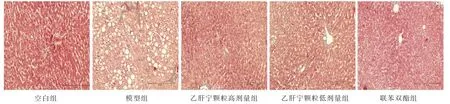
图2 乙肝宁颗粒对肝郁HF 大鼠组织形态学的影响(Masson 染色,×100)
2.3 乙肝宁颗粒对肝郁HF 大鼠TLR4、NF-κB、TGF-β、Smad3 阳性表达的影响
免疫组织化学实验可将切片组织中TLR4、NFκB 蛋白所在区域显色为棕黄色。 与空白组比较,模型组大鼠肝组织可见大片散在棕黄色细胞;与模型组比较,乙肝宁颗粒高、低剂量组及联苯双酯组中存在少量棕黄色细胞。 详见图3。

图3 乙肝宁颗粒对肝郁HF 大鼠TLR4、NF-κB、TGF-β、Smad3 阳性表达的影响(免疫组织化学,×200)
与空白组相比,模型组TLR4、NF-κB、TGF-β、Smad3 IOD 值均增加(P<0.01);与模型组比较,乙肝宁颗粒高、低剂量组和联苯双酯组组TLR4、NFκB、TGF-β、Smad3 IOD 值均降低(P<0.05);与乙肝宁颗粒高剂量组相比,低剂量组TLR4 和NF-κB IOD 值升高(P<0.05),高剂量组与低剂量组之间TGFβ 和Smad3 的表达无统计学意义(P>0.05);与联苯双酯组相比,低剂量组TLR4、NF-κB、TGF-β、Smad3 IOD 值均增加(P<0.05),联苯双酯组与高剂量组差异无统计学意义(P>0.05)。 详见表2。
表2 各组大鼠肝组织TLR4、NF-κB、TGF-β、Smad3 蛋白IOD 值比较(±s,n=12)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与联苯双酯组比较,△P<0.05;与乙肝宁颗粒高剂量组相比,▲P<0.05。
组别空白组模型组乙肝宁颗粒高剂量组乙肝宁颗粒低剂量组联苯双酯组F 值P 值TLR4 0.248±0.044 0.342±0.044*0.219±0.049#0.286±0.027△0.208±0.033##0.15 0.002 NF-κB 0.186±0.054 0.304±0.018**0.211±0.044##0.230±0.045#▲△0.201±0.028##1.868 0.000 TGF-β 0.212±0.002 0.675±0.112**0.336±0.232##0.309±0.087#△0.320±0.113##0.342 0.000 Smad3 0.289±0.177 0.587±0.221**0.389±0.003##0.310±0.022#△0.378±0.444##0.201 0.003
2.4 乙肝宁颗粒对肝郁HF 大鼠TLR4、NF-κB 蛋白表达水平的影响
与空白组比较,模型组大鼠肝组织TLR4、NFκB 蛋白表达均显著上调(P<0.01);与模型组比较,乙肝宁颗粒高、低剂量组及联苯双酯组TLR4、NFκB 的表达均明显降低(P<0.01),其中,高剂量组蛋白表达水平低于低剂量组(P<0.01),联苯双酯组与高剂量组无明显差异(P>0.05)。 详见表3。
表3 乙肝宁颗粒对HF 大鼠肝组织TLR4、NF-κB表达的影响(±s,n=12)

表3 乙肝宁颗粒对HF 大鼠肝组织TLR4、NF-κB表达的影响(±s,n=12)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与联苯双酯组比较,△P<0.05;与乙肝宁颗粒高剂量组相比,▲P<0.05。
组别空白组模型组乙肝宁颗粒高剂量组乙肝宁颗粒低剂量组联苯双酯组F 值P 值TLR4 相对表达量0.173±0.024 0.404±0.050**0.249±0.031##0.320±0.040#△▲0.182±0.028##0.326 0.000 NF-κB 相对表达量0.328±0.029 0.544±0.078**0.413±0.046##0.434±0.043#△▲0.377±0.050##0.168 0.000
2.5 乙肝宁颗粒对HF 大鼠TGF-β、Smad3 表达水平的影响
与空白组比较,模型组大鼠肝组织TGF-β、Smad3 蛋白表达均显著上调(P<0.01);与模型组比较,乙肝宁颗粒高、低剂量组及联苯双酯组TGF-β、Smad3 的表达均明显降低(P<0.01),其中,高剂量组降低的程度高于低剂量组(P<0.01),联苯双酯组与高剂量组无明显差异(P>0.05)。 详见表4。
表4 乙肝宁颗粒对HF 大鼠肝组织TGF-β、Smad3表达的影响(±s,n=12)

表4 乙肝宁颗粒对HF 大鼠肝组织TGF-β、Smad3表达的影响(±s,n=12)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与联苯双酯组比较,△P<0.05;与乙肝宁颗粒高剂量组相比,▲P<0.05。
组别空白组模型组乙肝宁颗粒高剂量组乙肝宁颗粒低剂量组联苯双酯组F 值P 值TGF-β 相对表达量0.976±0.454 1.813±0.753**1.165±0.488##1.201±0.320#△▲1.147±0.485##0.322 0.000 Smad3 相对表达量1.439±0.861 3.445±1.327**1.932±1.195##1.998±1.231#△▲1.894±1.097##0.118 0.000
3 讨论
中医学中无“肝纤维化”的病名,根据其临床症状,可归属于“积聚”“癥瘕”“胁痛”“膨胀”等范畴,肝纤维化的原发病因各异,临床表现虽有不同,但是基本病机为正虚邪盛,邪毒久稽,肝络受损,气滞血瘀,可归纳为“虚损生积”。 乙肝宁颗粒是治疗慢性肝炎的常用药,由黄芪、白花蛇舌草、茵陈、金钱草、党参、蒲公英、制何首乌、牡丹皮、丹参、茯苓、白芍、白术、川楝子13 味中药组成。 方中黄芪补气健脾利水,茵陈清热利湿,丹参活血祛瘀、通络止痛,三药共为方中之君药;辅以金钱草、蒲公英、白花蛇舌草助茵陈清热利湿、退黄疸,党参、白术、茯苓补气健脾、燥湿利湿,以增强黄芪扶正祛邪之功,牡丹皮活血祛瘀、清热凉血;佐以何首乌滋补肝肾之阴,川楝子清热行气止痛,白芍养血柔肝、缓急止痛。 诸药合用,共奏调气健脾、清热利胆、活血化瘀之功。
HF 是一种慢性肝损伤所致的持续性病理改变,其主要病理学表现为肝内细胞外基质合成与降解平衡失调,在HF 过程中肝星状细胞的增殖活化与肝内细胞外基质的大量沉积密切相关[19]。HF 发病机制的相关研究显示,肝星状细胞(hepatic stellatecell, HSC)激活与转化是肝脏纤维化形成的关键,TGF-β1 在肝脏纤维化形成的过程中起着非常重要的作用。 TGF-β1 是促进HSC 活化,并促进细胞外基质(extracellular matrix, HSC)表达细胞外基质(extracellular matrix, ECM)的关键因子。 TGF-β1能促进HSC 合成弹性蛋白、黏着蛋白、胶原及蛋白聚糖等细胞外基质,减少降解蛋白酶的合成,从而阻止新合成ECM 的分解,打破了ECM 合成与降解的平衡,使ECM 的沉积增多,加速肝脏纤维化的发展。TGF-β1 的促纤维化作用主要通过下游Smads 家族中Smad3 传递信号,相关研究表明TGF-β/Smad 信号途径在HF 的发病机制中发挥了关键作用[20]。
AST 和ALT 是临床上用于检测肝功能的指标,正常情况下两者活性较低,而当肝细胞受到损伤时会发生变化,故其活性的高低在一定范围内可反映肝细胞受损的程度[21]。TLR4 作为重要的模式识别受体,主要分布在HSC、肝细胞、肝巨噬细胞等细胞中[22],可特异性识别致纤维化因子脂多糖,激活下游NFκB 通路,TGF-β1、TNF-α 等炎症因子被激活,继续正反馈作用于NF-κB通路,进一步参与HSC 细胞活化和炎症反应,导致一系列炎性介质的大量释放,从而加重肝损伤[23-24]。 可见,TLR4/NF-κB 信号通路异常与肝损伤关系密切。研究表明,TLR4/NF-κB 信号通路介导体内炎症反应,肝脏受损时TLR4/NFκB 信号通路介导的体内炎症反应表达上升[25]。研究发现,HF 模型大鼠肝组织中TLR4 和NF-κB 蛋白大量表达[26],与本研究中模型组的蛋白表达量一致。
有研究表明,HF 模型大鼠肝内TLR4、NF-κB表达的增加,可能与肝组织出现的病理改变有关[27]。本研究通过四氯化碳腹腔注射建立HF 大鼠模型,在团队前期临床观察、文献调研以及数据分析的基础上,选用乙肝宁颗粒进行研究。结果发现:与空白组比较,模型组大鼠肝脏指数、血清AST 及ALT 含量均增加,ALB 和TP 含量显著下降,出现肝细胞变性、空泡形成、炎性浸润和胶原纤维沉积等病理表现;表明四氯化碳腹腔注射可诱导HF 模型大鼠出现肝细胞损伤和炎症反应。与模型组比较,乙肝宁颗粒高、中低剂量组和联苯双酯组均可改善HF 模型大鼠肝脏组织病理表现,降低肝脏指数、血清AST及ALT 的含量,升高ALB 和TP 含量,反映了3 种治疗方法均具有疗效,但仍具有一定的差异性,从研究中可以发现,低剂量乙肝宁颗粒的疗效低于高剂量组,表明在乙肝宁颗粒的用药剂量上,高剂量可获得更佳的疗效。 通过观察肝脏组织中TLR4、NF-κB、TGF-β、Smad3 蛋白表达水平发现,与空白组相比,模型组大鼠肝脏组织中TLR4、NF-κB、TGF-β、Smad3 蛋白的表达显著升高,表明HF 模型大鼠肝脏组织的病理改变可能与上述蛋白的升高有关。 经治疗后发现,上述蛋白的水平明显下降,可以推断发挥疗效的作用机制可能与降低TLR4、NF-κB、TGFβ、Smad3 蛋白的表达有关,其中,低剂量乙肝宁颗粒疗效低于高剂量组,表明高剂量的乙肝宁颗粒疗效更佳。
综上,本次实验发现,乙肝宁颗粒改善肝脏组织病理表现、发挥疗效的机制可能与降低肝脏组织中TLR4、NF-κB 蛋白的表达有关。 本文仅从药效评价的角度入手,观察乙肝宁颗粒在治疗HF 过程中可能存在的作用机制,在今后的实验研究中,计划进一步结合功能获得和缺失试验验证方能确定是否为该通路,从而探索其中深层次的作用机制,为临床运用乙肝宁颗粒治疗HF 提供理论依据。
