参苓白术散调控TLR4/NF-κB 通路抑制LPS 诱导心肌细胞炎性损伤的机制
2023-10-31王一阳
黄 娟,王一阳,肖 凡,刘 秀,喻 嵘*
1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208
糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病主要的心血管并发症之一,是糖尿病患者心力衰竭高发生率和高死亡率的主要病因[1-2]。 目前,DCM 的发病机制及诊治方面的研究尚有许多未知领域和难点。 近年研究认为,DCM 是心肌在长期高血糖状态下发生的一种慢性炎症性疾病[3]。 研究报道,糖尿病患者的血清和糖尿病动物模型的心肌组织中,多种炎症因子的表达水平显著升高[4-5]。因此,早期抑制炎症级联反应是防治DCM 的一个新靶点。 Toll 样受体4(Toll-like receptor 4, TLR4)作为炎症反应的重要受体及机体免疫防御系统中的重要组成,是免疫反应与慢性炎症的桥梁[6]。 但TLR4是否介导DCM 早期炎症损伤的发生发展,需要进一步探究。
新近研究表明,肠道菌群具有内分泌器官的特征,可通过调节机体代谢及免疫炎症反应影响糖尿病心肌病的病理进程[7]。 肠道微生物群落参与机体免疫细胞的分化成熟,生理状态下,肠上皮细胞结构完整并通过宿主模式识别受体,调控菌群结构,维持内环境稳态;当肠黏膜屏障损伤时,通透性增加,大量促炎物质[如脂多糖(lipopolysaccharide, LPS)]通过通透性升高的肠屏障进入血液循环到达心脏组织,直接激活TLR4 相关通路,诱导病原相关模式分子信号活化,触发局部炎症级联反应;另一方面,心肌细胞功能缺失,并出现大量细胞死亡,与黏附因子相互作用产生炎症效应,引起心肌纤维化及心室重构等病理状态出现[8-9]。 前期临床研究表明,以益气健脾立法组方的参苓白术散可调节糖脂代谢,对心血管疾病疗效确切[10]。 同时,体内实验证实,其可改善脂代谢和减少肠道炎症因子释放,减缓血管病变的风险,抑制免疫炎症反应过度损伤,但其靶向调控心血管的机制需要进一步研究[11-12]。 故本研究进行体外细胞实验研究,拟以心肌细胞作为研究对象,从免疫炎症角度出发,探讨参苓白术散含药血清对肠道代谢物LPS 介导的TLR4/核因子κB(nu clear factor-κB, NF-κB)信号通路及炎症相关因子白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)表达的影响。
1 材料
1.1 动物与细胞株
20 只8 周龄SD 雄性大鼠,体质量200~220 g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号:SCXK(湘)2019-0004,于湖南中医药大学第一附属医院实验动物中心进行饲养;温度(22±2) ℃,湿度50%~65%,自由饮食、饮水,12 h/12 h光/暗周期(光照时间为6:00~18:00)。 本研究经湖南中医药大学实验动物伦理委员会批准,批准号:430727221101382931。 大鼠H9C2 心肌细胞(批号:CL-0089),购自武汉普诺赛生物科技有限公司。
1.2 药物
参苓白术散由人参、茯苓、白术(炒)、山药、白扁豆(炒)、莲子、薏苡仁(炒)、砂仁、桔梗、甘草组成,批号:22101037,国药准字号:Z110020755,购自北京同仁堂股份有限公司同仁堂制药厂。
1.3 主要试剂与仪器
胎牛血清(批号:SA210518)、胰蛋白酶-EDTA消化液(批号:WH0221A171)、高糖DMEM 培养基(批号:WH0022P299)、PBS 缓冲液(批号:AD17792273)、CCK-8 检测试剂盒(批号:AI07246697)、无血清细胞冻存液(批号:WH0221A091)均购自武汉普诺赛生命科技有限公司;兔抗TLR4 多克隆抗体(批号:ab13556)、兔抗核因子κB p56(nuclear factor-κB p56,NF-κB p56)单克隆抗体(批号:ab207297)、兔抗NFκB 抑制蛋白α(degradation of protein κB-α, IκBα)单克隆抗体(批号:ab32518);兔抗TNF-α 单克隆抗体(批号:ab215188)、兔抗IL-1β 单克隆抗体(批号:ab234437)均购自英国Abcam 公司。
SW-CJ-2G 型超净工作台(美国Thermo Scientific 公司);TGL-18R型冷冻高速离心机(德国Eppendorf公司);YP1002N 型电子天平(上海精密科学仪器有限公司);EnSpire2300 型多功能酶标分析仪(新加坡PerkinElmer 公司);JSM-6700F 型扫描显微镜(日本Jeol 公司)。
2 方法
2.1 含药血清制备
将20 只SD 大鼠适应性喂养1 周后,随机分成2 组:空白血清组、参苓白术散含药血清组,每组10只。 给药剂量为等效剂量的5 倍,依据体表面积方法换算[13],参苓白术散含药血清组大鼠用药剂量=(5×12 g×6.3)/70 kg=5.4 g/kg,给予参苓白术散药液灌胃;空白血清组采用等容量的灭菌超纯水灌胃,每日1 次,连续7 d。 末次灌胃1 h 后,腹主动脉取血,用含肝素抗凝管收集血液,静置3 h 后;以3 000 r·min-1离心(离心半径10 cm)15 min,收集上层血清,0.22 μm一次性滤过器过滤,56 ℃恒温水浴锅灭活30 min;将灭活的血清分装至无菌EP 管中标记,置于-80 ℃保存。
2.2 含药血清浓度筛选
取对数生长期的H9C2 细胞接种于96 孔板中,按照每孔100 μL、每孔5×103个细胞,在5%CO2、37 ℃条件下培养24 h,弃去培养基,设空白对照组、空白血清组及含药血清组,设置5%、10%、15%、20%、25%的浓度梯度。 培养24 h 后,吸弃上清液,每孔加入CCK-8 溶液10 μL 及完全培养基90 μL,2 h 后用酶标仪在450 nm 波长处检测各组细胞的OD 值。
2.3 细胞分组及处理
H9C2 细胞用10%胎牛血清DMEM 培养液调整细胞密度为5×104/mL,接种于6 孔板中,予以10 μg/mL LPS 干预处理24 h 后收集细胞。随机分成空白血清组(10%空白血清)、模型组(10 μg/mL LPS+10%空白血清)、参苓白术散含药血清组(10 μg/mL LPS+10%参苓白术散含药血清)及TAK-242组(10 μg/mL LPS+5 μmol/L TAK-242[14])。
2.4 CCK-8 法筛选含药血清干预浓度
H9C2 细胞以5×104mL-1密度接种至96 孔板中,放入37 ℃、5% CO2细胞培养箱中培养24 h;吸弃培养基后,分别加入稀释后的胎牛血清、空白血清及含药血清,每组设置5%、10%、15%、20%、25%的浓度梯度,每组均设6 个复孔。干预处理24 h 后,每孔加入10 μL CCK-8 溶液及90 μL 完全培养基,培养箱孵育2 h 后采用酶标仪在450 nm 波长下检测各组细胞的OD 值。
2.5 ELISA 法检测细胞IL-1β、TNF-α 含量
取生长良好的H9C2 细胞按照分组干预后,吸取细胞上清液,以3 000 r·min-1(离心半径15 cm)离心20 min,取上清液检测。 分别设空白孔、待测样品孔。 在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀;每孔加入酶标试剂100 μL,空白孔除外;用封板膜封板后置37 ℃温育60 min;弃去液体,甩干,每孔加满洗涤液,静置30 s 后弃去;每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色15 min;加终止液50 μL,终止反应;以空白孔调零,450 nm 波长依序测量各孔的OD 值,计算IL-1β、TNF-α 含量变化。
2.6 免疫荧光法检测IL-1β、TNF-α 蛋白表达
将H9C2 细胞按照每孔1×105个细胞接种于含细胞爬片的6 孔板。按照分组加入相应药物干预,培养24 h 后,以4%预冷的多聚甲醛溶液对细胞进行固定(15 min),PBS 溶液洗3 遍后加入5% BSA 封闭30 min,加入稀释的IL-1β、TNF-α(1∶50)一抗孵育过夜;滴加稀释的IgG/FITC 二抗孵育60 min;洗涤后复染核,然后进行封片,荧光显微镜下观察。
2.7 Western blot 法检测TLR4、NF-κB p65、IκBα蛋白表达
将H9C2 细胞以5×105/mL 的细胞密度接种于6孔板中,细胞培养24 h 后,按照分组加入相应药物干预,培养24 h 后,弃培养上清液,用PBS 洗涤2次,加入适量RIPA 裂解液重悬;低温下匀浆后将样品转移至1.5 mL 离心管中,以12 000 r·min-1(离心半径10 cm)离心5 min,取上清液分装。 采用BCA法测定蛋白浓度后,进行丙烯酰胺凝胶电泳,转膜切胶后封闭,加入一抗TLR4(1∶1 000)、NF-κB p65(1∶1 000)、IκBα(1∶1 000)抗体,4 ℃下孵育过夜;PBST洗膜3 次,加入HRP 标记的山羊抗鼠IgG(1∶5 000)、山羊抗兔IgG(1∶5 000)二抗,室温孵育90 min。PBST洗膜3 次,ECL 显色液中显影1 min,冲洗胶片、扫描。
2.8 统计学方法
采用SPSS 22.0 进行统计处理。 计量资料满足正态性和方差齐性者用“±s”表示,多组间比较用单因素方差分析,组间比较用LSD 检验;不满足正态性和方差齐性者用Tamhane's T2 检验。P<0.05 表示差异有统计学意义。
3 结果
3.1 参苓白术散含药血清对H9C2 细胞增殖的影响
与空白对照组相比,参苓白术散含药血清组及空白血清组在10%浓度水平的OD 值差异无统计学意义(P>0.05);而参苓白术散血清浓度为5%、15%、20%、25%时,OD 值明显降低,细胞增殖受到抑制,差异有统计学意义(P<0.01)。 结果表明,10%参苓白术散含药血清对H9C2 细胞无明显毒性作用,故以此浓度作为后续实验含药血清的干预浓度。详见图1。
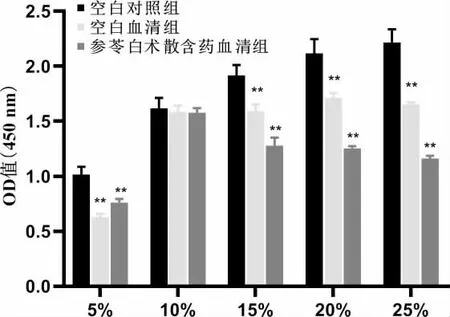
图1 各组H9C2 细胞增殖情况比较(±s,n=6)
3.2 参苓白术散含药血清对H9C2 细胞中TNF-α、IL-1β 水平的影响
与空白血清组相比,模型组H9C2 细胞释放的TNF-α、IL-1β 含量增加(P<0.01)。 与模型组相比,参苓白术散含药血清组及TAK-242 组细胞中的TNF-α、IL-1β 含量显著降低(P<0.01)。 详见图2。

图2 各组H9C2 细胞中TNF-α、IL-1β 水平比较(±s,n=6)
3.3 参苓白术散含药血清对H9C2 细胞IL-1β、TNF-α 蛋白表达的影响
与空白血清组比较,模型组H9C2 细胞的IL-1β、TNF-α 的平均OD 值明显增加(P<0.01)。与模型组比较,参苓白术散含药血清组及TAK-242 组细胞的IL-1β、TNF-α 平均OD 值明显下降(P<0.01)。 详见图3。
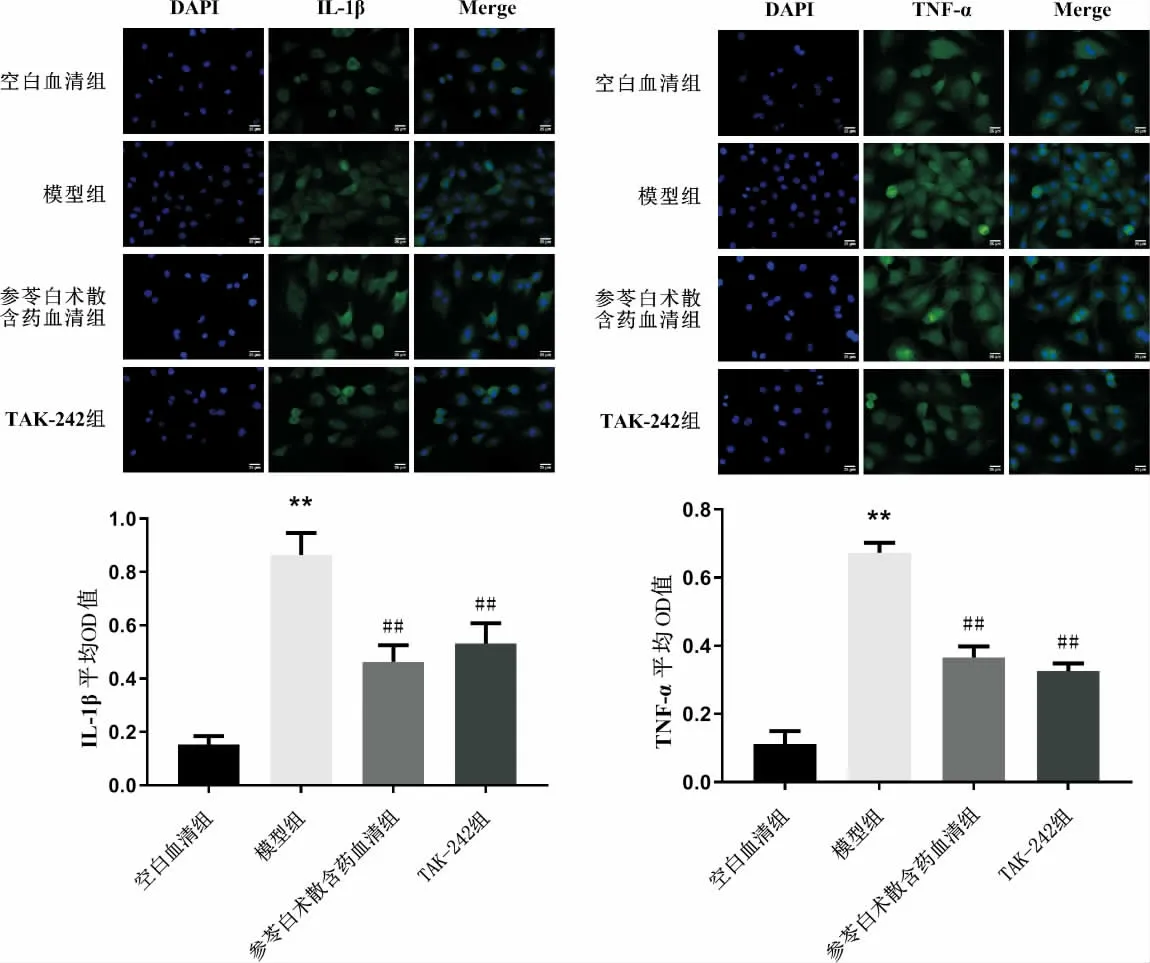
图3 各组H9C2 细胞IL-1β、TNF-α 蛋白表达比较(±s,n=6)
3.4 参苓白术散含药血清对H9C2 细胞TLR4、NFκB p65、IκBα 蛋白表达的影响
与空白血清组相比,模型组H9C2 细胞内TLR4、NF-κB p65、IκBα 蛋白表达显著增加(P<0.01)。 与模型组相比,参苓白术散含药血清组及TAK-242 组细胞的TLR4、NF-κB p65、IκBα 蛋白表达减少(P<0.01)。详见图4。

图4 各组H9C2 细胞TLR4、NF-κB p65、IκBα 蛋白表达比较(±s,n=6)
4 讨论
据最新国际糖尿病联盟的数据统计,目前全球约有4.25 亿糖尿病患者,且呈现逐年上升的趋势,预计到2045 年将达到7 亿[15]。持续的血糖增高可诱导机体代谢紊乱、免疫炎症反应及氧化应激等多种病理状态出现,引起机体组织及细胞的损伤,而糖尿病心血管并发症是糖尿病患者的主要死亡原因[16]。DCM 是糖尿病常见并发症之一,是独立于冠心病及高血压的特异性心肌病,其发病机制尚未完全阐明。糖尿病心肌病既有“消渴”症状,也存在“心病”表现。中医学认为,先天不足或后天失养及他脏病变累及脾胃,可导致其胃火偏盛,脾阴亏损,运化不能,气机失畅,水谷精微疏布失常,痰浊内生。病程迁延不愈,气阴耗伤,久病内舍于心,心气不足,运血无力,心阴亏虚,则燥热内盛,暗耗心血,瘀滞内生。 脾不散精是DCM 的中医病机关键,故选用参苓白术散,探究从脾治心的科学内涵。 方中君药人参、白术、茯苓益气健脾,渗湿化浊;臣以莲子、山药补气生津;合用白扁豆、薏苡仁、砂仁健脾渗湿,行气化滞;桔梗宣通肺气,载药上行于心肺为佐;甘草健脾和中,调和诸药。 全方以补中气、渗湿浊、行气滞为要。 近年来,随着肠道微生态相关内容的研究深入,发现肠道菌群与DCM 的发生密切相关[17-18]。 肠道菌群与宿主免疫系统相互协调平衡,维持机体内环境稳态。 正常状态下,肠道屏障功能能够抑制病原微生物的蓄积及移位,并通过宿主模式识别受体(pattern recognition receptor, PRR)感知微生物的异常活动,激活免疫反应识别清除;而病理情况下,出现肠道渗漏、肠屏障功能降低、肠道通透性升高,伴随肠道菌群丰度及结构变化,可触发局部炎症反应,大量释放的炎症因子可进入循环,发生移位,靶向损伤心肌细胞[19-20]。微生物相关模式分子和LPS 是肠道菌群与宿主相互作用的主要介质,可与PRR 识别结合,直接作用于免疫系统,并诱导炎症级联反应,促进DCM 的发生发展。
TLR4 是一种广泛表达于心肌细胞表面的PRR,可响应不同病原相关分子模式,启动识别、靶向结合并诱导一系列的信号传输,在机体内环境免疫炎症调控中具有重要作用,与心血管疾病紧密相关[21-22]。 持续的代谢紊乱状态及氧化应激可触发机体免疫炎症反应,TLR4 可识别并激活机体的免疫细胞,促使炎症介质及趋化因子释放,同时活化经典的下游炎症信号转录因子NF-κB。 在静息状态下,NF-κB 常以2 个亚单位p65 和p50 结合成异源二聚体,与IκB 抑制蛋白家族结合,形成一个稳定的三聚体,存在于细胞质中[23-24]。IκBα 是IκB 家族中的一员,是NF-κB 蛋白的主要抑制剂,当受到细胞外信号刺激时,IκBα 发生泛素化、磷酸化并降解,IκB从三聚体中解离出来,释放p65/p50,进行核移位,使其移至细胞核与靶基因启动区或增强子的NFκB p65 位点结合,上调IL-6、IL-8、TNF-α 等促炎因子的表达[25-26]。 IL-1β、TNF-α 可协同介导免疫炎症反应的级联放大[27]。 IL-1β 是炎性反应启动因子,应激状态下,以前体形式剪切活化,IL-1β 释放增加可促进血管细胞分泌大量的黏附因子,介导氧自由基及炎性递质蓄积[28]。 同时,可上调TNF-α 的合成与表达,激活凋亡通路,加快心肌细胞凋亡[29-30]。 本研究以LPS 作为诱导剂,模拟“肠漏”状态下,LPS 通过循环诱导心肌细胞炎症损伤的过程。 采用CCK-8法检测细胞增殖抑制率,筛选含药血清浓度,10%参苓白术散含药血清对细胞增殖状态无明显影响,故选做实验含药血清干预浓度。 研究结果显示,参苓白术散含药血清可有效抑制H9C2 细胞中TNF-α、IL-1β 的含量,降低炎症因子的释放。 H9C2 细胞在LPS 刺激后,可激活炎症相关通路,参与细胞炎性损伤过程。 本研究中,与空白血清组比较,LPS 诱导的模型组H9C2 细胞TLR4、NF-κB p65、IκBα 及TNF-α、IL-1β 蛋白表达明显上调,继发的炎性反应明显。 而参苓白术散含药血清可抑制TLR4/NF-κB通路蛋白表达,其中NF-κB p65 活化后的核移位效应可促进成熟的IL-1β、TNF-α 蛋白表达变化,并促进其分泌至细胞外,引起炎性反应,其作用效应与TLR4 抑制剂相当。 参苓白术散含药血清组IL-1β、TNF-α 蛋白表达差异与TLR4、NF-κB p65、IκBα 的结果具有一致性。
综上所述,参苓白术散含药血清可能通过细胞炎症信号通路TLR4/NF-κB,抑制炎症因子TNF-α、IL-1β 的释放与表达,阻断慢性炎性反应的持续过程,维持心肌细胞正常功能状态。本研究进一步验证参苓白术散通过抑制炎症机制调控LPS 对心肌细胞的损伤效应,为临床诊疗DCM 的应用提供依据。
