血小板输注无效患者HLA-Ⅰ类抗体产生率及其eplets 的分析*
2023-10-30黄晶晶何红红王仪含左元玲汤龙海
黄晶晶,何红红,王仪含,陆 荣,左元玲,成 婧,蒋 敏,汤龙海*
(1 江苏省苏州市中心血站,苏州 215006;2 苏州大学附属第一医院输血科)
近年来在寻找提高血小板输注效果、降低血小板输注反应发生率的方法方面取得了重要进展,包括输注ABO 同型血小板、去除血小板输注成分中的白细胞等[1],但血小板输注无效(platelet transfusion refractoriness,PTR)依旧是一个重要的临床问题,影响着多达14%的血液病患者[2]。发生PTR 的患者一般预后都较差,包括致死性出血增加、生存率降低等[3]。PTR 包括免疫性PTR 和非免疫性PTR,其中约90%的免疫性PTR 与人类白细胞抗原(human leukocyte antigen,HLA)-Ⅰ类抗体有关[4]。
HLA 抗体对HLA 等位基因间因氨基酸差异而导致结构差异的抗原表位具有特异性。2006 年R.J.DUQUESNOY[5]提出了“eplet”的概念,eplets 的定义类似于功能表位的概念,它是HLA 分子表面能够诱导抗体应答所需的最小的氨基酸构型,所涉及到的氨基酸残基都在3.0~3.5 A°内。Eplets 决定着抗原多态性决定簇的特异性,每个HLA 抗原都被视为一串eplets 的集合。与抗原水平匹配相比,基于eplets 的匹配被认为是改善免疫结局、减少抗体形成的更精确的策略。
为探究PTR 患者体内HLA-Ⅰ类抗体产生的原因,本研究对133 例PTR 的血液病患者体内的HLA-Ⅰ类抗体进行统计,并对检出抗体对应等位基因的eplets 进行比较分析,现报告如下。
1 资料与方法
1.1 病例来源 选取2021 年8 月—2022 年12 月苏州大学附属第一医院收治的133 例出现PTR 的血液病患者,其中急性白血病63 例,骨髓增生异常综合征32 例,再生障碍性贫血49 例。
1.2 试剂与仪器 LUMINEX 200(LUMINEX)及配套试剂LABScreenTMSingle Antigen HLA Class I 试剂盒(One Lambda)。
1.3 HLA-Ⅰ类抗体检测 对133 例PTR 患者进行HLA-Ⅰ类抗体检测,参照试剂说明书操作,在LUMINEX 200 上读取数据,使用配套软件分析解读数据结果。按照微球的平均荧光强度(mean fluorescence intensity,MFI)判定抗体结果,MFI≥10 000 为强阳性,5 000~<10 000 为阳性,500~<5 000 为弱阳性,<500 为阴性。对所有病例的检测结果进行汇总分析。
1.4 检出HLA-Ⅰ类抗体对应等位基因的eplets 分析 对检出的HLA-Ⅰ类抗体所对应等位基因进行高分辨率eplets 分型,统计抗体出现频率,并与该抗体对应基因型在人群中出现频率(数据见http://www.epitopes.net/index.html)进行比较分析。抗体出现频率=该基因型抗体出现次数/抗体出现总例数。
HLA 错配的eplets 数目与患者产生抗体的概率之间存在明确关系[6],但每个eplet 的免疫原性并不相同,并不是每个eplet 表位都具有相同的免疫原性潜能。本研究参考G.HÖNGER 等[7]的研究方法,对eplets 赋予免疫原性评分,每个eplet 评分=eplet 特异性抗体的发生率除以eplet 错配发生率,其中评分>0.2 的eplets 是高免疫原性eplets。
2 结果
2.1 PTR 患者HLA-Ⅰ类抗体强度分析 133 例PTR 患者中,共有86 例(64.66%)血清中检测出HLA-Ⅰ类抗体。其中49 例体内同时存在强阳性、阳性和弱阳性抗体,62 例体内同时存在阳性和弱阳性抗体。
2.2 HLA-Ⅰ类抗体出现频率与抗体对应等位基因在人群中出现频率的比较 由表1 可见,86 例HLA-Ⅰ类抗体阳性患者中,共检测出30 种HLA-A基因型抗体和48 种HLA-B 基因型抗体,其中A*68:02、A*23:01、A*25:01、A*24:03、A*32:01、A*34:02、A*68:01 等和B*57:01、B*15:12、B*49:01、B*08:01、B*15:16、B*56:01 等基因型在人群中出现频率<1%,但抗体出现率>20%;相对的,A*11:01 在人群中出现频率为20.03%,但只有16.90%的患者体内检测到了此种基因型抗体,这表明不同基因型的HLA 分子免疫原性不同,诱导抗体产生的能力也有所差别。
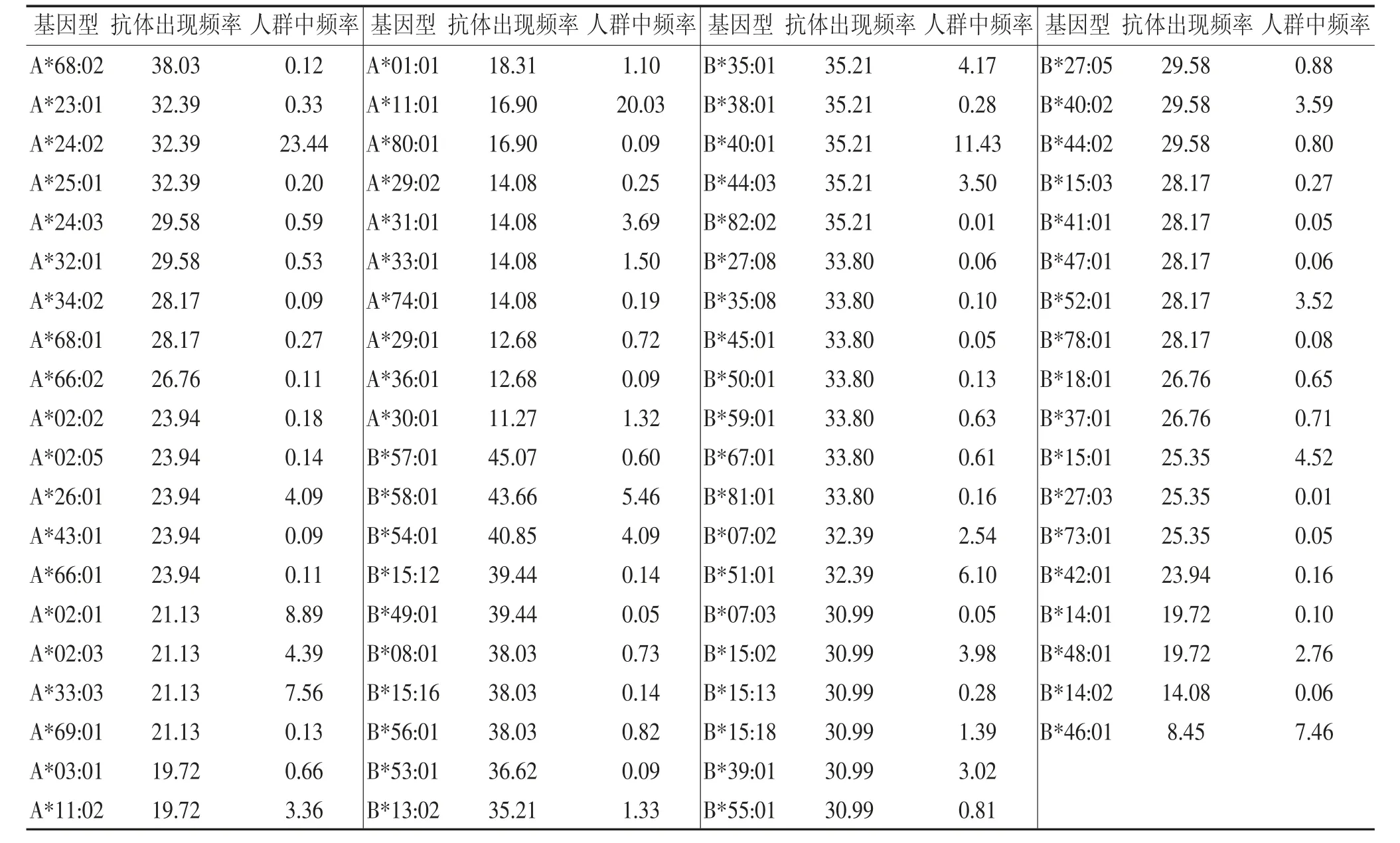
表1 不同基因型抗体出现频率与该基因型在人群中出现的频率%
2.3 HLA 分子eplets 免疫原性分析 选取在人群中出现频率<1%,抗体产生率>20%的HLA-A 分子和人群中出现频率<1%但抗体产生率>30%的HLAB 分子(共32 个)和低免疫原性HLA 分子(即A*11:01)上的eplets(https://www.epregistry.com.br/)进行比较,由表2 可见,这些高免疫原性HLA 分子大多包含一个或多个高免疫原性评分的eplets,即41T、45KE、62LQ、62GE、80I、82LR、107W、127K、131S、144TKH、145KHA(红色标出);而A*11:01 上的eplets免疫原性评分都较低,免疫原性最高的表位为90D,评分为0.125。然而也有部分高免疫原性的HLA 分子(A*34:02、A*66:01、A*66:02、B*07:03、B*08:01、B*81:01)中并没有高免疫原性评分的eplets 表位。
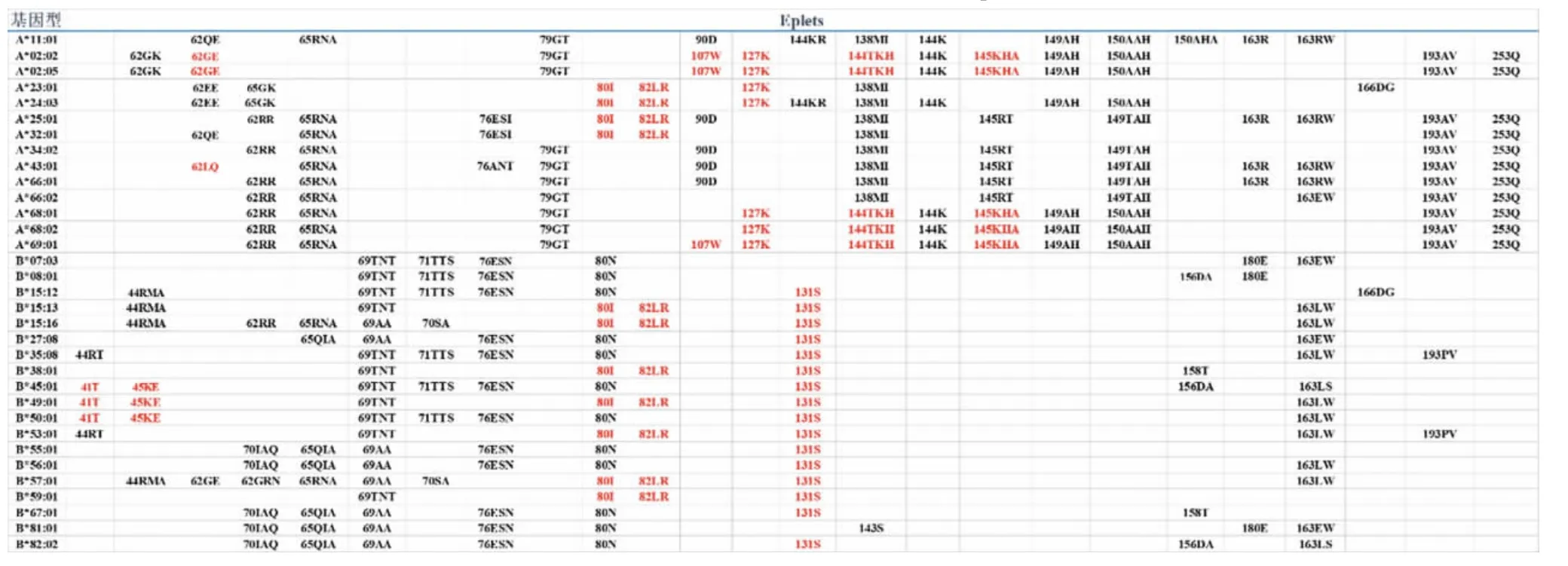
表2 高免疫原性与低免疫原性HLA 分子间的eplets 比较分析
3 讨论
Eplets 的负荷(即供者-受者中不匹配的eplets总和)与抗体形成的程度相关,然而基于eplets 负荷的免疫风险评估作用有限,因为不同的eplets 间的免疫原性差别较大,并非每一个eplet 错配都能诱导抗体的产生。Eplets 错配数量的增加与抗体之间的关联可能仅反映错配的eplets 越多,患者越有可能暴露于高免疫原性的eplets 的事实[8]。本研究也证实了这一点,多数高频率抗体所对应的基因型分子上有一个或多个高免疫原性eplets。一是因为G.HÖNGER等[7]提出一些表位出现的频率较低,在受者人群的自身HLA 库中通常较少出现,虽然免疫原性评分较低,但有相当大的潜在的免疫原性;二是因为本研究的样本量较少,不具备全面性,可能会造成部分HLA 分子的免疫原性评价虚高的情况,还需扩大样本量进行研究。
G.HÖNGER 等[7]的研究发现无免疫原性的eplets(62RR、76ESN、80TLR、156D、163RW)都定位于在α1或α2 结构域的α-螺旋内,与递呈的肽位置相当接近,这可能会降低B 细胞受体互补决定区的可及性;而那些免疫原性较高的eplets 多位于α2 结构域的侧前方,正好在β2-m 的对面,这也强调了在体液免疫应答开始期间,B 细胞受体能不受阻碍地接近大型抗原区域的重要性。
除了错配eplets 的空间位置,它的理化性质也影响着自身的免疫原性。抗体与靶抗原结合的特异性和稳定性受到两个分子之间静电和疏水相互作用的强烈影响,不匹配eplets 之间的理化差异(疏水性和静电电荷)强烈影响HLA-Ⅰ类抗原的免疫原性。V.KOSMOLIAPTSIS 等[9]通过疏水性错配评分对错配eplets 的疏水性进行评分。高疏水性或静电电荷错配评分的HLA-A 和HLA-B 错配特异性更具有免疫原性,可能引发同种抗体应答,因此最好避免。
C.S.M.KRAMER 等[10]指出某一HLA 等位基因错配诱发抗体的概率取决于其最具免疫原性的eplet 在人群中的出现频率。如果这一频率较高,则供者和受者更有可能共享该表位,从而导致具有该抗体特异性的患者数量较少。如果人群中该高免疫原性eplet 的出现频率较低,则在HLA 等位基因不匹配的情况下,针对该HLA 等位基因产生抗体的发生率则较高。然而目前还没有针对中国人群各个表位出现频率的大样本量数据,无法以此为依据筛选可接受错配。
总之,这提示未来在配型时不仅要关注错配的eplets 数量,更要关注错配eplet 的免疫原性,不同的eplets 具有不同的免疫原性,需预防高免疫原性的错配以避免HLA-Ⅰ类抗体的产生,配型时应根据每个eplet 的危险性质对其进行加权,从而改善基于表位的HLA 匹配。
