隆突性皮肤纤维肉瘤55 例临床病理分析*
2023-10-30顾婷婷姚丽倩王雨潇高小姣
顾婷婷,姚丽倩,王雨潇,徐 松,高小姣*
(1 江苏大学附属昆山医院,江苏省昆山市第一人民医院病理科,昆山 215300;2 江苏省昆山市中医院病理科)
隆突性皮纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)是软组织中间性肿瘤的代表性肿瘤之一。DFSP 是一种发生于皮肤的结节状或多结节状肿瘤,由形态一致的短梭形细胞组成,呈席纹状排列,可浸润皮下脂肪及肌组织。肿瘤切除不净,易局部复发,但极少发生转移[1]。本研究对55 例DFSP 患者进行病理学特征、免疫组织化学表型、FISH 检测,并结合临床病理特征、诊断及预后进行综合分析,以期提高对DFSP 的认识水平。
1 资料与方法
1.1 一般资料 选取昆山市第一人民医院和昆山市中医院病理科自2007 年1 月—2021 年1 月期间诊断的DFSP 患者共55 例。其中男30 例,女25 例;发病年龄8~71 岁,平均(39.0±14.2)岁,其中<20 岁3例,20~60 岁45 例,>60 岁7 例;病程数月至10 余年不等;发病部位:背部11 例,腹部10 例,胸部7 例,肩部5 例,头颈部3 例,大腿4 例,小腿3 例,腹股沟3 例,肘部3 例,腰部2 例,乳房2 例,腋下1 例,上臂1 例;临床多表现为自皮肤向表面隆起的暗紫红色斑块或结节,局部可见瘢痕样或萎缩性斑块,近期自觉肿块增大,质地较硬,少数患者皮肤表面局部破溃结痂;CT 多显示为结节性肿块,与周围组织境界相对清楚。
1.2 检测方法 组织切片:所有标本经规范固定、取材,常规脱水及石蜡包埋,切片厚4 μm,HE 染色,显微镜下病理观察。所用抗体均购自福州迈新生物技术开发有限公司。FISH 法检测血小板衍生的生长因子B 链(platelet-derived growth factor subunit B,PDGFB)基因重排:试剂盒购自美国雅培分子公司,DNA 探针为美国雅培公司的PDGFB 双色分离探针(10 μL),荧光显微镜为日本Olympus 公司的BX61 型。免疫组织化学染色:Vimentin、Desmin、SMA、S-100、CD34、BCL-2、β-Catenin 及Ki67 均采用美国Ventana 公司的BenchMark XT 全自动免疫组织化学染色机染色。免疫组织化学染色和FISH 检测操作步骤及参数设置按照操作手册及试剂说明书进行。本研究病例符合人体试验委员会所制定的伦理学标准并得到昆山市第一人民医院伦理委员会批准(2021-06-040-K01)。
1.3 结果判定 Vimentin、Desmin、SMA、S-100、CD34、BCL-2、及β-Catenin 蛋白均以细胞质和细胞膜出现棕黄色颗粒为阳性,Ki67 阳性反应为细胞核呈棕褐色颗粒状。切片背景干净,以出现棕黄色颗粒为阳性,采用半定量积分法[2]判定结果:阳性细胞数,0分:≤5%,1 分:>5%~25%,2 分:>25%~50%,3 分:>50%~75%,4 分:>75%;着色强度,0 分:无着色,1分:浅黄色,2 分:黄色,3 分:棕黄色。阳性细胞数得分和着色强度得分两者相乘,0 分为阴性(-),1~4 分为弱阳性(+),5~8 分为阳性(++),9~12 分为强阳性(+++)。PDGFB 基因重排结果判断标准:在荧光显微镜下观察并计数200 个完整细胞,红绿信号分离细胞数量>20%为阳性。
2 结果
2.1 病理巨检 55 例肿块均位于皮下,多呈圆形不规则结节状,14 例表现为多结节生长,其余41 例均为单结节,肿瘤直径0.8~11.0 cm,平均(3.31±1.04) cm。肿块无包膜,多基底光滑,与周围组织境界相对较清,呈褐色、粉红色、灰白色,实性,部分病例肿块切面可呈鱼肉样,胶冻状。
2.2 镜下观察 55 例DFSP 显微镜下形态相似,肿块多位于真皮层,周围皮肤附属器保留完好(图1A),表面的表皮无明显变化或萎缩,浅部与表皮之间可有一未受累的无细胞带(图1B)。肿瘤组织在真皮和皮下呈浸润性生长,可浸润脂肪组织(图1C),沿脂肪小叶间隔浸润性生长,也可侵犯周围肌肉组织(图1D)。也有部分肿块完全位于皮下,生长于皮下脂肪中。肿瘤细胞大多为梭形、短梭形,可呈轮辐状、漩涡状或花边样排列,核分裂象少见。肿瘤组织或其周边可伴有不等的淋巴细胞、浆细胞浸润。本组55 例DFSP 均可见典型的致密席纹状结构区域(图1E),其中伴有纤维肉瘤变4 例(图1F),表现为细胞密度增高,异型性明显,排列呈鱼骨样或人字状,细胞核染色深,核分裂象增加,>5 个/10 个高倍镜视野;伴有多量的黏液样间质3 例(图1G);可见较多的胶原纤维及薄壁血管3 例;伴有散在分布的树突状色素细胞2 例(图1H)。
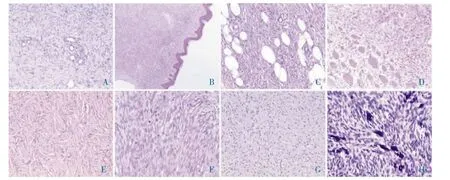
图1 DFSP 显微镜下组织学形态(HE,200×)
2.3 免疫组织化学染色 55 例DFSP 中,Vimentin定位于胞质和胞膜,均呈弥漫强阳性(图2A)。CD34定位于胞质和胞膜,有49 例呈弥漫强阳性,其中4例纤维肉瘤变及2 例黏液样变区域,CD34 表达明显减弱,局部无阳性表达(图2B)。BCL-2 定位于胞质,12 例呈阳性(图2C)。β-Catenin 定位于胞质,11 例呈阳性表达(图2D)。SMA(图2E)6 例呈局灶阳性。S100 5 例呈局灶阳性,主要在纤细的一致的梭形细胞区域,排列成致密的席纹状结构,余均呈阴性表达(图2F)。Desmin 均呈阴性表达(图2G)。Ki67 定位于细胞核,阳性指数1%~9%,平均3%(图2H)。

图2 DFSP 肿瘤细胞免疫组织化学染色(EnVision 法,免疫组织化学染色,200×)
2.4 分子检测 4 例DFSP 标本行FISH 法检测PDGFB 基因重排,均出现红绿信号分离(图3)。

图3 采用PDGFB 双色分离探针FISH 法检测,显示红绿信号分离(FISH,1 000×)
3 讨论
DFSP 是一种表浅的低度恶性潜能的间叶源性肿瘤[3],较少见,总体发病率为0.8/100 万~5/100 万,约占软组织肉瘤的6%[4]。R.W.TAGLOR 于1890 年首次报道此病,J.DAFTER 等于1924 年将其描述为进展的复发性的皮肤纤维瘤,E.HAFFMAMN 于1925年将此病命名为DFSP[5]。DFSP 的发病原因目前尚不清楚,有报道[6]指出,约20%的患者发病部位曾有手术瘢痕、免疫接种、放疗等局部外伤史。也有报道[7]指出,DFSP 出现17 和22 号同源染色体的特异性易位,促使PDGFB 的产生,刺激了肿瘤生长。DFSP 的细胞起源于纤维母细胞、组织细胞或神经外胚层,至今仍有争议,但多数学者[8]认为DFSP 是一种独立而罕见的皮肤纤维组织细胞源性肿瘤。其临床特点是肿块位于真皮,生长缓慢,形成暗紫红色结节,可见瘢痕样或萎缩性斑块。最常见于胸腹部及背部,其次是头颈部和四肢近端[9],偶可发生于乳房、腹股沟、外阴[10]等部位。患者的发病年龄在30~50 岁[11],男性稍多见[12]。本研究案例与上述研究报道情况基本吻合。
DFSP 按镜下形态可分为经典型、色素型、纤维肉瘤型(DFSP-FS)、黏液型、颗粒细胞型、萎缩型或斑块型、硬化型、栅栏状和含有较多Verocay 小体的DFSP、伴有大量脑膜上皮漩涡状结构的DFSP 等组织学亚型[1]。主要的亚型有:(1)经典型,表现为真皮层的梭形瘤细胞增生,与表皮可存在无细胞带,并浸润皮下脂肪组织成蜂窝状表现。肿瘤细胞呈梭形、短梭形,排列成席纹状或轮辐状结构,常紧密围绕汗管等残留的皮肤附件组织,核分裂象可见。(2)色素型,也称Bednar 瘤。肿瘤组织中出现数量不等的树突状细胞,胞质含有大量黑色素颗粒沉积。(3)纤维肉瘤型(DFSP-FS),肿瘤部分区域细胞丰富,呈束状或鱼骨样结构,不典型性及核分裂象增加,该区域超过肿瘤的5%及即诊断为DFSP-FS[13]。(4)黏液型,经典型DFSP 伴有黏液样变性区域占肿瘤的50%以上[14]。(5)萎缩型,肿瘤细胞呈不规则条束状排列,无明显的席纹状结构,临床上易误诊[15]。其中经典型最为多见;黏液型容易复发;纤维肉瘤型复发和转移率最高,预后最差[16]。诊断DFSP 除了依靠组织学形态及免疫组织化学染色,分子检测也非常重要。研究[17]显示,DFSP 具有17、22 号染色体易位和特征性的环状染色体(环状染色体包含17q22 和22q13区域的低水平扩增序列),导致COL1A1 与PDGFB 基因融合。在COL1A1-PDGFB 融合基因中,COL1A1 控制PDGFB扩增,导致细胞分裂,并产生过量的PDGFB 产物,该产物进一步激活PDGF 受体激酶活性,从而导致肿瘤的发生。应用FISH 和RT-PCR 技术确定肿瘤有COL1A1-PDGFB 融合基因,是诊断DFSP 的有力依据,同时可与其他皮肤梭形细胞肿瘤作出鉴别,大大降低了误诊率。
DFSP 在镜下应与以下几种疾病相鉴别:(1)纤维组织细胞瘤或真皮纤维瘤:本病主要位于真皮内,肿块通常较小,伴有表皮增生,瘤细胞呈梭形增生,但很少延伸到脂肪小叶。同时可见到组织细胞样细胞、含铁血黄素细胞等成分。免疫组织化学染色表达CD68、ⅩⅢa、D2-40 因子,不表达CD34[18-19]。(2)神经纤维瘤:肿瘤细胞排列稀疏,呈波浪状,核弯曲,可见触觉样小体结构。免疫组织化学染色S100 和神经微丝蛋白等阳性,CD34 阴性。(3)混杂性神经鞘瘤/神经束膜瘤:瘤细胞呈纤细的梭形,围绕血管呈漩涡状。免疫组织化学染色S100 阳性,CD34 阴性。EMA 可显示瘤细胞的胞突。(4)纤维肉瘤:肿块多位于深部软组织,肿瘤细胞异型性明显,病理性核分裂易见,排列成特征性的“鱼骨状”或“人字形”,常见出血坏死。免疫组织化学染色Vimentin 阳性,S100、CD34 阴性。CD34、F-ⅩⅢa 与Stromelysin-3(ST3)联合检测可用于鉴别皮肤肉瘤和DFSP[20]。(5)黏液性脂肪肉瘤:肿瘤位于深部软组织,瘤细胞无席纹状或车辐状结构,间质有丰富的丛状毛细血管网,存在脂母细胞,脂肪染色阳性。免疫组织化学染色CD34 阴性。(6)恶性纤维组织细胞瘤:肿瘤多发生于老年患者,肿块生长迅速,肿瘤细胞具有较高级别的非典型性、多形性,病理性核分裂象多见,可见黄色瘤细胞、杜顿巨细胞及炎症细胞,常见出血坏死。免疫组织化学染色CD34阴性。此外,临床上还应与萎缩性皮肤病、硬斑病、血管瘤、基底细胞癌等皮肤疾病相鉴别。
研究[21-22]显示,DFSP 切除后局部复发率高达26%~60%,罕见转移,但也有发生肺转移的报道。目前公认的DFSP 治疗是局部广泛切除手术[9]。外科Mohs手术具有创面小、治愈率高的优势。对于无法选择外科手术、复发或转移的患者,可考虑内科治疗。分子检测存在COL1A1-PDGFB 基因融合,可使用DFSP 靶向治疗药-甲磺酸伊马替尼[23-24]。伊马替尼与ATP 竞争,阻止酪氨酸激酶受体磷酸化,进一步抑制异常信号转导通路,从而达到抑制肿瘤细胞生长的作用[25]。所有经病理确诊为DFSP 的患者,应常规行皮损MRI,了解肿瘤的浸润深度,以确定手术范围,做到早诊断、早治疗,防止疾病的复发和转移。对于一些容易复发的病例,如肿瘤固定于深部组织、呈浸润性生长、含有黏液样或纤维肉瘤成分、局部晚期或复发病变,应行胸部CT 扫描以排除肺转移可能[26]。本组55 例DFSP 患者中,14 例行局部扩大切除术,41 例局部切除术。随访30 例患者中,5 例术后局部复发1 次,1例术后复发2 次。其中行扩大切除术的14 例患者随访期内均未发生肿瘤的复发和转移。
