东亚飞蝗WntA在胚胎发育阶段的时空表达
2023-10-30马钰洁IliyaKabak
宋 佳, 马钰洁, 蒲 雪, 季 荣,Iliya Kabak, 袁 亮,*
(1. 新疆师范大学生命科学学院, 中亚区域跨境有害生物联合控制国际联合研究中心, 乌鲁木齐 830054;2. 新疆师范大学生命科学学院, 新疆特殊环境物种保护与调控生物学实验室, 乌鲁木齐 830054;3. 新疆师范大学生命科学学院, 新疆特殊环境物种多样性应用与调控重点实验室, 乌鲁木齐 830054;4. 俄罗斯联邦植物保护研究所, 俄罗斯圣彼得堡 196608)
Wnt由两个同源基因名简并而来,即果蝇DrosophilaWingless基因(Sharma and Chopra, 1976)和小鼠乳腺肿瘤病毒(murine mammary tumor virus, MMTV)插入基因Int-1(Nusse and Varmus, 1982)。Wnt编码的分泌型糖基化蛋白参与调控胚胎发育、器官形成、细胞分化、细胞粘附、细胞运动和细胞增殖等重要生命过程(Nakashimaetal., 2015; Yeetal., 2015)。作为胞外信号配体,目前已知Wnt信号传导有3条通路:(1)经典Wnt/β-catenin通路,参与后生动物胚胎体轴轴向的建立与分化(van Amerongen and Nusse, 2009; Rao and Kühl, 2010);(2)Wnt/JNK通路,与果蝇PCP(planar cell polarity, PCP)通路类似,引起细胞骨架重排和转录水平变化(Semenovetal., 2007; Simons and Mlodzik, 2008);(3)Wnt/Ga2+通路,通过释放细胞内Ca2+影响细胞黏连和基因表达(Kühletal., 2000; Kühl, 2002)。
Wnt信号调控的复杂性不仅表现在作用机制多样,还体现在Wnt基因家族成员众多(Muratetal., 2010)。Wnt在后生动物中经历了异质性丢失和复制,形成拥有13个亚家族的庞大Wnt基因家族(Kusserowetal., 2005)。蜕皮动物发生了较大规模Wnt基因丢失现象,如黑腹果蝇D.melanogaster和秀丽隐杆线虫Caenorhabditiselegans分别仅有7个和5个Wnt基因成员(van Amerongen and Nusse, 2009)。此外,在昆虫基因组中广泛丢失Wnt2,Wnt3,Wnt4和Wnt16(膜翅目除外)(Muratetal., 2010)。开展WntA表达谱及功能研究,将有助于揭示Wnt基因家族成员在各动物类群中保留及丢失的进化机制和功能演化。然而有关直翅目(Orthoptera)昆虫基因组中Wnt基因家族成员的存在格局至今未见报道,该类群基因组中保留(或丢失)了多少Wnt基因仍然未知。
本研究克隆了东亚飞蝗LocustamigratoriamanilensisLmmWntA,并通过整胚原位杂交技术对LmmWntA在东亚飞蝗早期胚胎发育阶段的时空表达进行了分析,结果表明LmmWntA具有十分跳跃的时空表达谱,推测该基因参与东亚飞蝗胚胎后端体节生长、神经系统(脑和腹神经)、复眼、触角、消化系统后端(肛道)、颚、胸部附肢(足和翅)等重要组织和器官的发生和形成。本研究结果为进一步探讨LmmWntA基因功能及研究东亚飞蝗其他Wnt基因家族成员奠定了基础。此外,本研究将整胚原位杂交技术成功应用于东亚飞蝗胚胎研究,亦丰富了该物种发育生物学研究的方法和手段。
1 材料与方法
1.1 动物饲养及胚胎预处理
实验动物及胚胎来自新疆师范大学中亚跨境有害生物联合控制国际研究中心建立的东亚飞蝗室内种群。东亚飞蝗成虫饲养在室温30 ℃、相对湿度50%、光周期14L∶10D的不锈钢虫笼里,每天饲喂两次新鲜麦苗。待雌雄成虫交尾并产出卵夹,取卵夹埋入含水量20%(w/w)的蛭石中,放入恒温27 ℃、相对湿度50%的培养箱孵化。参考钦俊德等(1954)和何正波等(2011)划分的东亚飞蝗胚胎发育阶段,按产卵后(after egg laying, AEL)时间来描述。分别取产卵后发育至12, 24, 35, 46, 56和65 h以及3, 3.5, 4, 4.5, 5, 5.5, 6.5, 8, 8.5, 9.5和11 d共17个胚胎发育阶段的蝗卵各20枚,用10%次氯酸钠消化卵壳5 min,剔除卵内脂肪,用4% PFA-MOPS溶液固定胚胎24 h,转移至70%乙醇溶液-20 ℃保存,用于整胚原位杂交实验。
1.2 东亚飞蝗LmmWntA的克隆
取1.1节各发育阶段胚胎提取RNA,按PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa,北京)操作反转录合成cDNA作为模板。参考本实验室东亚飞蝗转录组注释为WntA同源基因的转录本序列设计上下游引物(Lmm-WntA-F1: 5′-ATGGCGCGCGCCTGCACACGCACCC-3′; Lmm-WntA-R1:5′-TCAGTTGCAGATGTGCTCCTCCTTC-3′)。PCR反应体系(50 μL): 5×PrimeSTAR Buffer (Mg2+Plus) 10 μL, dNTP Mixture(各2.5 mmol/L) 4 μL, PrimeSTAR HS DNA Polymerase(2.5 U/μL) 0.5 μL, 上下游引物(10 μmol/L)各2 μL, cDNA模板2 μL, ddH2O 29.5 μL。扩增反应在ProFlex PCR System(Thermo Fisher Scientific公司,美国)上完成,反应程序: 95 ℃预变性5 min; 95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸1 min, 35个循环;72 ℃延伸5 min。结束后4 ℃保存。PCR产物经生工生物工程(上海)股份有限公司完成测序。
1.3 生物信息学分析
利用MEGA 6软件ClustalW程序对东亚飞蝗LmmWntA编码蛋白与其他物种Wnt蛋白进行多重序列比对,采用邻接法(neighbor-joining, NJ)构建系统进化树及进行聚类分析,自举值设为1 000(Tamuraetal., 2013),所得NJ系统进化树由在线软件EvolView(https:∥www.evolgenius.info/evolview/#login)优化处理(Subramanianetal., 2019)。利用在线软件Clustal Omega(https:∥www.ebi.ac.uk/Tools/msa/clustalo/)分析目的蛋白与所属Wnt亚家族蛋白之间的同源性及保守序列(Madeiraetal., 2019),结果用Jalview软件(版本2.11)优化处理。
1.4 体外合成反义探针
将1.2节克隆的东亚飞蝗LmmWntA重组至pGEM-T Easy质粒(Promega,美国)构建pGEM-T-LmmWntA重组质粒,以EagⅠ限制性内切酶(全式金公司,北京)消化后的线性化pGEM-T-LmmWntA重组质粒为模板,利用载体T7启动子,体外转录合成含DIG-dUTP的反义RNA探针。体外转录体系(Life Technologies,美国)(20 μL): 10×Reaction Buffer 2 μL, Enzyme Mix 2 μL, 线性化质粒DNA 1 μg, DIG RNA Labelin 2 μL(Roche公司,瑞士), Nuclease-free Water补齐至20 μL。将装有上述反应液的PCR管放入PCR仪,37 ℃下孵育2 h,产物用琼脂糖凝胶电泳检测。
1.5 整胚原位杂交
为明确LmmWntA是否正常转录,我们通过整胚原位杂交技术对LmmWntA在东亚飞蝗胚胎发育阶段的转录信号进行调查。参照黑腹果蝇(Nagasoetal., 2001)和沙漠蝗Schistocercaamericana(Dearden and Akam, 2001)整胚原位杂交方法。第1天,东亚飞蝗胚胎通透及探针杂交,将带有地高辛(DIG)标记的探针与东亚飞蝗LmmWntAmRNA结合;第2天,洗涤和抗体孵育,孵育偶联碱性磷酸酶的抗体与地高辛结合;第3天,洗涤和染色,加入碱性磷酸酶的底物显色,通过杂交信号定位LmmWntA的表达。
2 结果
2.1 东亚飞蝗LmmWntA序列特征及系统发育
克隆获得东亚飞蝗LmmWntA(GenBank登录号: MW052768),CDS全长1 101 bp,编码366个氨基酸。系统进化树显示,LmmWntA与西方蜜蜂ApismelliferaAmWntA氨基酸序列一致性最高(59.05%),聚为姊妹群,同时与头索动物、昆虫、有爪动物及环节动物WntA蛋白共同聚为WntA亚家族单系群,并得到较高自展值支持(图1)。多重序列比对分析表明, LmmWntA氨基酸序列含有4个较为保守的糖基化位点, 其序列的中段和C端与系统进化树其他WntA的氨基酸序列保持了较高同源性,仅在N端信号肽区域出现较大差异,但东亚飞蝗与冈比亚按蚊Anophelesgambiae的WntA在N端信号肽区域内具有一段保守的7个连续亮氨酸的特异序列(图2)。结果支持本研究克隆获得目的基因为东亚飞蝗LmmWntA基因。
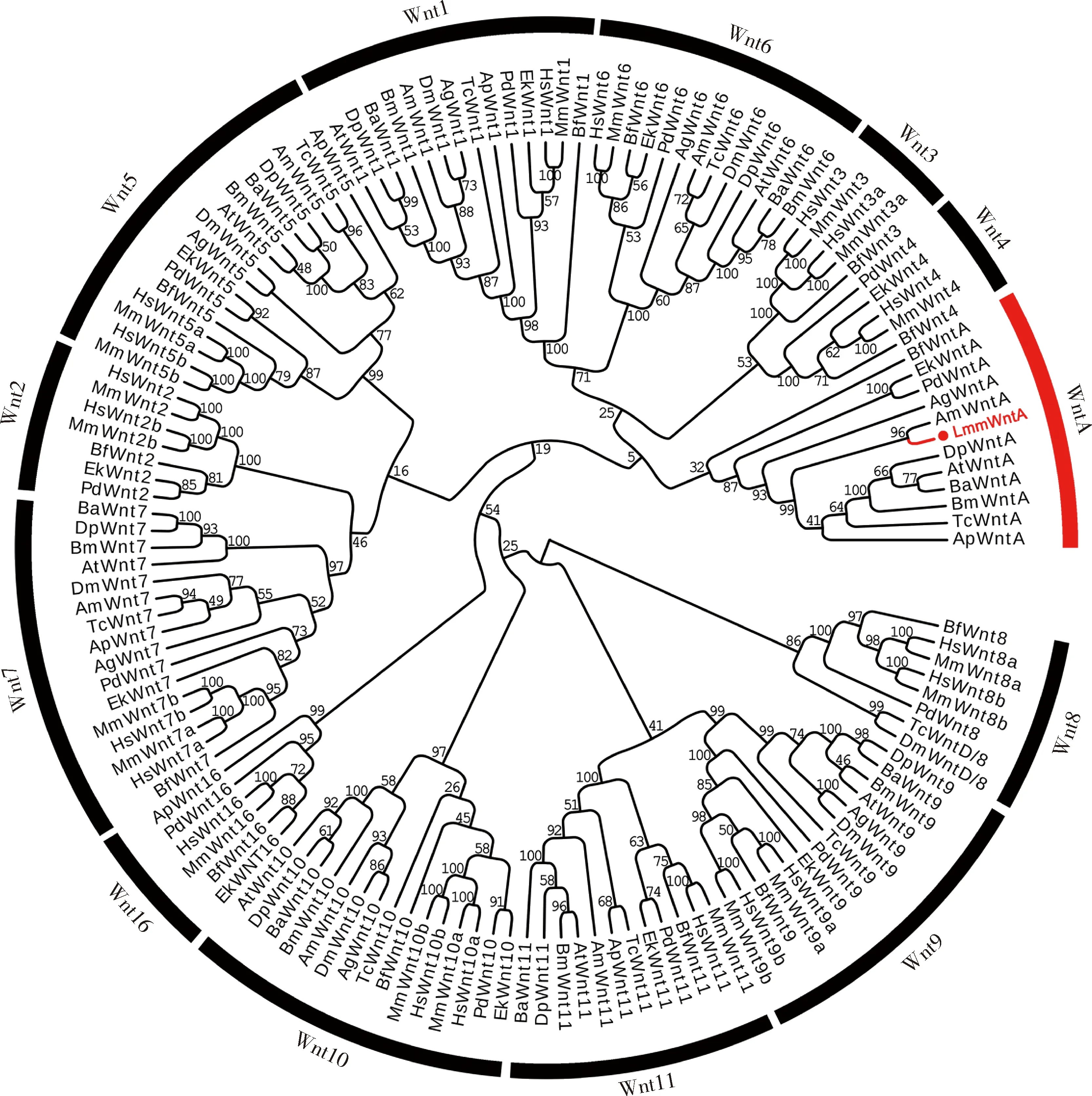
图1 邻接法构建的基于氨基酸序列的Wnt基因家族系统进化树(1 000次重复)Fig. 1 Phylogenetic tree of Wnt gene family constructed by neighbour-joining method based on amino acid sequence (1 000 replicates)蛋白来源物种和GenBank登录号Protein origin species and GenBank accession numbers: LmmWntA: 东亚飞蝗Locusta migratoria manilensis, MW052768; HsWnt1, HsWnt2a, HsWnt2b, HsWnt3, HsWnt3a, HsWnt4, HsWnt5a, HsWnt5b, HsWnt6, HsWnt7a, HsWnt7b, HsWnt8a, HsWnt8b, HsWnt9b, HsWnt9a, HsWnt10a, HsWnt10b, HsWnt11, HsWnt16: 人Homo sapiens, NP_005421, NP_003382.1, NP_004176.2, NP_110380.1, NP_149122.1, NP_110388.2, NP_001243034.1, NP_116031.1, NP_006513.1, NP_004616.2, NP_478679.1, NP_490645.1, NP_003384.2, NP_003386.1, NP_003387.1, NP_079492.2, NP_003385.2, NP_004617.2, NP_057171.2; MmWnt1, MmWnt2a, MmWnt2b, MmWnt3, MmWnt3a, MmWnt4, MmWnt5a, MmWnt6, MmWnt7a, MmWnt7b, MmWnt8a, MmWnt8b, MmWnt9a, MmWnt9b, MmWnt10a, MmWnt10b, MmWnt11, MmWnt16: 小鼠Mus musculus, NP_067254.1, NP_076142.3, NP_033546.2, NP_033547.1, NP_033548.1, NP_033549.1, NP_033550.2, NP_033552.2, NP_033553.2, NP_033554.3, NP_033316.1, NP_035850.2, NP_647459.1, NP_035849.3, NP_033544.1, NP_035848.1, NP_033545.1, NP_444346.3; BfWnt1, BfWnt2-11, BfWnt16, BfWnt: 文昌鱼Branchiostom floridae, AAC80432.1, XP_002601759.1, AAL37555.1, AAC80431.1, AAL37556.1, XP_002598625.1, XP_002597288.1, AAF80559.1, XP_002598627, XP_002598506, AAF80555.1, XP_002599799, AXP_002609873.1; DmWnt1, DmWnt5, DmWnt6, DmWnt7, DmWntD, DmWnt9, DmWnt10: 黑腹果蝇Drosophila melanogaster, NP_523502, NP_476924, NP_609108, NP_476810, NP_650272, NP_476972, NP_609109; AgWnt1, AgWnt5, AgWnt6, AgWnt7, AgWnt9, AgWnt10, AgWntA: 冈比亚按蚊Anopheles gambiae, XP_553580.3, XP_319487.4, XP_318816.4, XP_001238162.2, XP_318818.4, XP_318815.4, XP_557821.3; ApWnt1, ApWnt5, ApWnt7, ApWnt11, ApWnt16, ApWntA: 豌豆蚜Acyrthosiphon pisum, XP_001945295.1, XP_001949667.2, XP_001948541.2, XP_001944637.3, XP_016664156.1, XP_001947400.1; AmWnt1, AmWNnt5, AmWnt6, AmWnt7, AmWnt10, AmWnt11, AmWntA: 西方蜜蜂Apis mellifera, XP_026300091.1, XP_397473.4, XP_396945.4, XP_006557287.1, XP_396944.4, XP_016912252.1, XP_624751.3; AtWnt1, AtWnt5, AtWnt6, AtWnt7, AtWnt9, AtWnt10, AtWnt11, AtWntA: 脐橙螟Amyelois transitella, XP_013200502.1, XP_013195114.1, XP_013200466.1, XP_013186344.1, XP_013200476.1, XP_013200389.1, XP_013193026.1, XP_013186724.1; BaWnt1, BaWnt5, BaWnt6, BaWnt7, BaWnt9, BaWnt10, BaWNTt11, BaWntA: 偏瞳蔽眼蝶Bicyclus anynana, XP_023955185.1, XP_023937318.1, XP_023955186.1, XP_023935071.1, XP_023953537.1, XP_023955187.1, XP_023934504.1, XP_023937297.1; DpWnt1, DpWnt5, DpWnt6, DpWnt7, DpWnt9, DpWnt10, DpWnt11, DpWntA: 黑脉金斑蝶Danaus plexippus, OWR46374.1, OWR48186.1, OWR46372.1, OWR51990.1, OWR46375.1, OWR50975.1, OWR42165.1, OWR46938.1; BmWnt1, BmWnt5, BmWnt6, BmWnt7, BmWnt9, BmWnt10, BmWnt11, BmWntA: 家蚕Bombyx mori, NP_001037315.1, XP_021209298.1, XP_012548361.1, XP_021208534.1, XXP_012548374.1, XP_021205615.1, XP_004924665.2, XP_021209300.1; TcWnt1, TcWnt5, TcWnt6, TcWnt7, TcWntD, TcWnt9, TcWnt10, TcWnt11, TcWntA: 赤拟谷盗Tribolium castaneum, NP_001107822.1, XP_974684.1, NP_001164137.1, XP_008196351.1, XP_971439.1, XP_015835609.1, XP_015835532.1, XP_015835988.1, KYB26594.1; PdWnt1, PdWnt2, PdWnt4, PdWnt5, PdWnt6, PdWnt7, PdWnt8, PdWnt9, PdWnt10, PdWnt11, PdWnt16, PdWntA: 杜氏阔沙蚕Platynereis dumerilii, CAD37164, CAD37165.2, CAD37166.2, ADK38673.2, ADR81922.1, ADR81923.2, ADG26737.1, CAD37167.2, CAD37168.2, ADK38674.2, ADR81924.2, CAD37169.2; EkWnt1, EkWnt2, EkWnt4, EkWnt5, EkWnt6, EkWnt7, EkWnt9, EkWnt10, EkWnt11, EkWnt16, EkWntA: 天鹅绒虫Euperipatoides kanangrensis, ABY60732.1, CDI40099.1, CDI40100.1, CDI40101.1, CDI40102.1, CDI40103.1, CDI40104.1, CDI40105.1, CDI40106.1, CDI40107.1, CDI40108.1.

图2 东亚飞蝗LmmWntA与其他蝗虫WntA氨基酸序列多重比对Fig. 2 Multiple alignment of amino acid sequences of LmmWntA with WntAs from other locusts蛋白来源物种和GenBank登录号Protein origin species and GenBank accession numbers: LmmWntA: 东亚飞蝗Locusta migratoria manilensis, MW052768; BfWntA: 文昌鱼Branchiostom floridae, XP_002609873.1; EkWntA: 天鹅绒虫Euperipatoides kanangrensis, CDI40108.1; PdWntA: 杜氏阔沙蚕Platynereis dumerilii, CAD37169.2; AgWntA: 冈比亚按蚊Anopheles gambiae, XP_557821.3; ApWntA: 豌豆蚜Acyrthosiphon pisum, XP_001947400.1; AmWntA: 西方蜜蜂Apis mellifera, XP_624751.3; TcWntA: 赤拟谷盗Tribolium castaneum, KYB26594.1; BmWntA: 家蚕Bombyx mori, XP_021209300.1; AtWntA: 脐橙螟Amyelois transitella, XP_013186724.1; BaWntA: 偏瞳蔽眼蝶Bicyclus anynana, XP_023937297.1; DpWntA: 黑脉金斑蝶Danaus plexippus, OWR46938.1. 深蓝色代表氨基酸序列完全一致,淡蓝色代表氨基酸序列一致性为75%~99%;红色框为推测的糖基化位点;绿色框为7个连续亮氨酸的特殊序列。Dark blue indicates complete identity of amino acid sequences and pool lilac indicates 75%-99% amino acid sequence identity. The red boxes represent putative glycosylation sites. The green boxes are a special sequence composed of seven consecutive leucines.
2.2 LmmWntA在东亚飞蝗早期胚胎发育中的时空表达
至12 h AEL胚胎期活质体(energid)和24 h AEL胚胎期囊胚(blastula)均未检测到LmmWntA杂交信号(图3)。

图3 整胚原位杂交检测LmmWntA在东亚飞蝗产卵后(AEL)至12(A)和24 h(B)胚胎中的表达量Fig. 3 Expression levels of LmmWntA in the embryos at 12 (A) and 24 h (B) after egg laying (AEL) of Locusta migratoria manilensis by whole-mount in situ hybridization标尺Scale bar=500 μm.
至35 h AEL胚胎期,首先在胚胎末端生长区检测到LmmWntA杂交信号(图4: A)。至46 h AEL胚胎期,在生长区的杂交信号仍然存在,同时在胚胎头部两侧视叶区和上颚节新增微弱杂交信号(图4: B),其中视叶未来发育成复眼,上颚节未来发育成口器的大颚。至56 h AEL时,头节和胸节已全部形成,在头、胸部每节呈横带状杂交信号表达,表明LmmWntA在头、胸部每节呈横带状表达,同时头部两侧视叶区杂交信号较前阶段加强,生长区杂交信号依然保留,此外在大脑处新增微弱杂交信号(图4: C)。至65 h AEL时,LmmWntA在视叶区和脑部的杂交信号表达更强烈,表明LmmWntA在视叶区和脑部的表达更强烈,原先在头、胸节呈带状表达,此阶段则沿体轴腹中线两侧呈点状表达,而且类似的表达还扩展到第1和第2腹节(图4: D),此外在生长区的杂交信号依然存在。
至3 d AEL时,LmmWntA在头、胸部每节腹侧中线两侧的点状表达扩展到腹面远轴端表达,第1-3胸节最为明显(图4: E);随着身体后部延伸,LmmWntA在第1-6腹节呈带状表达(图4: E);在两侧视叶区、脑和生长区的杂交信号依旧较强(图4: E)。LmmWntA在3.5 d AEL胚胎中的表达模式基本延续了3 d AEL时的,此时可以区分更多的新生腹节(图4: F)。
至4 d AEL时,东亚飞蝗头胸腹所有体节形成完毕,除上颚节外,LmmWntA在头胸各节的表达弱化,在各腹节仍然呈中线两侧点状表达,在生长区的表达开始转移为消化道末端内陷表达(图4: G)。至4.5 d AEL时,在复眼处的表达信号依然强烈(图4: H),胸腹节各附肢初步形成,LmmWntA点状表达在头胸附肢远轴末端,在腹部表达的信号向腹中线靠近,此时胚胎末端向腹部内陷至第9和10腹节之间形成消化道后端的肛道(proctodeum),LmmWntA在此处也有表达信号(图4: H)。
至5 d AEL时,LmmWntA在脑和复眼的表达依然强烈(图4: I, K),在大颚外缘和胸部足的基部和末端有点状表达,原先在靠近腹节中线两侧点状表达的LmmWntA,此阶段点状信号向中线外侧迁移,所经之处呈弥散表达,形成弥散条带,肛道继续内陷,已抵达第8腹节,LmmWnt在肛道周围的腹面和前端表达(图4: I)。至5.5 d AEL时,LmmWntA呈弥散状表达在腹节的神经索,肛道继续内陷至第7腹节(图4: J)。至6.5 d AEL时,蝗虫胚胎开始胚转,LmmWntA的表达保持前一阶段模式(图4: L)。
至8 d AEL时,LmmWntA在脑的表达消失,在复眼的表达也仅限于后半区,在大颚的表达趋于弱化,在足的基部和关节处表达明显,在腹神经链和肛道的表达信号增强(图4: M)。至8.5 d AEL时,胚胎表层逐渐开始硬化,但仍可在复眼后半区、大颚、足关节处和腹神经链的表达(图4: N, O, P)。至9.5 d AEL时,LmmWntA在之前表达区域均未再检测到表达信号,但在翅基盘处启动新的表达区域,且表达信号强烈(图4: Q)。至11 d AEL时,已检测不出任何杂交信号(图4: R)。
3 讨论
3.1 东亚飞蝗基因组中保留了WntA亚家族支系
尽管WntA基因广泛存在于原口动物基因组,但在个别类群中却发生了丢失,如:所有的扁形动物和双翅目昆虫果蝇,那么该基因在直翅目昆虫基因组中是否存在仍然未知。本研究从东亚飞蝗胚胎转录组中克隆获得一段1 101 bp目标基因,通过对其编码蛋白序列的同源性比对分析表明,该基因编码蛋白与头索动物、双翅目昆虫、半翅目昆虫、膜翅目昆虫、鳞翅目昆虫、鞘翅目昆虫和环节动物中已报道物种的WntA蛋白聚为单系群(图1),暗示本研究所克隆目标基因为WntA的同源基因,隶属于WntA亚家族成员。基于多重序列比对分析表明,该基因编码蛋白的一级结构与上述物种WntA蛋白一级结构特征非常相似,它们的WntA蛋白序列中段和C端保持了较高同源性,仅在N端信号肽区域出现差异,其中东亚飞蝗和冈比亚按蚊还在N端(信号肽端)同时具有一段由连续7个亮氨酸连接的保守疏水结构域(图2),推测与其细胞膜表面受体蛋白特异结合相关。由此可见,本研究克隆获得的目标基因可确定为东亚飞蝗WntA基因,暗示直翅目昆虫基因组和大多数圆口动物一样保留了WntA亚家族分支。
3.2 WntA在不同动物类群中的表达谱差异及功能演化
整胚原位杂交表明(图4),本研究克隆目标基因并非假基因,而是能正常转录且对多个组织或器官发育起重要作用的功能基因。从35 h AEL至10 d AEL,LmmWntA先后在蝗虫胚胎的尾芽、复眼、触角基部、腹部体节、脑、触角基部、腹部中轴线两侧、腹神经、腹部附肢末端(后期转化为足末端及关节)、大颚、肛道和翅芽处表达,并遵循了严格的表达时序,暗示该基因参与上述组织或器官的分化和形成。可基于本研究结果与WntA在已报道物种的表达谱或功能证据进行对比分析,以探讨该基因在不同动物类群间表达模式和发育功能的演化。在昆虫中,与东亚飞蝗同为短胚带昆虫的鞘翅目赤拟谷盗T.castanenumTcWntA最早表达在胚盘期的胚胎末端,然后在下颌节和外侧头叶区表达,随着胚带延伸,初期在每个体节的条纹状表达信号很快就散成一些小的点状表达区分布在腹中线及两侧,稍后阶段在头和附肢区域也发现该基因的特异表达区(Bolognesietal., 2008; Janssenetal., 2010),除了不在翅芽处表达外,TcWntA与LmmWntA的表达模式基本相似。鳞翅目偏瞳蔽眼蝶BicyclusanynanaBaWntA在早期胚胎发育阶段同样表现出动态表达谱:受精后10 h,即可在颌节和胸节(thoracic segment)处呈条纹状表达,及头部耳垂(head lobes)处观察到该基因转录信号;受精后16 h,该基因表达扩展至身体所有体节,并呈横向条纹样表达,且胸部表达条纹宽于腹部表达条纹;受精后20 h,该基因在每节的表达由外侧向内侧缓慢削弱,并逐渐缩向腹中央神经沟(neurogenic furrow)处表达;受精后26 h,BaWntA表达在胸部初生肢芽及沿前后轴的腹中央神经沟(Holzemetal., 2019),BaWntA早期胚胎发育表达谱与LmmWntA在体节、耳垂和腹神经的表达极为相似。此外,WntA缺失导致鹿眼蛱蝶Junoniacoenia、斑点木蝶Parargeaegeria和小红蛱蝶Vanessacardui左右翅对称条纹发生紊乱、诱导小红蛱蝶Vanessacardui前翅眼斑变大、引起艺神袖蝶Heliconiuseratodemophoon和萨拉袖蝶Heliconiussarasara翅中黑色域和浅色域边界迁移等,表明WntA基因对调节蛱蝶翅图案图式起着关键作用(Mazo-Vargasetal., 2017),本研究也观察到LmmWntA在东亚飞蝗9.5 d AEL胚胎期的翅芽处有短暂表达。基于qRT-PCR数据显示,家蚕BombyxmoriBmWntA在5龄幼虫的精巢、马氏管、翅盘和神经组织中具有较高水平表达(Dingetal., 2019),暗示WntA不仅在早期胚胎发育阶段,甚至在胚后发育甚至成虫阶段,对鳞翅目昆虫生殖、排泄、神经和运动系统等均具有持续发育调控作用,该基因是否在直翅目昆虫也具有相似的胚后发育调控功能,尚需对成年蝗虫不同组织进行该基因的转录分析。
有爪动物(Onychophora)天鹅绒虫EkWntA在其早期胚胎发育阶段同样拥有广泛表达谱,表达区域包括头叶、颌、粘液乳头(slime papilla)、体节、尾部生长区、唾液腺和腹部神经系统等(Hogvalletal., 2014)。软体动物杜氏阔沙蚕PdWntA在胚胎阶段表达在疣足原基和胚胎后端生长区,随后表达在发育疣足的末梢,此外在背血管和腹血管之间连接的侧血管壁也有表达(Janssenetal., 2010)。螯肢类动物游荡蜘蛛CupienniussaleiCsWntA同样也观察到在胚胎末端生长区表达,此外在吐丝器(spinnerets)和螯肢(cheliceres)的末端也有表达,但并不表达在新生体节腹侧(Janssenetal., 2010)。倍足类动物球马陆GlomerismarginataGmWntA表达在头部视叶区、腹部体节胚带末端和心脏(Janssenetal., 2004, 2010)。
脊索动物门的脊椎动物整体缺失WntA基因支系,而头索动物和尾索动物基因组中仍保留了WntA基因亚家族。头索动物文昌鱼BranchiostomafloridaeBfWntA在幼体阶段表达在形成口的原基,及腹部肠道内胚层和外胚层之间的间皮细胞(Somorjaietal., 2018)。尽管在玻璃海鞘Cionarobusta成年组织转录组中筛查到WntA转录本,但通过对玻璃海鞘C.robusta和真海鞘Halocynthiaroretzi胚胎的整胚原位杂交分析并未获得任何杂交信号,推测WntA可能只表达在背囊动物的胚后或成年阶段(Somorjaietal., 2018)。
综上,WntA在不同动物早期胚胎发育阶段具有如下表达特征:(1)均表现为较广泛或跳跃的表达谱。无论原口动物,还是后口动物,WntA在早期胚胎发育阶段的表达并未局限于单一细胞及组织类型,而是多种细胞及组织类型,暗示其具有多样的发育调控功能。(2)在原口动物中,WntA在各物种间拥有多个共同保守的表达区域,如在胚胎后部生长区、体节、头部两侧视叶和腹神经等,暗示WntA基因对调控原口动物胚胎发育功能的进化保守。然而,WntA在各物种间也进化出各自的差异表达,如WntA基因在直翅目昆虫和鳞翅目昆虫的翅芽处有表达,但在鞘翅目昆虫中未见此现象。(3)在脊索动物中,WntA在头索动物文昌鱼幼体口原基,及腹部肠道内胚层和外胚层之间的间皮细胞表达,在尾索动物海鞘中未在胚胎或幼体阶段检出该基因表达信号,仅在成体转录组中筛查出该基因转录本,该基因甚至脊椎动物类群中整体丢失,暗示WntA由原口动物进化至后口动物过程中,其功能已发生显著变化。
3.3 东亚飞蝗有望成为短胚带昆虫发育生物学研究的模式生物
东亚飞蝗是直翅目昆虫的代表物种,在特定条件下能聚集迁飞,对农牧业生产造成重大危害。但从进化发育生物学(Evo-Dove)角度看,东亚飞蝗易饲养、生活史周期短、产卵量高、卵大易于胚胎操作,具备清楚的胚胎发育学(钦俊德等, 1954; 何正波等, 2011)和基因组学(Wangetal., 2014)研究背景,与完全变态长胚带模式昆虫果蝇不同,属典型的不完全变态短胚带昆虫,具有发展成短胚带模式昆虫的潜力。整胚原位杂交技术是发育生物学确定功能基因时空表达的重要方法,相对于qRT-PCR,整胚原位杂交能够能更为直观地反映目的基因在胚胎的空间表达,同时可以通过杂交信号的强弱判断表达量的高低。本研究将整胚原位杂交技术成功应用于东亚飞蝗胚胎研究丰富和拓展了东亚飞蝗发育生物学研究方法和手段。
