邻苯二甲酸二(2-乙基己基)酯降解菌群的筛选及特性研究
2023-10-30周冰玉孙翔宇王春平
周冰玉,孙翔宇,周 宇,汪 彬,王春平
(湖南省微生物研究院,湖南 长沙 410009)
邻苯二甲酸酯(Phthalic Acid Esters,PAEs)是一类混合在塑料中以增强其可塑性和多功能性的有机化合物[1],主要是依靠非化学键与塑料母体相连。在塑料制品的使用过程中,随着塑料结构的破坏,大量的邻苯二甲酸酯被释放到环境中,引发环境污染问题[2]。近年来,随着设施农业的发展,在农田土壤,甚至动植物产品中都检测到邻苯二甲酸酯的残留,对人类健康造成潜在威胁[3-6]。邻苯二甲酸酯是一种内分泌干扰物,对人体具有肝肾和生殖系统毒性,并对动物有致畸性、致突变性和致癌性[3]。邻苯二甲酸二(2-乙基己基)酯(DEHP)是近年来检出最多且较难降解的PAEs 污染物,其在自然环境中水解、光解的速率非常慢,微生物降解是其最主要的降解途径[7],由于生物降解技术具有效率高、成本低、易实施等优点,得到科技工作者的广泛关注。目前,已报道的能够降解邻苯二甲酸酯的微生物种类较多,例如不动杆菌、红球菌、假单胞菌、戈登氏菌、芽孢杆菌等[8-12]。有研究表明,从PAEs 污染地区分离的部分复合菌群对污染物的降解效果优于单一菌株[13],而目前有关复合菌群用于PAEs 污染土壤修复的报道较少。
因此,研究以邻苯二甲酸二(2-乙基己基)酯(DEHP)为降解对象,筛选具有高效降解能力的复合微生物菌群,并对菌群的降解特性进行分析,期望为DEHP 污染土壤的高效修复提供更丰富的微生物资源。
1 材料与方法
1.1 试验材料
土壤样品采集于湖南省益阳市赫山区泥江口镇某长期使用塑料薄膜大棚种植蔬菜的农田。DEHP购自国药试剂有限公司,所用有机溶剂为色谱级。
无机盐(MSM)培养基:KH2PO44.5 g/L,K2HPO45.8 g/L,(NH4)SO42.0 g/L,NaCl 0.75 g/L,MgCl20.16 g/L,CaCl20.02 g/L,FeCl30.002 g/L,pH 值7.0。固体培养基按1.8%比例添加琼脂粉。
DEHP 降解培养基:往无机盐培养基中加入一定浓度的DEHP 母液,配制成以DEHP 为唯一碳源的培养基。
1.2 试验方法
1.2.1 DEHP 降解菌群的分离筛选 取土壤样品约5 g 加入到盛有100 mL 含有终浓度为100 mg/L DEHP的MSM 液体培养基中,采用含200、400、600、800、1 000 、1 200 mg/L 的DEHP 浓度梯度驯化,每个周期培养7 d,培养条件:30℃、180 r/min、避光。每次转接1 mL 培养液到下一浓度梯度的培养基中,将最后获得的驯化培养液在相同浓度的DEHP培养基中连续转接4 次,获得稳定培养液,命名为HM6,同时利用甘油冷冻保藏法将菌种在-80℃冰箱保存。
1.2.2 HM6 菌群群落组成分析 使用DNA 提取试剂盒抽提HM6 菌群的总DNA,利用引物338F(5′-ACTC CTACGGAGGCAGCAG-3′)、806R(5′-GGACTACHV GGGTWTCTAAT-3′)扩增16S rRNA 基因的V3—V4 区,建库后利用Illumina 公司的Miseq PE300 平台进行测序,并利用美吉生物有限公司的云平台进行微生物群落组成分析。
1.2.3 HM6 菌群对DEHP 降解能力的测定 将HM6 菌群接种在含600 mg/L DEHP 的MSM 培养基中,30℃、180 r/min 避光培养,24 h 后收集菌液进行低温离心,去上清,加入无菌水重悬菌体(调节OD600约为0.2),作为种子液备用。按2%接种量将上述种子液添加到初始DEHP 浓度为600 mg/L 的MSM 培养基中,培养条件与种子液制备条件相同,每隔1 d 测定培养液中剩余的DEHP 含量,持续检测7 d。DEHP 含量采用高效液相色谱法(HPLC)测定[14],利用外标法定量,以峰面积对应DEHP 浓度绘制标准曲线。培养液中DEHP 萃取收集方法:加入50 mL 正己烷到培养液中,充分振荡静置后,收集有机相,重复2 次;将2 次萃取液合在一起,利用旋转蒸发仪蒸发至近干,加入10 mL 甲醇重新溶解萃取物,并使用0.22 μm 过滤器过滤;参照笔者实验室已报道的色谱条件进行HPLC 分析[15],色谱柱为Agilent Eclipse XDB-18(200 mm×4.6 mm),流动相为95%甲醇溶液,流速为1 mL/min,柱温30℃,紫外检测波长为228 nm,进样量20 μL。
1.2.4 环境条件对HM6 菌群降解DEHP 的影响(1)温度。将1.2.3 中制备的HM6 种子液按2%的接种量转接至MSM 液体培养基中(DEHP 浓度600 mg/L),培养温度分别设置为15、20、25、30、35、40℃,180 r/min 遮光培养4 d 后测定剩余的DEHP含量,以未接菌、相同温度处理作对照,计算降解率。(2)pH 值。分别用HCl 和NaOH 调节MSM 液体培养基的pH 值为5、6、7、8、9,接种量为2%,30℃、180 r/min 遮光培养,4 d 后测定剩余的DEHP含量,以未接菌、相同pH 值处理作对照,计算降解率。(3)DEHP 初始浓度。按2%的接种量将HM6 种子液转接到初始浓度为50、200、400、600、800、1 000、1 500、2 000 mg/L 的DEHP 无机盐培养基中,30℃、180 r/min 遮光培养4 d,测定菌液中剩余的DEHP 含量,以未接菌、相同初始浓度处理作对照,计算降解率。
1.2.5 HM6 菌群在DEHP 污染土壤中的应用 模拟试验所用土壤采集于益阳市赫山区泥江口镇农田(未检出DEHP),土样经风干并过20 目筛后备用,取200 g 土壤,加入DEHP 溶液配制成终浓度为200 mg/kg 的人工DEHP 污染土壤。按2%的接种量将HM6 种子液转接到人工DEHP 污染土壤中,以未接种HM6 的人工DEHP 污染土壤为空白对照,将锥形瓶放入30℃培养箱避光培养,每隔3 d 取样测定剩余DEHP 含量,总周期为21 d。土壤中DEHP 的提取参照杨婧等[14]报道的方法,含量分析同1.2.3 中介绍的方法。
2 结果与分析
2.1 HM6 菌群的群落组成分析
由图1 可知,HM6 菌群在科和属的分类水平上组成非常丰富。在科分类水平上,Nocardiaceae的丰度最高,占比达64.87%,这一结果与Li等[13]报道的DEHP 降解菌群类似,除此之外,Alcaligenaceae(7.91%)、Comamonadaceae(5.34%)、Chitinophagaceae(4.53%)、Rhizobiaceae(3.49%)、Xanthomonadaceae(2.82%)、Burkholderiaceae(2.76%)也是占比较高的科。在属分类水平上,丰度最高的属为Rhodococcus,占比达57.5%,另外unclassified_f_Alcaligencaceae(7.90%)、Gordonia(6.23%)、Hydrogenophaga(3.43%)、Terrimonas(2.95%)、Pandoraea(2.76%)、Pseudoxanthomonas(2.63%)、Ensifer(2.19%)等属的比例也较高。据报道,Rhodococcus、Gordonia属的菌株具有PAEs降解能力。因此,研究获得的HM6 菌群中这2 个属的丰度均较高,间接说明HM6 菌群在DEHP 污染修复方面的潜在应用价值较高。
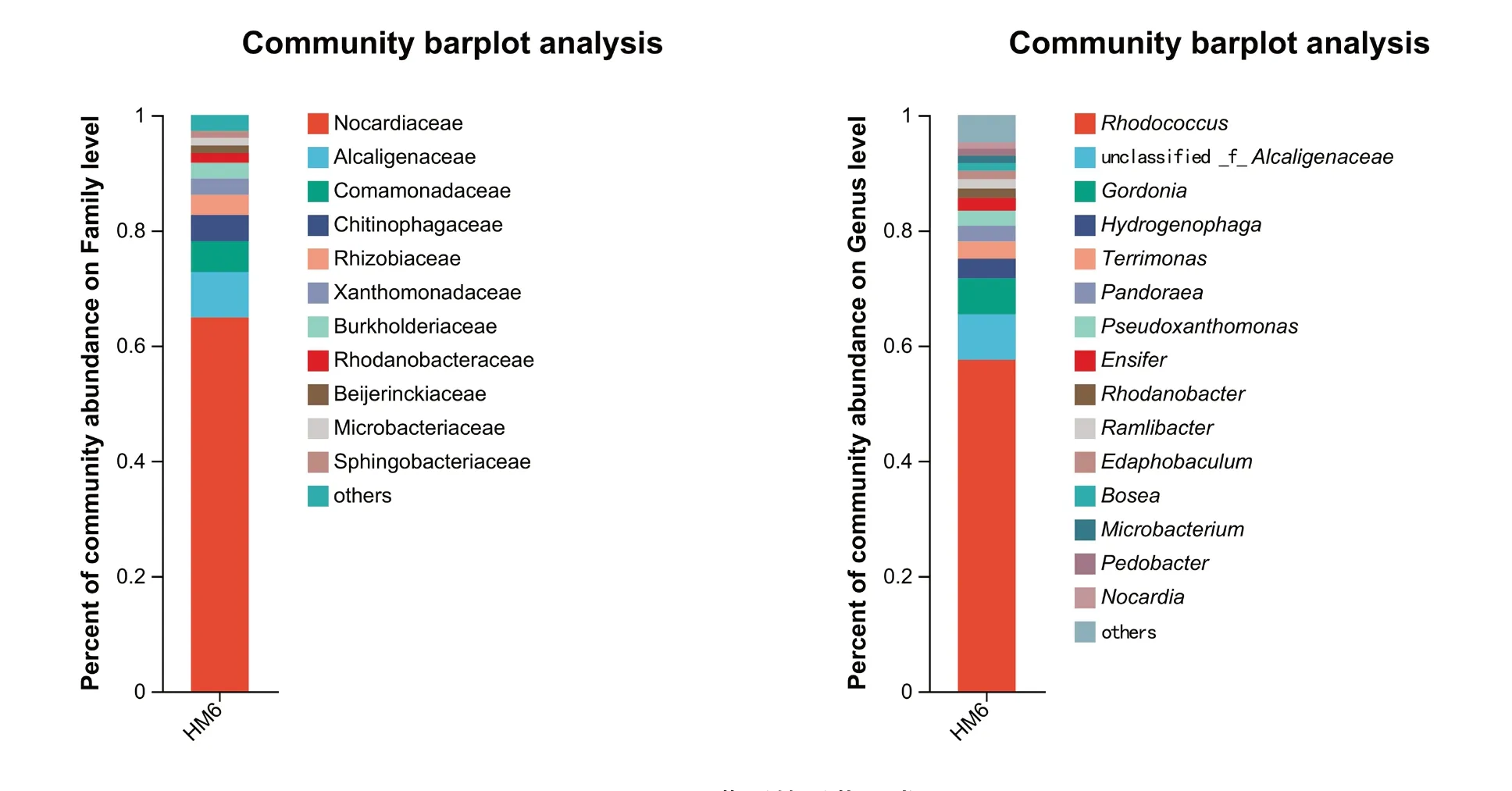
图1 HM6 菌群的群落组成
2.2 HM6 菌群降解DEHP 的能力分析
从图2 可以看出,在含600 mg/L DEHP 的培养基中培养1 d 后,培养基中DEHP 含量降低不明显,可能是该菌群处于生长适应期,生长繁殖较慢,因此对DEHP 的利用较少;培养2~3 d 后,DEHP 含量显著降低,说明HM6 菌群已经适应环境,以DEHP为碳源开始大量生长繁殖;培养3 d 以后,培养基中的DEHP 含量无显著变化,原因可能是培养基的环境已不适应菌群生长,菌体进入衰退期。

图2 HM6 菌群对DEHP 的降解曲线
2.3 环境条件对HM6 菌群降解DEHP 的影响
2.3.1 温 度 温度会影响微生物的生长繁殖,也会影响降解酶的活性,从而影响微生物对有机物质的降解[1]。图3 的结果显示,在15~30℃范围内,HM6 菌群对DEHP 的降解率随着温度的升高而上升,且在30~35℃时达到最大值(>92%);但环境温度提高到40℃时,降解率有所降低。在该研究设定的温度范围内,HM6 均对DEHP 有较大程度地降解,说明该菌株适应环境温度变化的能力较强。

图3 温度对HM6 菌群降解DEHP 的影响
2.3.2 pH 值 根据土壤pH 值范围,该研究考察了pH 值在5~9 之间时HM6 菌群对DEHP 的降解情况。由图4 可知,pH 值为6~8 时,HM6 菌群对DEHP 的降解率无显著性差异,说明中性条件有利于菌株对DEHP 的降解,这一结果与已报道的B6菌株[1]的特性类似;当pH 值降低至5 或提高至9 时,HM6 菌群对DEHP 的降解率显著降低,但仍处于65%以上,说明HM6 菌群能够在较宽pH 值范围内高效降解DEHP,这可能与HM6 菌群组成丰富,在不同pH 值条件下均有菌株发挥DEHP 降解功能有关,从而使HM6 菌群高效降解DEHP 的pH 值范围较广。

图4 pH 值对HM6 菌群降解DEHP 的影响
2.3.3 DEHP 初始浓度 由图5 可知,DEHP 初始浓度≤1 000 mg/L 时, HM6 菌群对DEHP 的降解率均在86%以上,表明菌群对DEHP 具有较强的耐受性;当浓度继续提高至1 500、2 000 mg/L 时,菌群对DEHP 的降解率分别下降至76.4%、61.8%,原因可能是高浓度的DEHP 会对HM6 菌群中部分菌株的生长繁殖产生抑制作用,从而影响DEHP 的降解。与已报道的菌株ASW6D[14]、Lff[16]、B6[1]相比,在一定的DEHP 浓度范围内,该研究的HM6 菌群对DEPH 的降解效率更高。
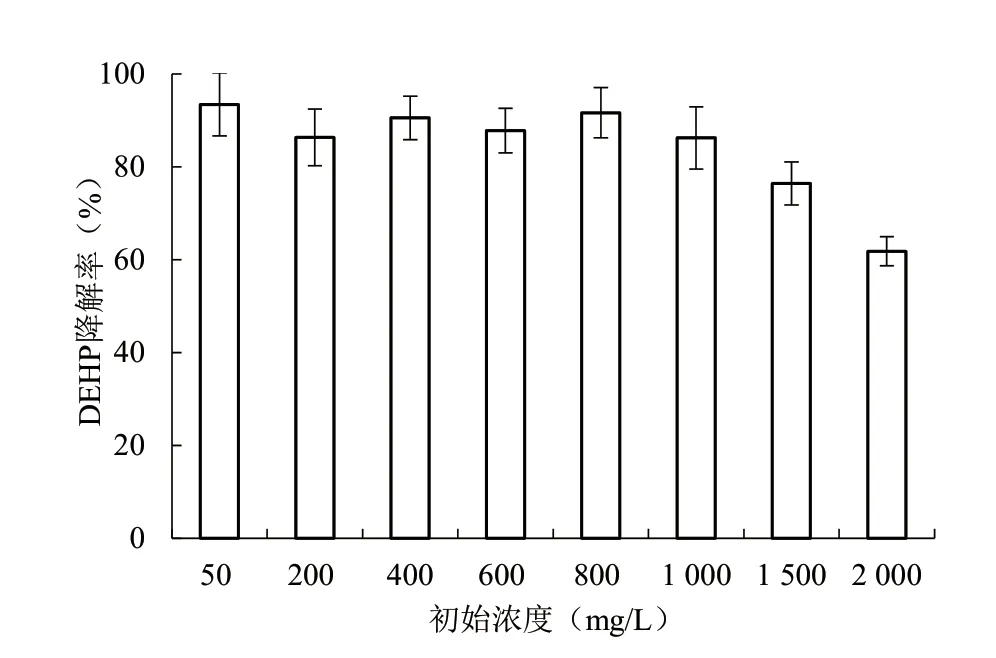
图5 DEHP 初始浓度对HM6 菌群降解DEHP 的影响
2.4 HM6 菌群对土壤中DEHP 的降解效果
从图6 可以看出,21 d 试验周期结束时,接种HM6 菌群的试验组,DEHP 的降解率达70.6%,而对照组的DEHP 降解率仅为28.5%。这表明HM6 菌群的添加显著提高了污染土壤中DEHP 的降解率。处理后不同时期HM6 菌群对DEHP 的降解速率差异较大;处理前3 d,试验组的DEHP 降解率与对照组无显著差异;处理3~9 d 时,HM6 菌群对DEHP的降解达到高峰;随后,HM6 菌群对DEHP 的降解速率又变得较为缓慢。导致这种结果的原因可能是接种菌群3 d 后,外源微生物已适应土壤环境,以DEHP 为碳源开始大量生长繁殖;接种9 d 后降解速度变慢可能是DEHP 通过分配作用进入土壤微孔内,导致微生物难以利用[17]。
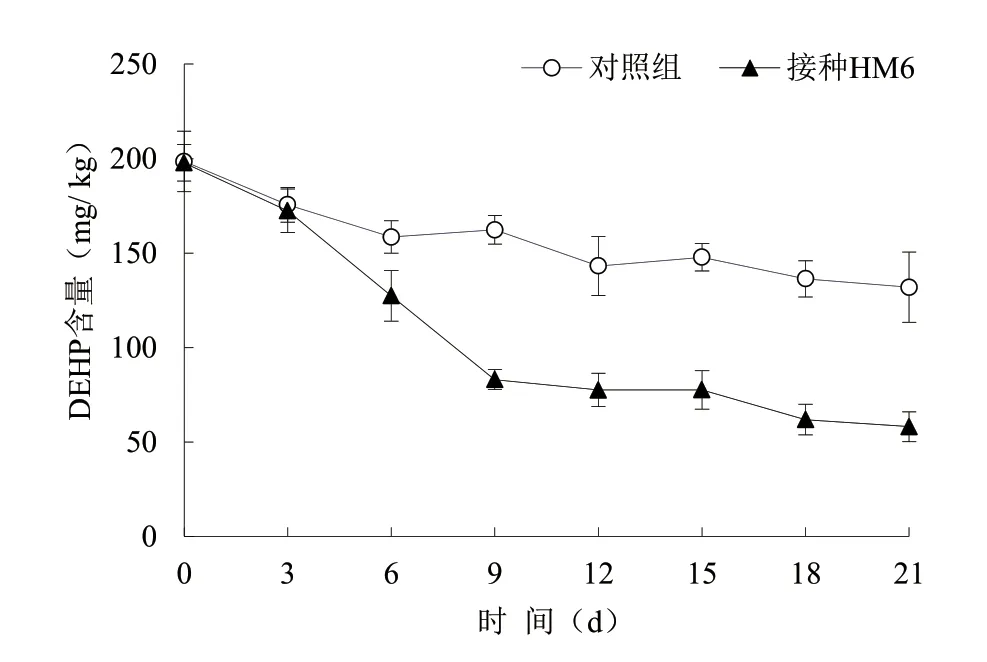
图6 HM6 菌群对土壤中DEHP 的降解效果
3 结 论
该研究从长期使用塑料薄膜大棚种植蔬菜的农田土壤中筛选到一个可高效降解DEHP 的菌群,课题组将其命名为HM6 菌群,对该菌群的群落组成结构进行分析,发现HM6 菌群中最主要的科是Nocardiaceae(64.87%)、Alcaligenaceae(7.91%)、Comamonadaceae(5.34%)、Chitinophagaceae(4.53%),最主要的属为Rhodococcus(57.5%)、unclassified_f_Alcaligencaceae(7.90%)、Gordonia(6.23%)、Hydrogenophaga(3.43%)。对该菌群的DEHP 降解能力进行测定,发现在含600 mg/L DEHP 的培养基中培养3 d 后,HM6 菌群对DEHP 的降解率可达93.9%,表明该菌群对DEHP 的降解性能优良。研究还发现,该菌群可在较宽温度、pH 值范围内高效降解DEHP,最适降解温度为30 或35℃,最适pH值为6.0~8.0,当初始DEHP 浓度≤1 000 mg/L 时,菌群对DEHP 的降解率均大于86%,表明该菌群对DEHP 的耐受能力较强。同时,该研究还考察了HM6 菌群在DEHP 污染土壤(200 mg/kg)中的应用效果,结果显示21 d 试验周期结束时,接种HM6菌群的试验组,DEHP 的降解率达70.6%,而对照组的DEHP 降解率仅为28.5%。这表明HM6 菌群的添加显著提高了污染土壤中DEHP 的降解率,其在DEHP 污染土壤的生物修复方面具有较高的潜在应用价值。
