黄芩苷通过调控MET/EGFR 通路对肝癌细胞增殖的影响
2023-10-30胡志萍付皓云胡齐欣
胡志萍,甘 宁,李 嫚,付皓云,胡齐欣
(湖北省肿瘤医院,湖北 武汉 430079)
肝细胞癌(hepatocellular carcinoma,HCC) 是全球健康的重大威胁之一,虽然目前人类已经在肝癌预防方面取得了巨大的进展,但是肝癌的总发病率和死亡率仍在持续上升[1]。有研究发现,表皮因子生长受体 (epidermal growth factor receptor,EGFR) 可以作为转录因子直接参与调控靶基因的转录,间质表皮转化因子 (mesenchymalepithelial transition factor,MET) 与癌细胞的恶性表型密切相关[2]。黄芩具有解热、抗菌、抗炎、抗氧化等药理作用[3-4],黄芩苷是其主要成分之一。有较多研究表明,黄芩苷能通过各种信号通路对肝癌细胞增殖、迁移和凋亡产生影响[5-7],但其对MET/EGFR 通路的作用机制以及其生物学功能尚不明确。本研究以黄芩苷、MET 抑制剂克唑替尼和EGFR 抑制剂吉非替尼处理人肝癌HepG-2 细胞,通过检测MET/EGFR 信号通路相关的通路蛋白表达探讨黄芩苷对肝癌细胞的影响及其可能机制。
1 材料与方法
1.1 细胞 人肝癌HepG-2 细胞购自中国科学院上海细胞库,由武汉华联科生物技术有限公司实验室保种。
1.2 试剂与药物 黄芩苷(上海阿拉丁生化科技有限公司,批号B110209)。MET 抑制剂克唑替尼、EGFR 抑制剂吉非替尼(美国MedChemExpress 公司,批号HY-50878、HY-50895)。MEM 培养基(天津市灏洋生物制品科技有限责任公司,货号TBD32561); 胎牛血清(武汉普诺赛生命科技有限公司,批号164210); 磷酸缓冲盐溶液(PBS)、0.25%胰蛋白酶(南京森贝伽生物科技有限公司,批号BL-O003、SBJ-L0045); CCK8 试剂、MET、EGFR、β-actin(武汉贝茵莱生物科技有限公司,批号C1706、PAB36425、PAB30672、PAB36265); AnnexinV-FITC/PI 凋亡检测试剂盒(上海抚生实业有限公司,批号FS-79505); PI/Rnase Staining Buffer Solution (上海谷研实业有限公司,批号GOY-K14070); p-MET、p-EGFR (英国Abcam 公司,批号ab5662、ab40815)。
1.3 仪器 倒置荧光显微镜(东莞市瑞显光学仪器有限公司); SpectraMax 酶标仪[美谷分子仪器(上海) 有限公司];流式细胞仪(美国Agilent 公司); 电泳仪(美国Bio-Rad 公司); 全自动化学发光分析仪(上海天能科技有限公司)。
1.4 黄芩苷最适质量浓度、作用时间筛选 HepG-2 细胞以每孔3.0×103个的密度接种于96 孔板,置于37 ℃、5%CO2培养箱中培养过夜,待细胞贴壁后弃培养基,分别加入含0、2.5、5、7.5、10、12.5 μg/mL 黄芩苷的培养基[6],每组3 个复孔,继续培养12、24、48 h,每孔加入10 μL CCK8 溶液,继续培养4 h,在酶联免疫检测仪450 nm波长处测量各孔吸光度,设置调零孔(仅加培养基和CCK8 溶液),计算细胞增殖抑制率。
1.5 分组与给药 HepG-2 细胞以每孔3×103个的密度接种于96 孔板,置于37 ℃、5%CO2培养箱中培养过夜,待细胞贴壁后,分为对照组、黄芩苷组(12.5 μg/mL)、克唑替尼组 (1 μmol/L)、黄芩苷+克唑替尼组 (12.5 μg/mL+1 μmol/L)、吉非替尼组(1 μmol/L)、黄芩苷+吉非替尼组(12.5 μg/mL+1 μmol/L)、克唑替尼+吉非替尼组(1 μmol/L+1 μmol/L)、黄芩苷+克唑替尼+吉非替尼组(12.5 μg/mL+1 μmol/L+1 μmol/L),弃旧培养基,加入含相应剂量药物的新培养基,培养48 h。
1.6 CCK-8 检测细胞增殖抑制率 细胞按“1.5” 项下方法处理,48 h 后每孔加入10 μL CCK8 溶液继续培养4 h,在酶联免疫检测仪450 nm 波长处测量吸光度,设置调零孔(仅加培养基和CCK8 溶液),计算细胞增殖抑制率。
1.7 流式细胞仪检测细胞凋亡率 收集各组细胞,每组约1×106个,4 ℃、400×g离心5 min,重悬于200 μL PBS 中,加入10 μL Annexin V-FITC、10 μL 碘化丙啶(propidium,PI),混匀后4 ℃避光孵育30 min,加入300 μL PBS 上机检测,通过NovoExpress 软件进行分析。
1.8 流式细胞仪检测细胞周期 收集各组细胞,每组约1×107个,4 ℃、400×g离心5 min,重悬于300 μL PBS 中,加入700 μL 无水乙醇,置于-20 ℃冰箱中固定24 h 以上,4 ℃、700×g离心5 min,100 μL 1 mg/mL RNase A 溶液重悬细胞,于37 ℃培养箱中消化细胞RNA 30 min,加入400 μL 50 μg/mL PI 溶液,4 ℃避光孵育10 min,上机检测,通过NovoExpress 软件进行分析。
1.9 Western blot 法检测细胞MET、EGFR 蛋白表达 取各组细胞,裂解提取蛋白,离心后取上清液,蛋白定量后进行变性,经SDS-PAGE 电泳后转移至PVDF 膜,5%脱脂奶粉溶液室温封闭过夜,加一抗室温孵育1 h,PBST 洗涤3次,加HRP 标记的二抗(1 ∶10 000) 室温孵育1 h,PBST洗涤3 次,加入ECL 发光液,于全自动化学发光分析仪中显影,通过TANON GIS 软件读取相关条带灰度值,以βactin 为内参,计算目的蛋白相对表达。
1.10 统计学分析 通过SPSS 19.0 软件进行处理,计量资料以(±s) 表示,2 组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 黄芩苷最适质量浓度、作用时间筛选 如表1 所示,除12.5 μg/mL 外,其他质量浓度黄芩苷在干预12、24、48 h 后均对HepG-2 细胞增殖抑制率无明显影响 (P>0.05); 12.5 μg/mL 黄芩苷干预12、24、48 h 后,HepG-2细胞增殖抑制率升高(P<0.05),以48 h 最显著,因此选择12.5 μg/mL 黄芩苷作用48 h。
表1 不同质量浓度黄芩苷作用不同时间对HepG-2 细胞增殖抑制率的影响(±s,n=3)

表1 不同质量浓度黄芩苷作用不同时间对HepG-2 细胞增殖抑制率的影响(±s,n=3)
注: 与同一作用时间其他质量浓度比较,*P<0.05。
黄芩苷/(μg·mL-1)时间12 h24 h48 h 2.5-0.17±4.42-0.71±1.25-0.39±2.60 5-2.05±4.051.58±1.950.74±2.13 7.51.07±2.22-1.57±1.982.92±2.68 10-0.92±1.50-1.33±0.654.86±1.87 12.56.66±2.48*9.75±1.03*23.26±1.37*
2.2 黄芩苷和MET、EGFR 信号通路抑制剂对HepG-2 细胞凋亡、增殖的影响 与对照组比较,其余组细胞凋亡率和G1期细胞比例升高(P<0.05),黄芩苷+吉非替尼组细胞凋亡率和G1期细胞比例高于吉非替尼组(P<0.05),黄芩苷+克唑替尼组细胞凋亡率和G1期细胞比例高于克唑替尼组(P<0.05),黄芩苷+克唑替尼+吉非替尼组细胞凋亡率和G1期细胞比例高于克唑替尼+吉非替尼组(P<0.05),见图1~2、表2。
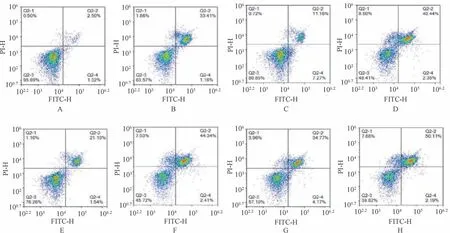
图1 各组HepG-2 细胞凋亡情况
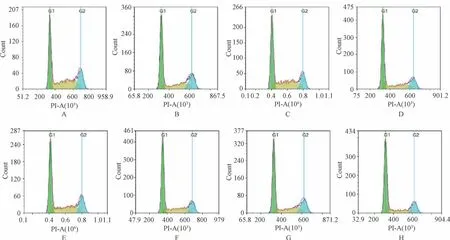
图2 各组HepG-2 细胞周期变化
表2 各组HepG-2 细胞凋亡率、细胞周期比较(±s,n=3)

表2 各组HepG-2 细胞凋亡率、细胞周期比较(±s,n=3)
注: 与对照组比较,*P<0.05; 与克唑替尼组比较,#P<0.05;与吉非替尼组比较,△P <0.05; 与克唑替尼+吉非替尼组比较,▲P<0.05。
组别凋亡率/%G1 期细胞比例/%对照组2.34±1.3036.05±0.52黄芩苷组34.48±0.20*49.74±0.29*克唑替尼组18.16±0.8844.65±1.34黄芩苷+克唑替尼组43.17±0.64#53.02±0.60#吉非替尼组23.03±0.7345.88±0.39黄芩苷+吉非替尼组47.22±1.08△54.60±0.59△克唑替尼+吉非替尼组38.06±1.1249.44±0.73黄芩苷+克唑替尼+吉非替尼组 52.51±0.18▲59.86±0.55▲
2.3 黄芩苷和MET、EGFR 信号通路抑制剂对HepG-2 细胞增殖抑制率的影响 与对照组比较,其余组细胞增殖抑制率均升高(P<0.05),黄芩苷+吉非替尼组细胞增殖抑制率高于吉非替尼组(P<0.05),黄芩苷+克唑替尼组细胞增殖抑制率高于克唑替尼组(P<0.05),黄芩苷+克唑替尼+吉非替尼组细胞增殖抑制率高于克唑替尼+吉非替尼组(P<0.05),见表3。
表3 各组HepG-2 细胞增殖抑制率比较(±s,n=3)

表3 各组HepG-2 细胞增殖抑制率比较(±s,n=3)
注: 与对照组比较,*P<0.05; 与克唑替尼组比较,#P<0.05;与吉非替尼组比较,△P <0.05; 与克唑替尼+吉非替尼组比较,▲P<0.05。
组别增殖抑制率/%对照组0.00±0.93黄芩苷组29.35±0.54*克唑替尼组13.90±1.33黄芩苷+克唑替尼组37.29±0.41#吉非替尼组17.22±0.04黄芩苷+吉非替尼组39.94±0.41△克唑替尼+吉非替尼组31.87±0.46黄芩苷+克唑替尼+吉非替尼组45.95±0.33▲
2.4 黄芩苷和MET、EGFR 信号通路抑制剂对MET/EGFR信号通路蛋白表达的影响 与对照组比较,其余组细胞p-MET、p-EGFR 蛋白表达降低(P<0.05),黄芩苷+吉非替尼组细胞p-MET、p-EGFR 蛋白表达低于吉非替尼组(P<0.05),黄芩苷+克唑替尼组细胞p-MET、p-EGFR 蛋白表达低于克唑替尼组(P<0.05),黄芩苷+克唑替尼+吉非替尼组细胞p-MET、p-EGFR 蛋白表达低于克唑替尼+吉非替尼组(P<0.05),见表4、图3。

图3 各组HepG-2 细胞MET/EGFR 通路蛋白条带
表4 各组HepG-2 细胞MET/EGFR 信号通路蛋白表达比较(±s,n=3)
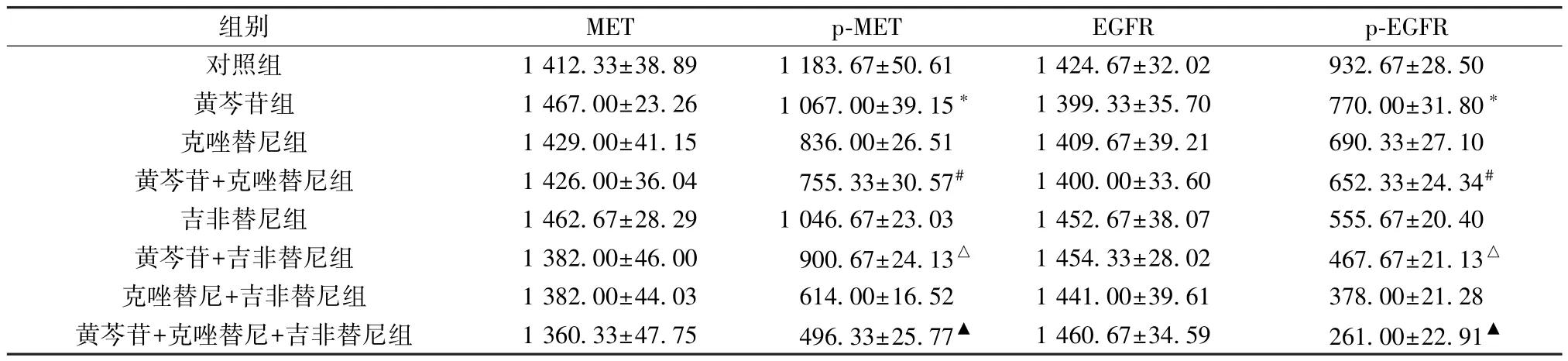
表4 各组HepG-2 细胞MET/EGFR 信号通路蛋白表达比较(±s,n=3)
注: 与对照组比较,*P<0.05; 与克唑替尼组比较,#P<0.05; 与吉非替尼组比较,△P<0.05; 与克唑替尼+吉非替尼组比较,▲P<0.05。
组别METp-METEGFRp-EGFR对照组1 412.33±38.891 183.67±50.611 424.67±32.02932.67±28.50黄芩苷组1 467.00±23.261 067.00±39.15*1 399.33±35.70770.00±31.80*克唑替尼组1 429.00±41.15836.00±26.511 409.67±39.21690.33±27.10黄芩苷+克唑替尼组1 426.00±36.04755.33±30.57#1 400.00±33.60652.33±24.34#吉非替尼组1 462.67±28.291 046.67±23.031 452.67±38.07555.67±20.40黄芩苷+吉非替尼组1 382.00±46.00900.67±24.13△1 454.33±28.02467.67±21.13△克唑替尼+吉非替尼组1 382.00±44.03614.00±16.521 441.00±39.61378.00±21.28黄芩苷+克唑替尼+吉非替尼组1 360.33±47.75496.33±25.77▲1 460.67±34.59261.00±22.91▲
3 讨论
黄芩是我国传统中药材,主产于河北、山东等地,具有解热、抗菌、抗炎、抗氧化等药理作用[8-9]。Oh 等[10]研究发现,从甘草中提取的甘草查尔酮可以通过抑制EGFR和MET 来抑制肺癌细胞活性。传统中药在治疗癌细胞中的价值越来越高。本研究发现,黄芩苷干预后HepG-2 细胞增殖抑制率升高,与MET、EGFR 信号通路抑制剂单独干预的效果相似; 黄芩苷与MET、EGFR 信号通路抑制剂同时干预,能够达到更好的HepG-2 细胞增殖抑制效果,与先前大鼠胆汁中黄芩苷的代谢物黄芩素6-O-β-D-葡萄糖醛酸苷的研究相类似[11]。
细胞凋亡作为程序性细胞死亡,在正常组织的发育和体内稳态中起着重要的作用,不正常的凋亡可能表现为癌症或自身免疫疾病[12-13]。细胞凋亡减少和细胞周期缩短都是肿瘤细胞的特点之一。细胞凋亡与细胞周期也有一定的关系,诱导细胞凋亡信号通路的激活会终止细胞周期进程[14]。目前已有研究指出,黄芩苷能够通过PI3K/Akt/mTOR 途径和线粒体功能障碍来抑制人软骨肉瘤细胞生长和促进细胞凋亡[15]。黄芩苷与信号通路调控细胞的凋亡和细胞周期密切相关[16-17]。本研究发现,黄芩苷干预后HepG-2 细胞凋亡率和G1期细胞比例升高,与MET、EGFR信号通路抑制剂单独干预的效果相似,且联合干预也能获得更好效果。这与黄芩苷可能通过JNK/FoxO1/BIM 信号通路抑制胰腺癌SW1990 细胞的增殖并促进其凋亡的研究[18]及黄芩苷能够抑制慢性糜烂性胃炎浊毒患者体内的Met 信号来减少炎症并恢复细胞周期的研究相一致[19]。
MET/EGFR 信号通路与肝脏发育、增殖和肝细胞癌的发生密切相关[20]。该通路的研究已经成为了癌症治疗的一大突破口。本研究发现,黄芩苷干预后HepG-2 细胞中p-MET 和p-EGFR 蛋白表达均降低,表明黄芩苷具有抑制MET 和EGFR 信号通路的效果; 且黄芩苷和MET、EGFR信号通路抑制剂联合干预后,MET、EGFR 通路蛋白表达降低更显著,提示黄芩苷能单独作为MET 和EGFR 信号通路的蛋白抑制剂,同时也能够增强这2 条信号通路蛋白抑制剂的抑制作用。MET/EGFR 信号通路可作为多种中药发挥药效的信号通路,例如白藜芦醇能够靶向EGFR 和c-Met 信号通路来抑制非小细胞肺癌细胞增殖[21]。
综上所述,黄芩苷对人肝癌细胞有明显的抑制作用,对其凋亡和细胞周期较大影响,并且可能通过抑制MET/EGFR 信号通路来调控其细胞增殖和凋亡,提示黄芩苷有治疗肝癌的潜力。
