沉默SOCS1联合rAAV/PSA基因修饰的树突状细胞疫苗治疗前列腺癌的实验研究
2023-10-30宋浩杰宋琴施为建吕成伟蒋凤莲王丽李全泳
宋浩杰 宋琴 施为建 吕成伟 蒋凤莲 王丽 李全泳
前列腺癌是男性常见的恶性肿瘤,在欧美地区的发病率和死亡率位居男性恶性肿瘤的前三位[1]。近几年来,我国前列腺癌的发病率和死亡率呈现上升趋势,前列腺癌发现时往往以中晚期为主,总体治疗效果仍不理想[2],亟需探索新的治疗手段。而以树突状细胞(dendritic cells,DC)为基础的肿瘤疫苗是前列腺癌治疗中极有希望取得突破的疗法[3]。前列腺特异性抗原(prostate specific antigen,PSA)是前列腺癌的特异性标志物,是一种非常理想的前列腺癌靶抗原。实验研究表明:以重组腺相关病毒(recombinant adeno-associated virus,rAAV)为载体,将前列腺特异性抗原(PSA)基因负载DC,在体外能够诱导较强的PSA抗原特异性的抗肿瘤效应[4]。但成熟DC存在宿主自身抗原特异性免疫耐受[5],限制了DC疫苗的临床疗效。如何促进DC成熟、共刺激和抗原递呈能力以及打破对自身肿瘤相关抗原的免疫耐受是目前DC肿瘤疫苗成功的关键。细胞因子信号抑制因子1(suppressor of cytokine signaling 1,SOCS1) 是一个负性调控分子家族成员,对多种细胞因子的信号转导起负调控作用。研究表明,SOCS1可以调控DC及T细胞的分化、成熟和活化,对DC的免疫负反馈调节起重要作用[6]。我们前期的研究证实:沉默人DC的SOCS1表达,可以促进DC的成熟和活化,促进炎性细胞因子的分泌,减少抑制性细胞因子的分泌,参与免疫调控,有利于促进DC刺激Th1型免疫反应[7]。本研究探索应用重组腺相关病毒(rAAV)介导的RNA干扰技术,沉默人DC的 SOCS1基因的表达,联合携带PSA基因的rAAV/PSA感染DC提供持续的抗原提呈,制备新型DC疫苗,以期促进DC突破宿主水平自身抗原特异性免疫耐受,从而有效激发针对前列腺癌的特异性免疫应答,为临床前列腺癌的免疫治疗提供新的策略。
1 材料与方法
1.1 主要试剂与仪器 淋巴细胞分层液(Ficoll-Hypaque)购自天津血液研究所;重组人白细胞介素 2(IL-2)、重组人白细胞介素4(IL-4)、重组人白细胞介素 7(IL-7)、重组人粒细胞-巨噬细胞集落刺激因子(GM-CSF)、肿瘤坏死因子α(TNF-α)购自Sigma 公司;RPMI-1640培养基、AIM-V 培养基购自Invitrogen公司;DMEM培养基购自Gibco公司;RT-PCR试剂盒购自 Takara公司;Anti-SOCS1抗体购自 Millipore公司。荧光标记小鼠抗人抗体CD80-PE、CD83-FITC、CD86- FITC、CD4-FITC、CD8-FITC、CD25-PE、CD69-PE购自BD公司;FoxP3-APC染色试剂盒购自eBioscience公司;IL-10、IL-12p70、IFN-γ ELISA检测试剂盒购自eBioscience公司;LDH细胞杀伤检测试剂盒购自Biovision公司。流式细胞仪为美国 BD公司产品;倒置荧光显微镜购自Olympus公司;美国Bio-Rad 550型酶标仪。
1.2 重组腺相关病毒和细胞株 携带PSA基因的rAAV/PSA由美国阿肯色大学医学院基因治疗中心刘勇教授惠赠,病毒滴度为1×1011eg/ml。表达shRNA-SOCS1和绿色荧光蛋白的重组腺相关病毒(rAAV-shRNA-SOCS1)已在前期研究中构建制备完成[8],病毒滴度为1×1012eg/ml,保存于-80℃。shRNA-SOCS1序列为:F 5’-TCGACCTGGTTGTTGTAGCAGCTTAAA AGCTTAAGCTGCTACAACAACCAGTTTTTT-3’;R 5’-CTAGAAAAAACTGGTTGTTGTAGCAGCTTAAGCTTTT AAGCTGCTACAACAACCAGG-3’。人前列腺癌细胞株LNCaP (HLA-A2+,PSA+)由本实验室保存。
1.3 方法
1.3.1 人外周血DC的培养:无菌抽取HLA-A2阳性健康志愿者外周血50 ml,肝素抗凝,采用Ficoll密度梯度法分离外周血单个核细胞(PBMC),培养于6孔板,贴壁5 h后,轻轻洗去悬浮的淋巴细胞,剩余贴壁的细胞即为DC前体细胞,每孔加2.5 ml含GM-CSF(800 U/ml)的 AIM-V培养基,隔天半量换液,从培养第2天起加入IL-4(1 000 U/ml)。在DC培养第3天,用rAAV-shRNA-SOCS1感染未成熟DC,感染复数MOI为100,实验分为空白对照组、阴性对照组和RNA干扰组,感染8 h后除去含病毒的培养基,以新鲜的AIM-V培养基取代之,并于第5天起给予TNF-α(20 ng/ml)刺激DC成熟,第7天收集悬浮细胞,即为成熟的DC。
1.3.2 Western blot检测DC的SOCS1蛋白的表达:重组腺相关病毒感染96 h后收集各组细胞进行总蛋白提取,BCA法测定总蛋白浓度,样品蛋白SDS-PAGE电泳分离,电转至PVDF 膜上,封闭液中孵育,加入SOCS1小鼠抗人单克隆一抗(1∶1 000),4℃孵育过夜。TBST洗涤后加入山羊抗鼠二抗(1∶1 000)室温下摇床孵育2 h,TBST洗涤后用化学发光试剂孵育1 min,用X线片曝光显影。以β-actin为内参照验证蛋白的含量。
1.3.3 重组腺相关病毒感染DC:按照1.2.1方法培养的DC至第3天,重组腺相关病毒rAAV-shRNA-SOCS1和rAAV/PSA感染未成熟DC,按照不同处理方式将DC分为3组,Control-DC组(空白对照组DC),rAAV/PSA-DC组(rAAV/PSA感染DC),SOCS1(-)+rAAV/PSA-DC组(沉默SOCS1联合rAAV/PSA感染DC)。从第5天起给予TNF-α (20 ng/ml)刺激DC成熟。隔天半量换液。第7天收集悬浮细胞,即为成熟的DC,计数。
1.3.4 ELISA法检测DC分泌细胞因子的水平:收集3组DC培养第7天的上清液,用ELISA试剂盒检测上清液中细胞因子IL-10、IL-12 p70的含量。反应终止后0.5 h内用酶标仪检测 450 nm吸光度,按标准品浓度与吸光值关系绘制标准曲线,再根据标准曲线计算所测细胞因子的含量。
1.3.5 FACS检测DC表面分子表型:DC培养第7天,分别收集3组成熟的DC,将细胞悬液浓度调至1× 106/ml,PBS洗涤2遍后,100 μl PBS重悬细胞,分别加入CD80、CD83、CD86荧光标记的单克隆抗体及同型对照抗体,混匀后4℃避光孵育30 min,PBS 缓冲液洗涤后,用流式细胞仪检测DC表面分子表型的表达情况。
1.3.6 成熟DC诱导细胞毒性T细胞(CTL)和IFN-γ含量测定:在6孔板内,按DC∶T细胞=1∶20的比例混合细胞,在含GM-CSF(800 U/ml)、IL-2(20 U/ml)、IL-7(20 ng/ml)的 AIM-V 培养基中培养,隔天半量换液,共培养7 d,收获活化的细胞毒性T细胞(CTL)。收集DC与T细胞共育第7天的上清液,用ELISA试剂盒检测上清液中IFN-γ的含量。
1.3.7 FACS分析CTL细胞的免疫表型:3组DC与T淋巴细胞混合反应后,分别收集各组CTL细胞,经处理后置于流式细胞仪专用测试管中,分别加入荧光素标记的鼠源性单抗及同型对照抗体,4℃避光孵育30 min,用PBS溶液洗涤2次,流式细胞仪分析CTL细胞的免疫表型CD4+、CD8+、CD8+CD69+和CD4+CD25+FoxP3+Treg的表达情况。
1.3.8 LDH 法检测CTL对PSA阳性靶细胞的杀伤效应:CD8+细胞毒T淋巴细胞(cytotoxic T lymphocyte,CTL)反应采用 LDH 法检测。收集3组DC诱导的CTL作为效应细胞,收获对数生长期的PSA阳性前列腺癌细胞株LNCaP作为靶细胞,按效靶比 20∶1 的比例分别加入96孔板中,置 37℃、5% CO2培养箱培养4 h。同时设4个对照:靶细胞最大释放组、体积校正对照组、背景对照组和自然释放组。按LDH-Cytotoxicity 试剂盒说明书操作。 细胞杀伤率=[(实验组释放-效应细胞自发释放-靶细胞自发释放)/(靶细胞最大释放-靶细胞自发释放)]×100%。同时取PSA阴性的K562、SW480细胞为靶细胞进行细胞毒实验以分析CTL的非特异杀伤活性。

2 结果
2.1 Western blot检测DC的SOCS1基因沉默效果 Western blot检测重组腺相关病毒感染DC 96 h后各组DC细胞SOCS1蛋白的表达情况,结果为RNA干扰组SOCS1蛋白的表达较阴性对照组和空白对照组显著下降(P<0.05)。阴性对照组与空白对照组比较,差异无统计学意义(P>0.05)。见图1,表1。

表1 Western blot 检测DC的SOCS1蛋白表达 n=3,
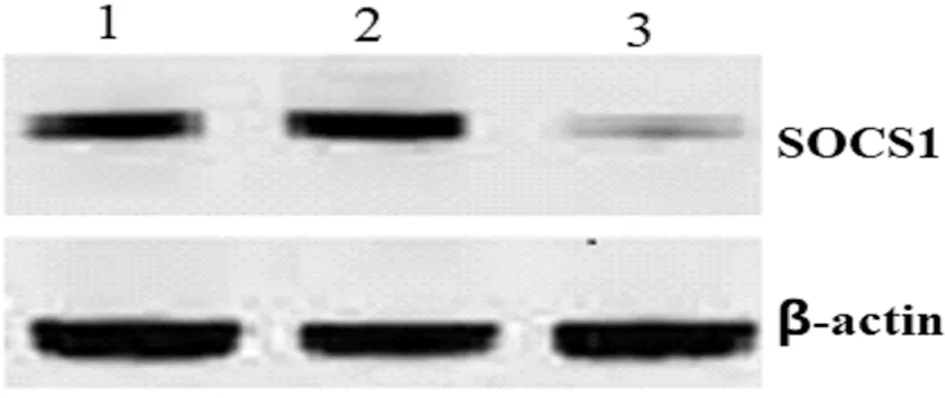
图1 Western blot 检测DC的SOCS1蛋白表达;1空白对照组;2阴性对照组;3RNA干扰组
2.2 DC分泌细胞因子IL-10、IL-12 p70的水平 ELISA检测显示,与Control-DC组和rAAV/PSA-DC组比较,SOCS1(-)+rAAV/PSA-DC组成熟DC培养上清液中IL-12 p70的分泌水平显著升高,而IL-10的分泌水平显著下降,3组间比较差异均有统计学意义(P<0.05)。见表2。

表2 3组DC分泌细胞因子IL-12 p70、IL-10水平比较 n=3,%,
2.3 DC表面分子表型的表达 FACS 检测显示:3组成熟 DC均高表达 CD80、CD83和CD86;SOCS1(-)+rAAV/PSA-DC组各表面分子表型标志的表达水平最高,与Control-DC组和rAAV/PSA-DC组比较,差异均有统计学意义(P均<0.05)。见表3。

表3 3组DC表面分子表型的表达水平 n=3,%,
2.4 CTL细胞释放IFN-γ水平检测 ELISA检测显示,与Control-DC组和rAAV/PSA-DC组比较,SOCS1(-)+rAAV/PSA-DC组成熟DC诱导的CTL释放IFN-γ的水平显著升高,3组间比较差异均有统计学意义(P<0.05)。见表4。

表4 3组CTL细胞释放IFN-γ水平比较 n=3,%,
2.5 FACS分析CTL细胞的免疫表型 FACS检测结果显示:与Control-DC组和rAAV/PSA-DC组比较,SOCS1(-)+rAAV/PSA-DC组成熟DC诱导的CTL细胞免疫表型中,CD8+、CD8+CD69+T细胞的比例均明显增高;而CD4+、CD4+CD25+FoxP3+Treg细胞的比例均显著降低,3组间比较,差异均有统计学意义(P<0.05)。见表5。

表5 3组CTL细胞的免疫表型 n=3,%,
2.6 3组DC诱导的 CTL细胞对靶细胞的杀伤活性和抗原特异性 与Control-DC组和rAAV/PSA-DC组比较,SOCS1(-)+rAAV/PSA-DC组成熟DC诱导的CTL细胞对PSA阳性前列腺癌细胞株LNCaP有明显的杀伤作用,Control-DC组对LNCaP细胞无明显杀伤作用,3组间比较,差异均有统计学意义(P<0.05)。而以上3组CTL细胞对PSA阴性的K562、SW480细胞均无明显杀伤作用。见表6。

表6 3组CTL细胞对靶细胞的杀伤活性 n=3,%,
3 讨论
DC是体内功能最强的专职抗原提呈细胞,在诱导特异性抗肿瘤细胞免疫中起关键作用,DC疫苗被认为是一种最具潜能的肿瘤免疫治疗手段[9]。在DC肿瘤疫苗制备过程中,如何激发高效、强大的自身肿瘤相关抗原特异性细胞免疫反应是实验的关键之一,研究证实,采用AAV载体携带抗原基因转染DC可使抗原基因在DC内稳定表达,在体外诱导特异性抗肿瘤免疫反应[10,11]。然而,由于DC自身存在免疫负反馈调节机制,限制了DC的能力,使DC肿瘤疫苗的临床疗效不能有效发挥,如何突破宿主水平的自身免疫耐受亦是实验的关键。研究发现,SOCS1 是多种细胞因子如 IFN-γ、IL-2、IL-6、IL-7及IL-12 P70的负调控信号,是 DC内存在的免疫负反馈调节点[12,13], SOCS1的表达使成熟的DC能诱导免疫耐受[14]。沉默SOCS1可以显著促进DC成熟、提呈抗原、启动T 细胞免疫的能力,有效增强DC的抗肿瘤免疫反应[15]。Shen等[16]采用RNAi技术抑制DC的SOCS1表达,提高DC的抗原提呈能力及抗原特异性抗肿瘤免疫反应。在一项动物实验中证实,SOCS1杂合性缺失的小鼠几乎不出现自身免疫现象,而SOCS1 纯合性缺失的小鼠会发生严重的自身免疫现象[17]。由此可得出结论,应用 RNAi技术部分沉默 DC 的SOCS1基因表达,一方面可以抑制其负反馈调节,另一方面又不会引起自身免疫疾病。
基于以上研究,为研发新型DC肿瘤疫苗提供了一个新的思路,我们采用RNAi技术沉默DC的SOCS1的表达,提高DC提呈抗原的能力,再负载PSA抗原基因,从而有效激发针对前列腺癌的特异性免疫应答。本研究中采用rAAV-shRNA-SOCS1可高效感染DC,行Western blot检测,DC的SOCS1蛋白的表达水平明显降低,基因沉默效率达82.5%。这表明rAAV-shRNA-SOCS1可有效沉默人DC的SOCS1的表达。我们进一步研究观察SOCS1基因沉默DC的生物学特性和免疫功能。为了验证沉默SOCS1基因对DC成熟的影响,我们检测了DC分子表型的变化,结果发现,与对照组比较,SOCS1基因沉默的成熟DC高表达CD80、CD83和CD86,表面共刺激分子(CD80、CD83及CD86)是DC功能成熟的表面标志,随着DC成熟这些分子表达水平会随之增高。
DC 在成熟过程表达并分泌大量的IL-1β、IL-12、IFN-γ、TNF-α等多种炎性细胞因子,这类细胞因子能有效诱导并增强免疫反应,在机体免疫反应过程中发挥了重要作用。与对照组比较,SOCS1基因沉默的DC可以促进炎性细胞因子IL-12 p70的释放,减少抑制性细胞因子IL-10的释放,从而减弱抑制因子信号,可以进一步促进DC成熟,提高DC的抗原提呈能力,从而参与免疫调控,增强DC的免疫功能。本研究中,与对照组比较,SOCS1(-)+rAAV/PSA-DC组成熟DC诱导的CTL可显著促进Th1类细胞因子IFN-γ的释放,高表达CD8(杀伤型T细胞标志)、CD69 (T细胞早期活化的标志),而低表达CD4(辅助型T细胞标志)、CD25、 FoxP3(抑制性T细胞标志)。以上结果表明,沉默SOCS1联合rAAV/PSA感染的DC能够明显促进T细胞的增殖和活化,促进Th1型免疫反应发生,减少Treg细胞的生成,有助于突破肿瘤免疫耐受,抑制肿瘤免疫逃逸,其抗原递呈途径主要为MHCⅠ类途径,识别CD8+T细胞并活化,从而诱发更强烈的细胞免疫反应。
制备DC肿瘤疫苗的核心是所诱导CTL能特异识别并杀伤抗原阳性的靶细胞,本研究中,与对照组比较,SOCS1(-)+rAAV/PSA-DC组成熟DC所诱导CTL对PSA阳性LNCaP靶细胞具有明显的杀伤活性,杀伤活性明显优于单纯rAAV/PSA-DC所诱导的CTL,并且此杀伤活性具有抗原特异性。这与国内外的研究结论[18,19]相似。
综上所述,rAAV/PSA感染DC,能够诱导针对PSA抗原的特异性免疫反应,而沉默SOCS1基因进一步增强了DC的免疫功能,两种方法联合制备的新型前列腺癌DC疫苗能够进一步增强其免疫活性,产生高效而特异性的抗前列腺癌免疫效应,为临床制备更高效、更特异前列腺癌DC疫苗奠定基础。
