兔斯氏艾美耳球虫、肠艾美耳球虫和大型艾美耳球虫PCR检测靶标的筛选与单一、多重直接PCR检测方法的建立
2023-10-29罗跃军蒲家艳熊常明任永军杨光友
肖 洁,罗跃军,陈 浩,蒲家艳,何 维,熊常明,郝 哥,任永军,杨光友*
(1.四川农业大学动物医学院,成都 611130;2.四川省畜牧科学研究院,成都 610066;3.动物遗传育种四川省重点实验室,成都 610066;4.四川省岳池县动物疫病预防控制中心,岳池 638300)
兔球虫病是由艾美耳科、艾美耳属(Eimeriaspp.)球虫寄生于家兔的肠道或者肝胆管上皮细胞内所引起的一种寄生虫病。该病流行于世界各地,各品种和各年龄阶段的兔均易感,尤其对断奶后至3月龄的幼兔危害最严重,可导致家兔生长速度和饲料转化率降低,甚至引起死亡,给兔业生产造成巨大的经济损失。兔球虫的11种有效种中,斯氏艾美耳球虫(Eimeriastiedae)和肠艾美耳球虫(Eimeriaintestinalis)是分别寄生于兔肝和肠道的强致病性虫种,同时也是我国流行的优势虫种,常引起严重的兔球虫病[1-3];而大型艾美耳球虫(Eimeriamagna)具有中等致病力,在密集饲养兔群中最常见,也是感染我国各地兔群的优势虫种[4-6]。
兔球虫病的诊断主要根据流行病学、临床症状和病理剖检,结合粪便卵囊检查进行综合判断。准确的鉴别兔球虫种类尤其是强致病力虫种是防治兔球虫病的关键,但兔球虫卵囊在虫种间形态学差异不明显,难以进行形态学鉴别。近年来,国内外学者已建立了用于检测粪便中球虫卵囊[7-10]和组织中虫体[11]的PCR方法,然而这些方法都需进行费时昂贵的DNA抽提,且存在DNA丢失现象,对低强度感染或感染早期可能出现漏检。直接PCR技术是一种新开发的检测技术,无需进行DNA抽提,具有快速简便的优点,已用于寄生蠕虫[12-13]、原虫[14]和媒介生物[15]的检测。本研究通过测定斯氏艾美耳球虫线粒体基因组全序列和3种兔球虫顶质体基因rpoB序列,对3种兔球虫靶基因序列相似性分析筛选出特异和灵敏的靶基因,旨在建立能单独或同时检测兔斯氏艾美耳球虫、肠艾美耳球虫和大型艾美耳球虫的直接PCR方法,以期为3种兔球虫的流行病学调查、诊断和防控等提供技术支持。
1 材料与方法
1.1 试验动物和球虫卵囊
试验动物为四川农业大学动物寄生虫病研究中心自繁自养的无球虫新西兰幼兔。
斯氏艾美耳球虫卵囊从阳性兔的胆汁中分离获得并由四川农业大学动物寄生虫病研究中心传代、保存。大型艾美耳球虫卵囊、肠艾美耳球虫卵囊均由中国农业大学刘贤勇老师馈赠。
1.2 主要试剂、仪器
动物组织直接PCR试剂盒购自成都福际生物有限公司;琼脂糖凝胶DNA回收试剂盒、2×TaqPCR Master Mix、多重PCR扩增试剂盒购自天根生化科技(北京)有限公司;pMD19-T载体、DNA Marker购自大连宝生物工程有限公司。
PCR反应扩增仪购自美国Bio Rad公司,DF-C型稳压稳流电泳仪购自北京市六一仪器厂。KZ-II高速组织研磨仪购自武汉赛维尔生物科技有限公司。
1.3 样品采集和DNA裂解
用肠艾美耳球虫(100个·只-1)和大型艾美耳球虫(200个·只-1)孢子化卵囊分别感染3只30日龄的无球虫幼兔,感染后收集卵囊孢子化培养后于4 ℃保存。取4 ℃保存的斯氏艾美耳球虫、大型艾美耳球虫和肠艾美耳球虫卵囊各1×105个,3 000 r·min-1离心10 min洗去重铬酸钾,保留沉淀备用。
为确保充分破碎,虫体先经液氮反复冻融5次后进行研磨,根据动物组织直接PCR试剂盒操作说明加入Buffer AL 100 μL、Foregene Protease 4 μL,65 ℃裂解30 min,紧接着95 ℃孵育5 min。孵育后,12 000 r·min-1离心5 min,收集上清液直接作为PCR反应的模板。
120只30日龄健康无球虫新西兰兔随机分为3组(n=40),分别人工感染斯氏艾美耳球虫、大型艾美耳球虫和肠艾美耳球虫。根据文献报道分别在特定时间取3种球虫裂殖体阶段(n=7)和配子体阶段(n=7)的肝和肠道组织样品[11,16-17],于-20 ℃保存备用。每组余下26只兔达到排虫期时,对其进行安乐死并收集肠道组织(n=13)与粪样(n=13)保存备用。粪样参照汪运舟等[18-19]报道的方法,进行饱和食盐水浓集法富集粪样中的卵囊。
1.4 检测靶标的筛选
艾美耳球虫PCR检测候选靶标主要包括内转录间隔区序列(ITS1、ITS2)、线粒体基因(cytb、cox1、cox3)和顶质体基因(rpoB)。从GenBank数据库下载斯氏艾美耳球虫(登录号:JQ328190)、肠艾美耳球虫(登录号:JX406874)和大型艾美耳球虫(登录号:JX406876)的ITS序列。
通过PCR方法测定斯氏艾美耳球虫mtDNA,肠艾美耳球虫、大型艾美耳球虫和斯氏艾美耳球虫的顶质体基因(rpoB)。
1.4.1 斯氏艾美耳球虫mtDNA全序列测定与分析 根据GenBank公布的6种兔艾美耳球虫线粒体基因组全序列的保守片段设计5对引物P1、P2、P3、P4、P5(表1),采用分段克隆测序再拼接的方法对斯氏艾美耳球虫线粒体基因组全序列进行测定。反应体系:2×TaqPCR Master Mix 25 μL、ddH2O 17.5 μL、DNA裂解液 2.5 μL、上、下游引物各2.5 μL,共计50 μL ;梯度PCR反应条件:在94 ℃预变性5 min,94 ℃变性30 s,50~55 ℃退火30 s,72 ℃延伸80 s,共35个循环,终延伸5 min。PCR产物用1%琼脂糖凝胶电泳检测,对检测正确的PCR扩增产物胶回收纯化,并将其连接到pMD19-T载体上,转化到DH5α感受态细胞,将菌液PCR鉴定阳性克隆送上海生工生物股份有限公司测序。
用软件SeqMan7.1将测序结果和6种兔球虫线粒体基因组全序列(肠艾美球虫KP009592、无残艾美耳球虫KP025690、中型艾美耳球虫KP025691、维氏艾美耳球虫KP025692、黄艾美耳球虫KP025693、大型艾美耳球虫KF419217)进行序列比对和拼接,得到斯氏艾美耳球虫mtDNA全序列,利用DNAMAN6.0软件和在线多序列比对工具Clustal(https:∥www.ebi.ac.uk/Tools/msa/clustalo/)分析。
1.4.2 3种兔球虫顶质体基因rpoB的测定与分析 参考田思勤等[20]报道的艾美耳球虫rpoB扩增引物(上游:5′-GCCCATATTTCCATTTCTCC-3′,下游:5′-GTGGTCGTTATGGAAATAAAGG-3′)和方法扩增3种球虫的rpoB基因。将检测正确的PCR扩增产物纯化后连接到pMD19-T载体上,转化到DH5α感受态细胞,将菌液PCR鉴定阳性克隆送上海生工生物股份有限公司测序,测序结果用DNAMAN6.0软件和在线多序列比对工具Clustal(https:∥www.ebi.ac.uk/Tools/msa/clustalo/)分析。
1.5 单一、多重直接PCR检测方法的建立
根据3种兔球虫筛选出的靶标序列各设计两对引物(表2)。每对引物经单一直接PCR,选择具有良好的特异性和敏感性引物进行多重PCR检测。同时,对引物浓度、退火温度以及反应体系等进行优化。

表2 三种兔球虫直接PCR检测引物
由于组织样本中含有大量宿主核酸,对多重直接PCR检测结果的影响较大,因此本研究建立主要针对兔粪样中球虫卵囊的多重直接PCR检测方法。按优化后的反应条件,以斯氏艾美耳球虫卵囊、肠艾美耳球虫卵囊、大型艾美耳球虫卵囊DNA裂解液单独或混合作为模板验证多重直接PCR的特异性;同时将含斯氏艾美耳球虫、肠艾美耳球虫、大型艾美耳球虫卵囊各1×105个的DNA裂解液(共100 μL)进行倍比稀释,得到每1.5 μL中分别对应3种球虫各含50、5、0.5和0.25个卵囊DNA量的稀释液,对多重直接PCR的敏感性进行检测。反应体系:10×Multi HotStart Buffer 2.5 μL、Super Pure dNTPs 2 μL、Multi HotStart DNA Polymerase 0.5 μL、MgCl22 μL、混合引物 6 μL、DNA裂解液各0.5 μL、ddH2O 10.5 μL,共计25 μL;反应条件:95 ℃预变性15 min,94 ℃变性30 s,58 ℃退火90 s,72 ℃延伸90 s,共计40个循环。
2 结 果
2.1 三种兔球虫mtDNA、rpoB和ITS序列分析
2.1.1 斯氏艾美耳球虫mtDNA序列分析 斯氏艾美耳球虫mtDNA呈线性重复排列,全长6 277 bp(登录号:OQ427352),包括3个蛋白质基因(cytb、cox1、cox3)和23个rRNA基因(图1、图2)。与肠艾美球虫、无残艾美耳球虫、中型艾美耳球虫、维氏艾美耳球虫、黄艾美耳球虫、大型艾美耳球虫mtDNA序列相比,序列总体相似性为93.90%~97.45%;cytb位于128—1 207位,与上述其他6种球虫cytb序列相似性为93.43%~97.78%,与此前上传的斯氏艾美耳球虫cytb序列(登录号:HQ173890)相似性100%;cox1位于1 241—2 683位,与其他6种球虫相应序列相似性为93.47%~98.87%;cox3位于4 298—5 053位,与其他6种球虫相应序列相似性为92.23%~96.98%。
2.1.2 3种兔球虫顶质体基因rpoB的测定与分析 斯氏艾美耳球虫(登录号:OQ421116)、肠艾美耳球虫(登录号:OQ421118)和大型艾美耳球虫(登录号:OQ421117)顶质体基因rpoB大小均为500 bp左右(图略),经测序分析三者序列相似性达93.93%~95.30%。
2.1.3 3种兔球虫ITS序列分析 斯氏艾美耳球虫(登录号:JQ328190)、肠艾美耳球虫(登录号:JX406874)和大型艾美耳球虫(登录号:JX406876)与其他兔球虫(微型艾美耳球虫KT361060、黄艾美耳球虫JX406873、无残艾美耳球虫JX406875、中型艾美耳球虫JX406877)ITS序列相似性很低,分别为35.10%~65.25%、44.61%~66.09%、44.75%~74.93%。
2.2 单一直接PCR检测方法的建立
经序列分析与筛选,ITS种内保守和种间差异大,是良好的分子诊断标识候选。基于3种兔球虫ITS序列设计引物,根据每对引物单一直接PCR的结果,引物Ps1、Pi2、Pm2具有良好的特异性(图3)和敏感性(图4),引物Ps1、Pi2能检测出相当于1个卵囊DNA量的稀释液,引物Pm2能检测出相当于0.5个卵囊DNA量的稀释液,且三者的最佳退火温度均为58 ℃。同时,分别用上述建立的三种直接PCR方法对人工感染的组织和粪便样本(三种兔球虫样品分别包括裂殖体阶段样本7份,配子体阶段样本7份,排虫期组织和粪便样本各13份)进行检测,可达到100%的检出率(图5~7)。因此,建立的三种单一直接PCR方法可用于患病死亡兔组织中球虫核酸及粪样中球虫卵囊的检测。

A. 基于斯氏艾美耳球虫ITS的单一PCR(引物Ps1;M. D2000 DNA相对分子质量标准;1.模板为Eimeria stiedae DNA;2.模板为E. intestinalis DNA;3.模板为E. magna DNA);B. 基于大型艾美耳球虫ITS的单一PCR(引物Pm2;M. D2000 DNA相对分子质量标准;1.模板为E. magna DNA;2.模板为E. stiedae DNA;3.模板为E. intestinalis DNA);C. 基于肠艾美耳球虫ITS的单一PCR(引物Pi2;M. D2000 DNA相对分子质量标准;1.模板为E. intestinalis DNA;2.模板为E. stiedae DNA;3.模板为E. magna DNA)A. Direct PCR amplification based on Eimeria stiedae (primer Ps1; M. DNA marker D2000; 1. Template is Eimeria stiedae DNA; 2. Template is E. intestinalis DNA; 3. Template is E. magna DNA); B. Direct PCR amplification based on E. magna (primer Pm2; M. DNA marker D2000; 1. Template is E. magna DNA; 2. Template is E. stiedae DNA; 3. Template is E. intestinalis DNA); C. Direct PCR amplification based on E. intestinalis (primer Pi2; M. DNA marker D2000; 1. Template is E. intestinalis DNA; 2. Template is E. stiedae DNA; 3. Template is E. magna DNA)图3 引物Ps1、Pm2、Pi2直接PCR特异性试验Fig.3 Primer (Ps1, Pm2, and Pi2) specificity was validated by direct PCR

M. D2000 DNA相对分子质量标准;1~6. 对应DNA模板稀释倍数分别相当于500、100、10、1、0.5和0.25个卵囊M. DNA marker D2000; 1-6. Dilutions of the corresponding DNA template were equivalent to 500, 100, 10, 1, 0.5, and 0.25 oocysts, respectively图4 引物Ps1 (A)、Pm2 (B)、Pi2 (C)单一直接PCR敏感性试验Fig.4 The sensitivity of Ps1 (A), Pm2 (B), and Pi2 (C) were validated by direct PCR
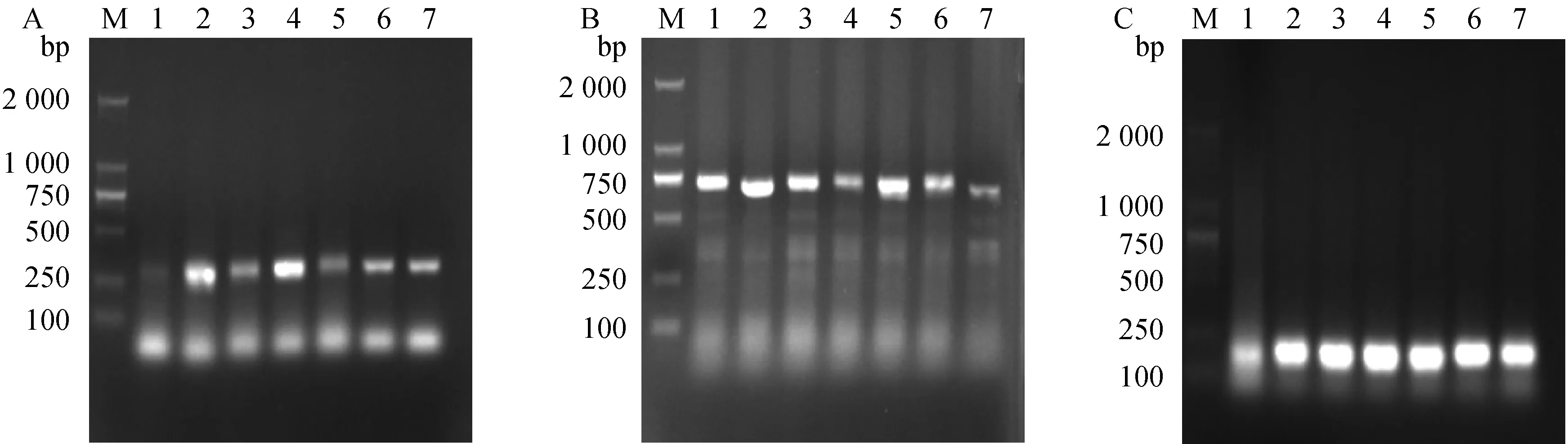
M. D2000 DNA相对分子质量标准;1~7. 取自7只不同兔裂殖体阶段的组织样本M. DNA marker D2000; 1-7. Tissue samples were collected from 7 rabbits at schizont stage, respectively图5 引物Ps1 (A)、Pm2 (B)、Pi2 (C)直接PCR方法检测人工感染组织样本(裂殖体阶段)Fig.5 Detection of experimentally infected samples by direct PCR methods based on Ps1 (A), Pm2 (B), and Pi2 (C) (schizont stage)
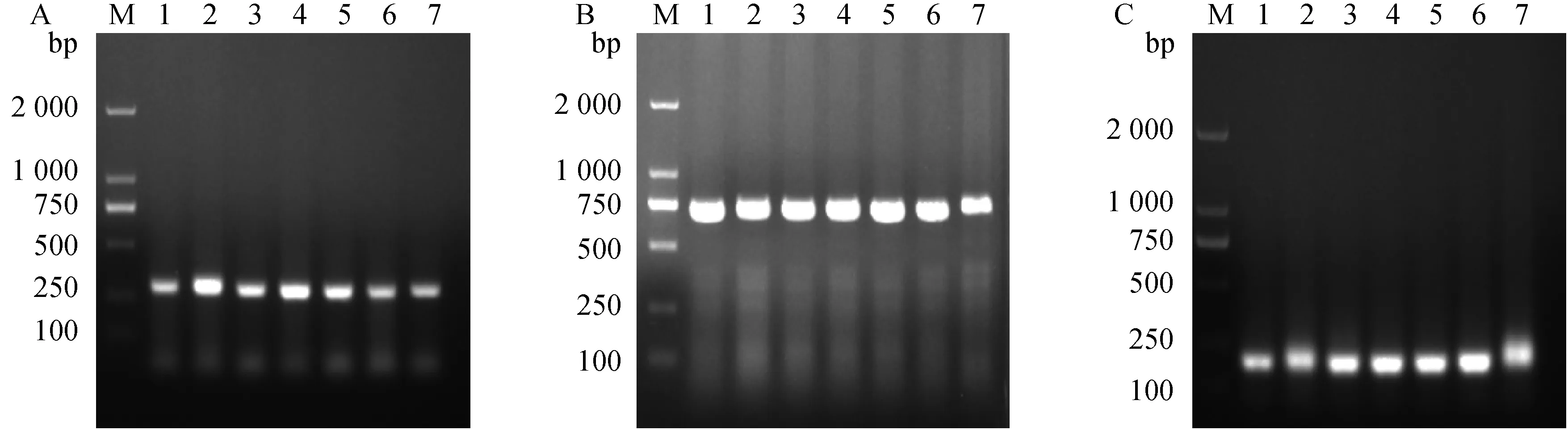
M. D2000 DNA相对分子质量标准;1~7.取自7只不同兔配子体阶段的组织样本M. DNA marker D2000; 1-7. Tissue samples were collected from 7 rabbits at gametophytic stage, respectively图6 引物Ps1 (A)、Pm2 (B)、Pi2 (C)单一直接PCR方法检测人工感染组织样本(配子体阶段)Fig.6 Detection of experimentally infected samples by direct PCR methods based on Ps1 (A), Pm2 (B), and Pi2 (C) (gametophytic stage)

M. D2000 DNA相对分子质量标准;1~13. 取自13只不同兔排虫期的组织样本;14~26. 取自13只不同兔排虫期的直肠粪便样本M. DNA marker D2000; 1-13. Tissue samples were collected from 13 rabbits at patent period, respectively; 14-26. Stool samples were collected from 13 rabbits at patent period, respectively图7 引物Ps1 (A)、Pm2 (B)、Pi2 (C)单一直接PCR方法检测人工感染组织和粪便样本(排虫期)Fig.7 Detection of experimentally infected tissue and stool samples by direct PCR methods based on Ps1 (A), Pm2 (B), and Pi2 (C) (patent period)
2.3 多重直接PCR检测方法的建立
以3种兔球虫卵囊DNA裂解液单独或混合后作为模板,按优化后的多重PCR条件扩增,产物中195 bp代表肠艾美耳球虫、384 bp代表斯氏艾美耳球虫、712 bp条带代表大型艾美耳球虫。反应体系为:10×Multi HotStart Buffer 2.5 μL、Super Pure dNTPs 2 μL、Multi HotStart DNA Polymerase 0.5 μL、MgCl22 μL、混合引物 6 μL、DNA裂解液各0.5 μL、ddH2O 10.5 μL,共计25 μL;反应条件:95 ℃预变性15 min,94 ℃变性30 s,58 ℃退火90 s,72 ℃延伸90 s,共计40个循环。结果显示,单一模板或混合模板均能成功扩增出相应的目的条带(图8A)。含斯氏艾美耳球虫卵囊、肠艾美耳球虫卵囊、大型艾美耳球虫卵囊各1×105个的DNA裂解液倍比稀释后,使用多重PCR试剂盒最低能检测出相当于3种兔球虫卵囊各5个的稀释液(图8B)。

M. D2000 DNA相对分子质量标准;1.模板Eimeria stiedae、Eimeria magna、Eimeria intestinalis混合DNA;2.模板Eimeria magna DNA;3. 模板Eimeria intestinalis DNA;4.模板Eimeria stiedae DNA;5~8.模板为三种球虫混合DNA,分别对应三种球虫各含50、5、0.5和0.25个卵囊DNA量的稀释液。均以Ps1、Pi2、Pm2为引物M. DNA marker D2000; 1. Template is the mixed DNA of Eimeria stiedae, E. magna and E. intestinalis; 2. Template is E. magna DNA; 3. Template is E. intestinalis DNA; 4. Template is E. stiedae DNA; 5-8. template is the mixed DNA of Eimeria stiedae, E. magna and E. intestinalis, dilutions of the corresponding DNA template were equivalent to 50, 5, 0.5, and 0.25 oocysts of each coccidia, respectively. Using Ps1, Pi2, and Pm2 as primers图8 多重直接PCR特异性(A)和敏感性(B)检测Fig.8 The specificity (A) and sensitivity (B) of the multiplex direct PCR method
3 讨 论
3.1随着养兔业的规模化、集约化程度不断提高,兔球虫病对生产的危害愈发凸显。大型艾美耳球虫、斯氏艾美耳球虫和肠艾美耳球虫是我国主要养兔区的优势虫种,同时也是致病性较强的兔球虫,给养兔业造成巨大经济损失。在生产中,兔球虫一般呈混合感染,准确地鉴定虫种可以为兔球虫病流行风险评估及兔球虫病防治对策的制定提供参考。仅依据卵囊的形态很难准确地鉴定出兔球虫种类,而PCR检测敏感性高,特异性强,能批量检测,已被应用于各类畜禽球虫病的检测和流行病学调查[21-23]。然而,这些方法都需要进行费时而昂贵的DNA抽提步骤,而在直接PCR中,裂解缓冲液在65 ℃条件下10~30 min内检测样品释放基因组DNA,释放出的微量DNA可直接作为模板进行PCR。不仅节省了样品和检测时间(能在3 h内完成整个检测过程),而且最大限度地减少了人为错误和污染,具有良好的应用前景[24]。
3.2基于不同靶基因的PCR诊断方法,其敏感性、特异性存在差异,因此有必要对艾美耳球虫PCR检测靶标进行筛选[25-26]。ITS进化快,是常见的艾美耳球虫鉴别标识;而顶质体和线粒体相似,进行母性遗传,其产生的变异能准确地反映出虫种差异[20,27]。本研究分析了大型艾美耳球虫、斯氏艾美耳球虫和肠艾美耳球虫内转录间隔区序列(ITS1、ITS2)、线粒体基因(cytb、cox1、cox3)、顶质体基因(rpoB)等靶标的序列相似性,发现三种兔球虫线粒体基因和顶质体基因rpoB较保守,而ITS序列种间差异明显,是良好的分子检测靶标,这与Yan等[28]和许家园等[29]的研究一致。引物设计是多重PCR的关键环节,引物的Tm值应基本一致且目的片段的大小需适宜。在本研究中,基于3种兔球虫的ITS序列各设计了2对引物,通过单一PCR筛选后的3对引物Ps1、Pi2、Pm2单一或混合检测时均具有良好的特异性和敏感性。
3.3在生产上兔球虫病虽流行普遍,但亚临床感染病例较多,尤其是健康带虫者的兔群粪样中卵囊数量较低,需要灵敏的检测方法。而1~3月龄幼兔感染球虫后易继发其他疾病导致急性死亡,此时虫体主要存在于寄生组织中,还未形成大量卵囊随粪便排出,尤其是斯氏艾美耳球虫寄生于肝,具有较长的潜隐期[30]。因此对于死亡病例进行组织的PCR检测,准确判断致病虫种对兔球虫病的防治有十分重要的意义。本研究建立的斯氏艾美耳球虫、肠艾美耳球虫和大型艾美耳球虫单一直接PCR检测方法特异且敏感,其中斯氏艾美耳球虫和肠艾美耳球虫最低能检测出相当于1个卵囊DNA的稀释液,大型艾美耳球虫最低能检测出相当于0.5个卵囊DNA量的稀释液,和普通PCR的敏感性相当[7,31],同时建立的3种兔球虫单一直接PCR方法对于不同发育阶段组织样本以及排虫期粪便样本均可达到100%的检出率,说明本研究建立的3种单一直接PCR方法可用于患病死亡兔组织样本中球虫核酸和粪样中球虫卵囊的检测,为3种兔球虫病流行病学调查及诊断提供便捷、可靠的技术支持。
基于单一虫种检测直接PCR方法基础上建立的三重直接PCR也具有良好的特异性,其敏感性虽不及单一虫种检测的直接PCR,但最低仍能检测出相当于3种兔球虫各5个卵囊DNA的混合液。由于组织样本中含有大量的宿主核酸,容易影响多重直接PCR检测结果,因此该方法主要用于兔粪样中球虫卵囊的检测,通过饱和食盐水浓集法富集粪样中的卵囊后,可大大减少粪便中杂质对PCR反应的抑制作用,从而达到对粪样中3种兔球虫卵囊的快速临床检测。
4 结 论
本研究首次测定了兔斯氏艾美耳球虫、肠艾美耳球虫和大型艾美耳球虫顶质体基因rpoB序列以及斯氏艾美耳球虫线粒体基因组全序列,并在此基础上对PCR检测靶基因进行筛选。
3种兔球虫ITS具有种内保守和种间差异大的特点,更适合用于分子诊断。筛选出的引物Ps1、Pi2、Pm2单一直接PCR能检测出相当于1、1和0.5个卵囊DNA量的稀释液,且对组织和粪便样本均达到100%的检出率,该方法除可应用于兔粪样中球虫卵囊的检测外,还可用于患病死亡兔组织样本中球虫核酸的检测。多重直接PCR能检测出相当于3种兔球虫各5个卵囊DNA量的稀释液,且两种方法均具有良好的特异性,可对兔粪样中3种兔球虫卵囊进行快速检测。本研究建立的单一和多重直接PCR检测方法为兔球虫病的病原检测与诊断提供了便捷、可靠的技术支持。
