血满草多糖介导巨噬细胞M1型极化抑制肺癌的作用机制研究
2023-10-29袁雷胡亚东
袁雷,胡亚东
(1.西藏农牧学院,西藏特色农牧资源省部共建协同创新中心,西藏自治区 林芝 860000;2.中国科学院成都生物研究所,四川 成都 610041)
肿瘤防治是一个全球性难题,2013年《Science》杂志将肿瘤的免疫治疗评为当年十大科技进展之首,2018年抑制免疫负向调控用于肿瘤治疗的研究被授予诺贝尔生理学与医学奖,从而使肿瘤免疫治疗成为时代主流。与传统的直接靶向肿瘤细胞的治疗方法不同,通过激活宿主的免疫系统从而达到消除肿瘤是肿瘤免疫疗法的主要作用机制[1]。
重塑肿瘤相关巨噬细胞(TAM)是癌症免疫治疗的有效策略[2-3]。TAM 是肿瘤微环境(TME)的重要组成部分之一,占肿瘤体积的50%,可分为两种亚型,即典型激活的巨噬细胞(M1)和交替激活的巨噬细胞(M2)。简单地说,M1 亚型具有强大的抗原呈递能力,可以促进Th1 免疫以杀死肿瘤细胞。然而,TME 中的大多数TAM 倾向于分化为M2 表型。M2 巨噬细胞可诱导组织修复和血管生成的Th2 型免疫,从而促进肿瘤生长和转移[3-4]。因此,将TAM 极化为M1 亚型的免疫调节剂是近年来研究的热点。
多糖的免疫调节作用是其最重要的生物活性之一,灵芝多糖[5]、红花多糖[6]、紫锥菊多糖[7]、蛹虫草多糖[8]等均可通过调控巨噬细胞极化抑制肿瘤的发生发展。血满草(Sambucus adnata)为我国民间常用药,也是藏药的药源植物之一,其味辛、涩、性温,具有祛风、利水、活血、通络的功效,主治急慢性肾炎、风湿疼痛等症[9]。前期研究中,本课题组详细解析了血满草多糖(Sambucus adnatepolysaccharide,SPS-1)的结构特征,并发现SPS-1 与TLR2 受体结合并通过MAPKs 和NF-κB 信号通路激活RAW 264.7 细胞的免疫活性[10]。本研究在前期研究基础上通过探讨SPS-1 对巨噬细胞极化的影响及在共培养条件下对Lewis 细胞的抑制作用研究,以期为深入开展血满草多糖SPS-1的抗肿瘤作用及实际应用奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 细胞株
小鼠单核巨噬细胞RAW264.7 和小鼠肺癌细胞Lewis由武汉普诺赛生命科技有限公司提供。
1.1.2 实验药物
血满草多糖SPS-1 为本课题组自制,糖含量94.76%。
1.1.3 主要试剂
DMEM 高糖细胞培养基、青霉素/链霉素双抗和胎牛血清(美国Gibco公司);白细胞介素-4(IL-4,美国PeproTech 公司);Trizol(美国Ambion 公司);小鼠单抗β-肌动蛋白(β-actin)、辣根过氧化物酶/HRP标记羊抗兔二抗(武汉博士德生物工程有限公司);兔多抗巨噬细胞甘露糖受体(CD206)、E-钙黏蛋白(ECadherin)、N-钙黏蛋白(N-Cadherin)和波形纤维蛋白(Vimentin)(武汉三鹰生物技术有限公司);兔多抗磷酸甘油醛脱氢酶(GAPDHF,杭州贤至生物有限公司);兔单抗B 淋巴细胞瘤-2 蛋白(Bcl-2)、Bcl-2 相关X 蛋白(Bax)(美国Abcam 公司);A 型血管表皮生长因子(VEGF-A)、缺氧诱导因子-1(HIF-1α)酶联免疫吸附测定(ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司);兔多抗白细胞分化抗原(CD86)、反转录试剂盒、SYBR Green(南京诺唯赞生物科技股份有限公司);引物合成(北京擎科生物科技有限公司);其他试剂均为分析纯或色谱纯。
1.1.4 主要仪器
电子天平(北京赛多利斯仪器系统有限公司,型号:CPA225D);酶标仪(美国Thermo 公司,型号:mµlISKANMK3);荧光定量PCR 仪(美国ABI 公司,型号:QuantStudio 6);CO2恒温培养箱(日本SANYO 公司,型号:MCO-15AC);流式细胞仪(美国Beckman coulter 公司,型号:cytoFLEX);离心机(美国Eppendorf公司,型号:5702R)。
1.2 细胞培养
将液氮保存的RAW264.7 细胞和Lewis 细胞于37 ℃水浴中溶解冻存液;并将细胞转移至含有5 mL培养基的离心管中,常温条件下1 000 r/min离心5 min收集细胞;用高糖DMEM 培养基(含10%胎牛血清)悬浮细胞,接种至培养皿,37 ℃、5% CO2条件下培养。后续实验选择对数生长期细胞。
1.3 巨噬细胞极化分析
将RAW264.7细胞接种于6孔板中,加入20 ng/mL的IL-4 培养24 h,收集细胞并用PBS 清洗2 次,得到M2 型巨噬细胞。随机分为M0 组(对照组)、M2 组(M2极化组)、M21 组(M2 极化组 + 200 µg/mL SPS-1)、M22 组(M2 极化组+ 400 µg/mL SPS-1)和M23 组(M2 极化组 + 800 µg/mL SPS-1),给予相应药物处理24 h。
1.3.1 表面标志物的检测
采用Western blot 技术分析不同极化状态RAW264.7 细胞的表面标志物(CD206 和CD86)。各组培养24 h后用胰蛋白酶消化并收集细胞,RIPA 裂解液将细胞裂解30 min,4 ℃、12 000 r/min 离心10 min,取上清测定蛋白质浓度。样品经SDS-PAGE电泳、转膜、封闭1 h 后,一抗孵育过夜,TBST 洗涤5 次,孵育二抗,用ECL 试剂盒进行显影,成像系统显像并采用BandScan 软件分析条带灰度值,重复3 次。一抗包括抗CD206(1∶500)、抗CD86(1∶1 000)和抗β-actin(1∶500),二抗包括山羊抗兔/小鼠IgG-HRP。以目的蛋白条带与内参β-actin 蛋白条带的灰度值之比表示目的蛋白的相对表达水平。
1.3.2 TNF-α、iNOS、IL-10、TGF-β 和Arg-1 基因表达水平
各组培养24 h后去除培养基,按照Trizol法提取总RNA,检测纯度后,根据逆转录试剂盒操作说明逆转录合成cDNA,进行RT-qPCR 反应。根据GenBank 中基因序列设计PCR 引物,检测TNF-α、iNOS、IL-10、TGF-β 和Arg-1 基因的表达水平,以β-actin 为内参。PCR扩增条件:95 ℃预变性10 min;95 ℃变性15 s;60 ℃退火60 s,共40 个循环。每组设置3 个复孔,以2-△△Ct值表示目的基因的相对表达水平。RT-qPCR引物信息见表1。

表1 RT-qPCR各目的基因引物序列
1.4 对细胞迁移、侵袭及凋亡的影响
1.4.1 细胞迁移和侵袭试验
将处于对数生长期的RAW264.7细胞以3×105个/孔移植于无血清DMEM的6孔板中,根据分组加入不同试剂(终浓度800 µg/mL 的SPS-1 或/和终浓度20 ng/mL的IL-4),培养24 h 后收集上清,得到条件培养基(Conditioned medium,CM),备用。
实验分组:Control 组(Lewis 细胞)、CM0 组(SPS-1 + Lewis 细胞)、CM1 组(RAW264.7 + IL-4 的条件培养基 + Lewis细胞)、CM2组(RAW264.7 + SPS-1的条件培养基 + Lewis细胞)和CM3组(RAW264.7 + IL-4 +SPS-1 的条件培养基 + Lewis 细胞),处理24 h 后收集细胞开展迁移和侵袭试验。体外细胞的侵袭和迁移实验用24孔板Transwell小室进行检测。侵袭实验,在小室的上层铺100 µg 的基质胶。迁移实验不铺基质胶。并于Transwell 小室上室加入3×105个/mL 的Lewis 细胞200 µL,培养24 h 后吸弃培养液,小心擦掉小室上层没有发生侵袭或迁移的细胞,PBS 冲洗2 次后,10%甲醇固定30 min,5%结晶紫染色20 min 后进行拍照计数。
1.4.2 HIF-1α和VEGF-A的测定
将Lewis细胞按106个/mL接种于96孔细胞培养板中,加入不同培养基培养24 h,收集上清液,采用ELISA法检测HIF-1α和VEGF-A含量。
1.4.3 流式细胞术检测肿瘤细胞凋亡
实验分组同“1.4.1”,培养24 h 后收集6 孔板中Lewis 细胞,使用AnnexinV-APC/7-AAD 细胞凋亡检测试剂盒检测Lewis细胞凋亡。
1.4.4 免疫印迹试验
采用Western blot 技术检测肿瘤细胞转移和凋亡相关蛋白E-Cadherin(1∶5 000)、N-Cadherin(1∶2 000)、Vimentin(1∶2 000)、Bax(1∶1 000)、Bcl-2(1∶2 000)的表达水平,方法同“1.3.1”项,以目的蛋白条带与内参GAPDH(1∶1 000)蛋白条带的灰度值之比表示目的蛋白的相对表达水平。
1.5 统计学方法
实验重复3 次,实验结果采用均值±标准差(±s)表示。实验数据采用IBM SPSS 19.0进行统计分析,不同组间数据采用单因素方差分析(One-way ANOVA),并使用Origin 8.1 软件进行绘图。P<0.05为差异具有统计学意义。
2 结果
2.1 SPS-1 诱导RAW264.7 细胞由M2 表型向M1 表型极化
20 ng/mL IL-4 处理RAW264.7 细胞可增加膜表面分子CD206 和减少CD86 的表达,这表明形成了极化的M2 型巨噬细胞。在SPS-1 处理后,CD86/CD206 以剂量依赖性方式显著增加,SPS-1 浓度为400、800 µg/mL 时,CD86/CD206 比值较M2 组具有极显著差异(P<0.01)。结果见图1。与M1 表型相关的炎症因子TNF-α mRNA 的表达量升高,特异性M1 指标iNOS mRNA 的表达量也显著上调;与之相反,IL-10、TGF-β mRNA 及特异性M2 指标Arg-1 mRNA 的表达量则显著下调,与M2 组相比,差异具有统计学意义(P<0.05,P<0.01),见表2。综上,SPS-1 可诱导RAW264.7 细胞由M2 表型向M1 表型极化。
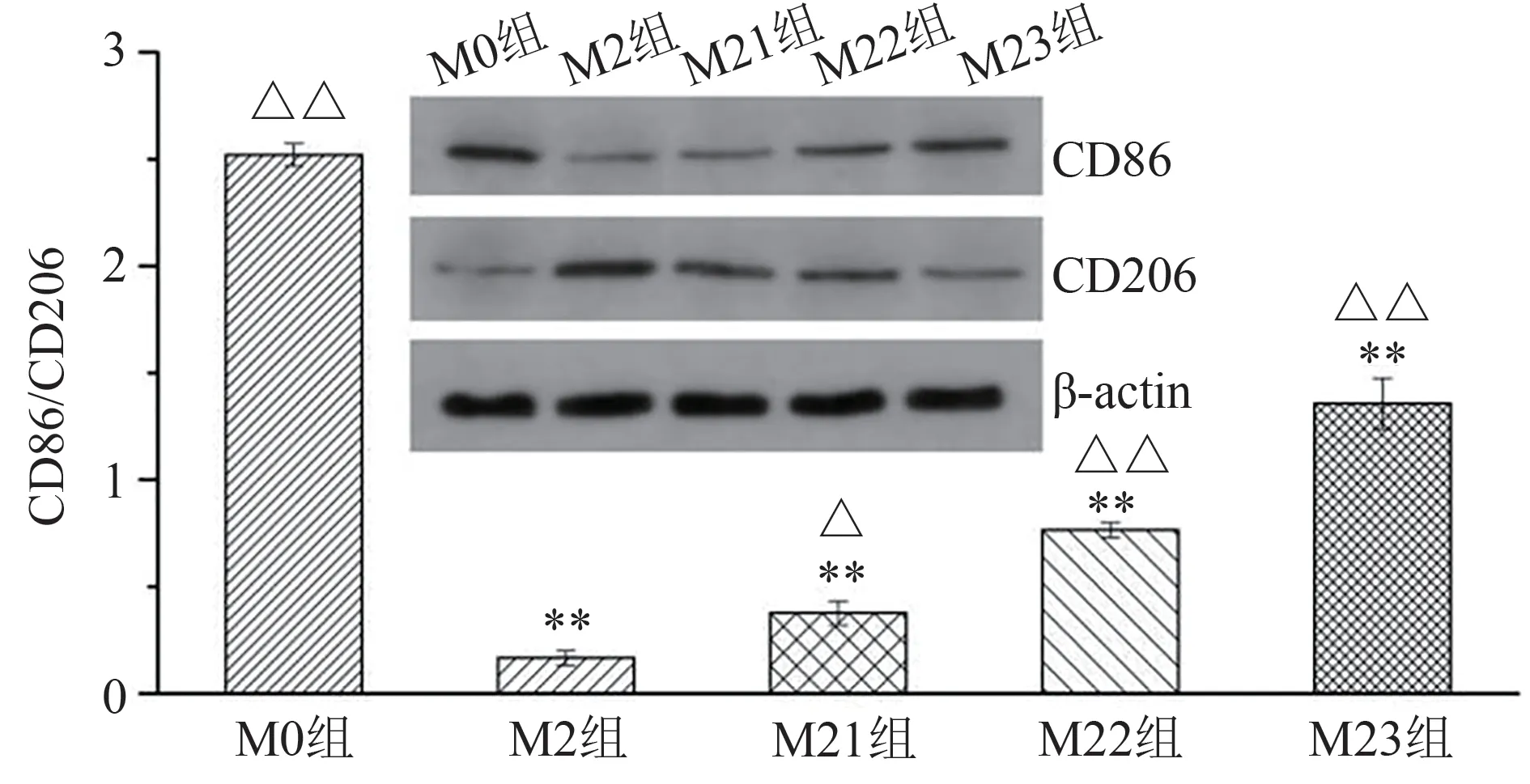
图1 SPS-1对RAW264.7细胞膜表面CD206和CD86蛋白表达的影响
表2 各组对RAW264.7巨噬细胞极化相关基因mRNA相对表达量的比较(±s)

表2 各组对RAW264.7巨噬细胞极化相关基因mRNA相对表达量的比较(±s)
注:与M0组比较,*P<0.05,**P<0.01;与M2组比较,△P<0.05,△△P<0.01。
组别M0组M2组M21组M22组M23组Arg-1 0.94±0.08 3.29±0.21**2.64±0.16**2.07±0.14**△△1.58±0.18△△TNF-α 1.03±0.12 0.39±0.06*0.84±0.06△△1.16±0.16△1.84±0.14*△△iNOS 1.02±0.15 0.49±0.04 0.89±0.08△1.30±0.13△1.91±0.04*△△IL-10 1.05±0.13 1.43±0.12 1.24±0.05 1.01±0.06 0.81±0.04△TGF-β 1.01±0.11 2.52±0.17**2.05±0.11**1.65±0.11*△1.38±0.13△△
2.2 SPS-1 调控M1/M2 巨噬细胞极化抑制Lewis 细胞的迁移与凋亡
SPS-1 调控M1/M2 巨噬细胞极化抑制Lewis 细胞的迁移与凋亡的实验结果见表3 和图2。共培养条件下,与对照组相比,CM0、CM2、CM3 组均可不同程度地降低Lewis细胞的迁移能力,与CM1组相比,CM0、CM2组均可极显著降低Lewis 细胞的迁移(P<0.01),CM3组也可显著或极显著的降低Lewis 细胞的迁移能力(P<0.05,P<0.01)。ELISA 和Western blot 实验结果显示,CM0、CM2、CM3 组均可显著或极显著的降低HIF-1α和VEGF的分泌及N-Cadherin和Vimentin的表达,而E-Cadherin 表达则极显著增加(P<0.01)。以上结果表明SPS-1 可通过诱导RAW264.7 细胞极化为M1 亚型抑制Lewis 细胞的迁移能力。流式细胞仪检测Lewis 细胞凋亡,与对照组和CM1 组相比,CM0、CM2、CM3 组共培养体系中,Lewis 细胞凋亡率明显增加(P<0.01)。进一步通过Western blot实验检测Lewis 细胞中凋亡相关蛋白Bcl-2 和Bax 的表达水平,结果显示经SPS-1 处理,可显著降低Lewis 细胞中抗凋亡蛋白Bcl-2 的表达及提高促凋亡蛋白Bax 的表达,以上结果表明,SPS-1 可诱导RAW264.7 细胞极化促进Lewis细胞的凋亡。
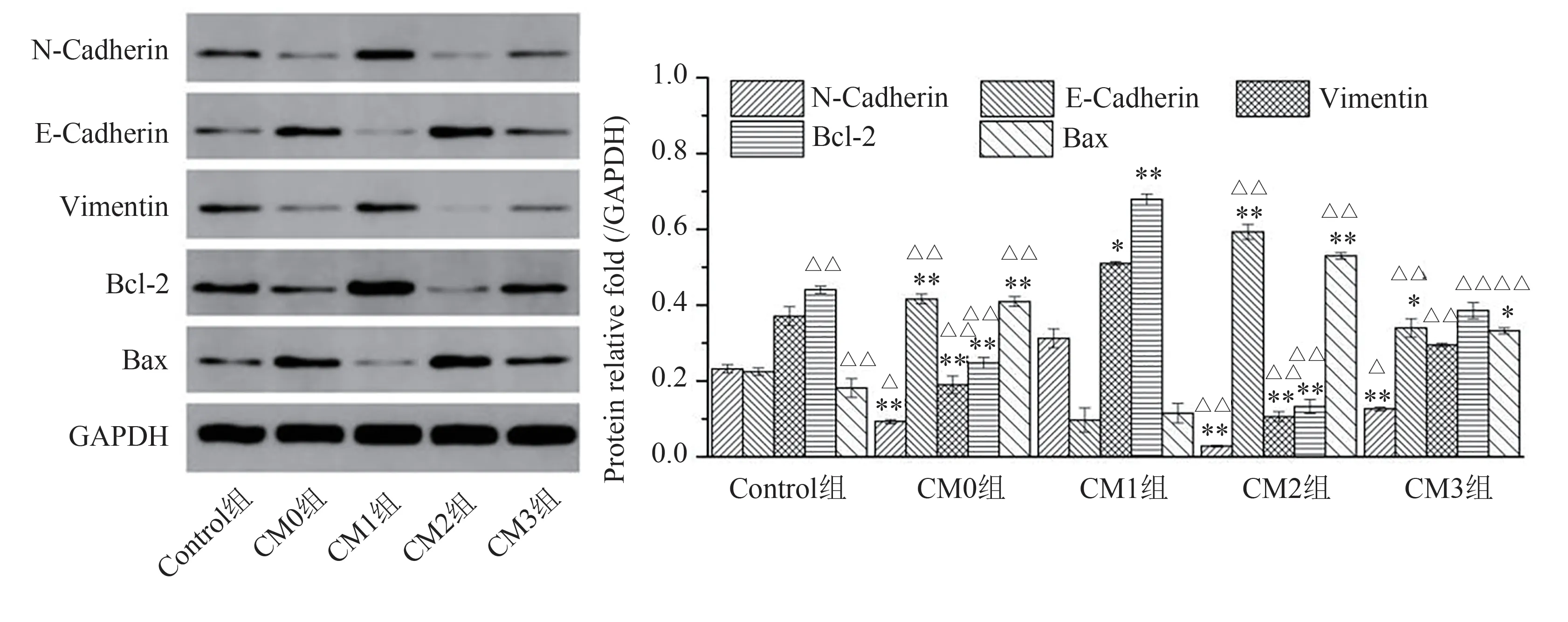
图2 共培养条件下SPS-1对Lewis细胞转移及凋亡相关蛋白表达的影响
表3 各组对Lewis细胞的抑制作用比较(±s)

表3 各组对Lewis细胞的抑制作用比较(±s)
注:与Control组比较,*P<0.05,**P<0.01;与CM1组比较,△P<0.05,△△P<0.01。
组别Control组CM0组CM1组CM2组CM3组凋亡指数4.13±0.12△△24.10±0.67**△△3.19±0.10**39.36±1.07**△△19.38±1.17**△△迁移率/%100.00±3.03 62.12±4.01**△△128.28±7.63 40.40±1.75**△△85.35±3.15*△侵袭率/%100.00±2.29△△55.00±2.29**△△121.50±3.97*35.00±1.73**△△90.00±2.60*△△HIF-1α/(pg/mL)575.20±43.75△△287.03±18.96*△△868.79±35.87**186.19±11.58*△△477.54±34.59△△VEGF/(pg/mL)229.96±25.66△△112.78±11.94*△333.59±30.52 62.58±6.79*△188.57±20.51△
3 讨论
非小细胞肺癌(NSCLC)是肺癌的主要类型,约占肺癌的85%~90%[11]。目前免疫治疗、靶向治疗等新的治疗方法已引入到NSCLC 治疗中[12]。作为肿瘤组织中主要的免疫调节细胞,肿瘤相关巨噬细胞在肿瘤的免疫反应中发挥重要作用[13]。但是,巨噬细胞存在着高度异质,会在局部微环境刺激下从M0 阶段极化到不同的亚型即M1和M2型,显示完全相反的功能。
在肿瘤发生、发展过程中,肿瘤相关巨噬细胞的极化普遍存在,M1 型和M2 型巨噬细胞在表型、标记物、精氨酸代谢和对肿瘤的影响方面存在差异。M1 型巨噬细胞是典型激活的促炎性细胞因子(TNF-α、IL-1β、IL-6)的统称,其细胞膜分子CD40、CD80 和CD86等表达增加[14]。M2 型巨噬细胞表现出更高的甘露糖受体(CD206)转录表达,并通过分泌抑制性细胞因子IL-10、TGF-β 等下调免疫应答,减少促炎细胞因子的产生[15]。它们也可以根据精氨酸代谢相互区分,其中M1 型巨噬细胞优先通过诱导型一氧化氮合酶(iNOS)将精氨酸代谢为NO,而M2 样巨噬细胞优先通过精氨酸酶-1(Arg-1)将精氨酸代谢为鸟氨酸[16]。本研究发现血满草多糖(SPS-1)能促进M1 型巨噬细胞极化,上调其特征标记CD86、下调清道夫受体CD206 表达。SPS-1 处理的RAW264.7 细胞具有浓度依赖的TNF-α、iNOS mRNA 水平升高及IL-10、TGF-β、Arg-1 mRNA 水平降低,可显著诱导RAW264.7细胞由M2型向M1型极化。
抑制肿瘤的侵袭和迁移能力是药物发挥抗癌作用的一个重要因素。血管的生成在肿瘤生长和转移过程中发挥着重要的作用[17],可以促进肿瘤细胞的快速生长,从而进一步加速实体肿瘤的发生、侵袭和转移[18]。HIF-1α 通过活化上调P13K/Akt 信号通路在转录水平介导VEGF 蛋白表达。VEGF 是一种血管生成因子,参与许多生理和病理过程,其意义与促进肿瘤生长和转移有关[19]。缺氧也会引发上皮-间质转化(EMT),EMT 是原发性肿瘤转移进展的重要生物学机制,它的主要变现是极性的上皮细胞转换为活动能力强的间质细胞并获得侵袭和迁移能力[20]。上皮标志物如ECadherin 等表达下调、间充质细胞标志物Vimentin 和N-Cadherin 表达的增加是EMT 表型改变的主要特征,这导致EMT过程的发生,导致转移的起始[21-23]。本研究的Transwell 实验结果表明,共培养条件下,SPS-1 通过调控RAW264.7 细胞极化显著抑制Lewis 细胞的侵袭和迁移,并降低HIF-1α和VEGF的分泌及NCadherin 和Vimentin 的表达,同时显著上调ECadherin 的表达,从而起到抑制Lewis 细胞转移的作用。凋亡实验结果显示,SPS-1 亦可通过调控RAW264.7细胞极化显著促进Lewis细胞的凋亡。
4 结论
SPS-1 可促进巨噬细胞M1 型极化并通过调控巨噬细胞极化抑制Lewis细胞的转移及促进其凋亡。
