紫罗兰基因组DNA 快速提取方法的研究
2023-10-28张海梅陈道宗谭晨
张海梅, 陈道宗, 谭晨
(赣南师范大学 生命科学学院, 江西 赣州 341000)
紫罗兰 [Matthiolaincana(L.) R.Br.] 是十字花科紫罗兰族紫罗兰属植物, 原产于欧洲大陆地中海沿岸, 其花色丰富、花量大、花期长、株型多样、耐低温、应用场景多样[1-2], 是一种市场前景良好的观赏植物。目前, 紫罗兰的优良品种主要依赖进口, 国产优良品种极少。因此, 国产紫罗兰新品种的培育亟待加强。
紫罗兰的现代化遗传育种研究离不开基因组DNA 的提取, 比如分子标记定位、分子标记辅助选择、遗传多样性研究等。根据研究目的不同, 对基因组DNA 的质量和数量要求也不同, 常用的DNA 基因组的提取方法有十六烷基三甲基溴化铵法 (CTAB 法)[3-4]、十 二 烷 基 苯 磺 酸 钠 (SDS)法[5-6]、碱 处 理 法[7]、高 温 水 煮 法[8-9]等, 其 中,CTAB 法因其提取的DNA 产量高、纯度好而被广泛使用, 但其提取过程繁琐、耗时耗力, 且用到了氯仿等有毒有害试剂, 不能满足育种实践中大样本量的实验需求。现已报道了在拟南芥、水稻、玉米、小麦等植物中的快速基因组提取方法[9-14], 可以用于大规模基因组DNA 的提取。
借鉴已有的快速提取植物基因组DNA 的方法[8-10], 本研究对高温水煮法进行了简化处理, 建立了一种适用于紫罗兰基因组DNA 快速提取的方法 (即快速法), 可以简单、快速地大规模提取可高效扩增的紫罗兰基因组DNA, 为紫罗兰分子育种奠定了基础。
1 材料与方法
1.1 实验材料
本研究所用材料有和谐系列紫罗兰色紫罗兰(样品1)、辉煌系列桃粉色紫罗兰 (样品2) 和凯斯系列紫色紫罗兰 (样品3), 3 个实验材料均在植物光照培养箱种植 (温度: 23 ℃; 光照: 16 h;黑暗: 8 h), 播种后约3 周取幼嫩的真叶为实验材料。
1.2 紫罗兰基因组DNA 提取方法
1.2.1 CTAB 法
取0.1 g 新鲜的叶片于2.0 mL 离心管中, 加600 μL 2% CTAB 提取液 [NaCl 81.9 g, Tris-HCl(1.0 mol·L-1, pH 值 为8.0) 100 mL, EDTA(0.5 mol·L-1, pH 值为8.0) 40 mL 和20 g CTAB定容至1 000 mL] 充分研磨; 于65 ℃水浴锅中水浴60 min, 每10~15 min 轻轻摇晃一次; 冷却后加入600 μL 体积比为24 ∶1 的氯仿/异戊醇, 轻轻摇匀, 12 000 r·min-1离心10 min; 吸取300 mL上清液于1.5 mL 的离心管中, 加600 μL 的冰乙醇,-20 ℃静置30 min, 12 000 r·min-1离心5 min, 弃上清; 加500 μL 75%的乙醇漂洗, 12 000 r·min-1离心5 min, 重复3 次, 弃上清, 晾干; 加100 μL 1% RNA 酶溶液溶解, 置于37 ℃恒温箱中1 h 以上, 其间时常摇晃, 测其浓度以及用琼脂糖凝胶电泳检查基因组DNA。
1.2.2 高温水煮法
参照许明等[9]介绍方法, 并作部分改动。取0.1 g 新鲜的叶片于2.0 mL 离心管中, 加600 μL DNA 提 取 缓 冲 液 (100 mmol·L-1Tris, pH 值 为8.0; 50 mmol·L-1EDTA; 500 mmol·L-1NaCl)充分研磨; 沸水煮10 min, 12 000 r·min-1离心10 min; 吸取300 μL 上清液于1.5 mL 的离心管中, 加600 μL 的冰乙醇, -20 ℃静置30 min,12 000 r·min-1离心5 min, 弃上清; 加500 μL 75%的乙醇漂洗, 12 000 r·min-1离心5 min, 重复3次, 弃上清, 晾干; 加100 μL 1% RNA 酶溶液溶解, 置于37 ℃恒温箱中1 h 以上, 期间时常摇晃,测其浓度以及用琼脂糖凝胶电泳检查所提DNA。
1.2.3 快速法
取0.1 g 新鲜的叶片于2.0 mL 离心管中, 加600 μL DNA 提取缓冲液 (100 mmol·L-1Tris, pH值为8.0; 50 mmol·L-1EDTA; 500 mmol·L-1NaCl) 充分研磨; 沸水煮10 min, 12 000 r·min-1离心10 min; 吸取100 μL 上清液于1.5 mL 的离心管中, 稀释20 倍, 即可用作PCR 反应的DNA模板。
1.3 DNA 质量检测方法
1.3.1 DNA 浓度及纯度测定
用超微量分光光度计 (Nanodrop 2 000 C) 测定提取的紫罗兰基因组DNA 的浓度和光谱数据。
1.3.2 琼脂糖凝胶电泳检测
CTAB 法和高温水煮法提取的紫罗兰基因组DNA, 样品1、样品2 和样品3 各取4 μL, 加2 μL Loading buffer, 用1%的琼脂糖凝胶电泳, 通过凝胶成像仪观测结果。
1.3.3 PCR 扩增
采用10 μL 的反应体系进行PCR 扩增, 反应体系中: 2×Taqmaster mix (Vazyme) 5 μL、DNA 模板DNA (约50 ng·μL-1) 2 μL、紫 罗 兰 内 参 基 因Actin引物[15]上游引物 (5′-GTGAGATACACCATCAC CAGAATC-3′) 和 下 游 引 物 (5′-TAAAGTATCCAA TCGAGCATGGTA-3′) 各0.5 μL (10 μmol·L-1),ddH2O 2 μL。扩增体系为: 95 ℃预变性5 min;94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸30 s,35 个循环; 最后72 ℃延伸10 min。PCR 产物在1%琼脂糖凝胶电泳, 凝胶成像仪下观测结果并拍照。
2 结果与分析
2.1 高温水煮法提取的DNA 产量和纯度分析
为了探究高温水煮法提取的紫罗兰DNA 产量和纯度, 以CTAB 法为对照进行了比较, 两种方法提取的紫罗兰基因组DNA 的浓度和光谱数据如表1 所示, 尽管实验组高温水煮法提取的DNA 浓度显著低于对照组CTAB 法提取的 (P<0.05), 但其浓度也均大于1 000 ng·μL-1, 平均达到1 982.3 ng·μL-1, 能够满足一般分子生物学实验要求。超微量分光光度计检测结果显示, 对照组CTAB 法提取的紫罗兰基因组DNA 的D260/D280均大于1.8,D260/D230均在2.00~2.20, 说明DNA 纯度高。高温水煮法提取的DNA 光谱数据与对照组相当, 表明所获得的DNA 没有蛋白质或酚类物质的影响,也没有碳水化合物、盐 (胍盐) 等污染物。
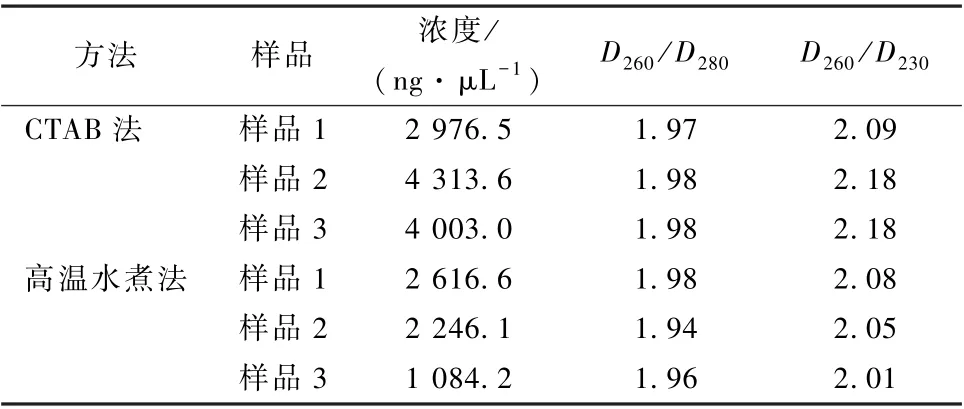
表1 紫罗兰基因组DNA 检测结果
2.2 DNA 质量分析
将提取的紫罗兰基因组DNA 进行琼脂糖凝胶电泳检测, 结果如图1 所示。从图中可以看出, 对照组CTAB 法提取的紫罗兰基因组DNA 中, 条带清晰, 无明显拖带现象, 表明DNA 完整性较好。实验组高温水煮法提取的DNA 中, 条带4 和5 明亮清晰, 表明DNA 浓度较高; 无明显拖带现象,表明完整性好; 条带6 较暗, 可能是DNA 浓度较低, 与表1 浓度结果一致, 也无明显拖带现象, 表明完整性也较好。因此, 高温水解法提取的基因组DNA 完整性与对照组CTAB 法相当。
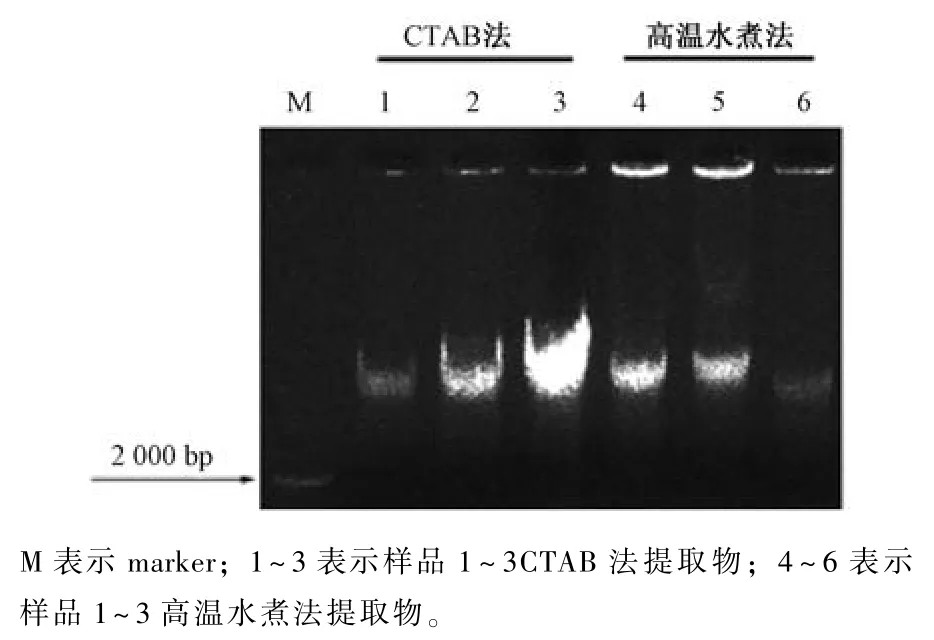
图1 CTAB 法与高温水煮法提取物琼脂糖凝胶电泳检测结果
2.3 PCR 分析
将提取的紫罗兰基因组DNA 稀释至50 ng·μL-1后, 采用紫罗兰内参基因Actin引物进行PCR扩增, PCR 产物的琼脂糖凝胶电泳结果如图2 所示。从图中可以看出, 实验组高温水煮法和对照组CTAB 法提取的DNA 的PCR 扩增结果相同, 电泳条带均清晰、稳定, 条带大小均在250~500 bp,与预期片段大小一致, 表明高温水煮法提取的DNA 成功用于PCR 反应。
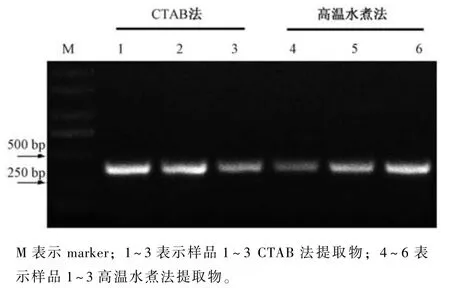
图2 CTAB 法与高温水煮法提取DNA 的PCR 扩增结果
以上结果表明, 与对照组CTAB 法相比, 实验组高温水煮法能够获得产量足够, 且质量相当的紫罗兰基因组DNA。此外, 在操作步骤上, 高温水煮法只需沸水浴10 min 后即可进行后续的离心、吸上清液、沉淀、漂洗等步骤, 而CTAB 法则需要水浴 (65 ℃) 60 min 后加入氯仿/异戊醇溶液后再进行离心、吸上清液、沉淀、漂洗等步骤 (详见实验方法)。因此, 与对照组CTAB 法相比, 实验组高温水煮法操作更简单、所需时间更短, 且无需使用有毒有害的试剂, 产生的废液也更少。
2.4 快速法提取DNA 的PCR 扩增效果
为了建立更加简洁、高效的基因组DNA 提取方法, 对高温水煮法进行了进一步简化, 整个提取过程大概耗时30 min, 称为快速法。快速法主要是减少了DNA 提取过程中的沉淀和漂洗环节, 这样势必会降低DNA 的纯净度, 超微量分光光度计检测结果也证实了这一点 (表2), 即D260/D230均很小, 表明溶液中还有较多的碳水化合物、盐类或有机化合物, 但其浓度较高 (平均1 171.3 ng·μL-1)。因此, 将其稀释20 倍后再作为DNA 模板进行PCR 扩增, 这样既降低了杂质的含量, 又可以使DNA 浓度达到PCR 模板的要求。随后, 以快速法提取的DNA 的20 倍稀释液为模板来扩增内参基因Actin的片段, 并用CTAB 法提取的DNA 为对照, PCR 产物的琼脂糖凝胶电泳如图3 所示。结果表明, 快速法提取的DNA 稀释液作模板能扩增出与对照组一致的清晰稳定的条带, 且条带大小符合预期 (250~500 bp)。说明用快速法提取紫罗兰基因组DNA 稀释20 倍后能很好地满足一般PCR反应的需求。
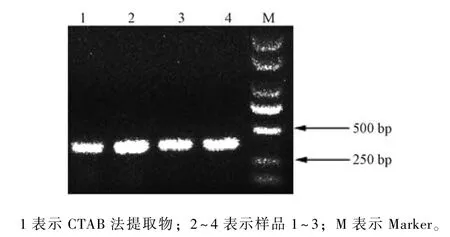
图3 DNA 稀释20 倍后的PCR 扩增结果

表2 快速法提取紫罗兰基因组DNA 原液检测结果
2.5 快速法提取DNA 的保存时间
为了探究快速法提取的DNA 的保存时间, 将在-20 ℃冰箱保存了3 个月后的DNA 原液稀释20倍后进行PCR 扩增, 结果显示, 其仍然可扩增出清晰可见的条带 (图4)。表明快速法提取的紫罗兰基因组DNA 在-20 ℃下至少能够保存3 个月,完全能够满足一般分子实验的周期要求。
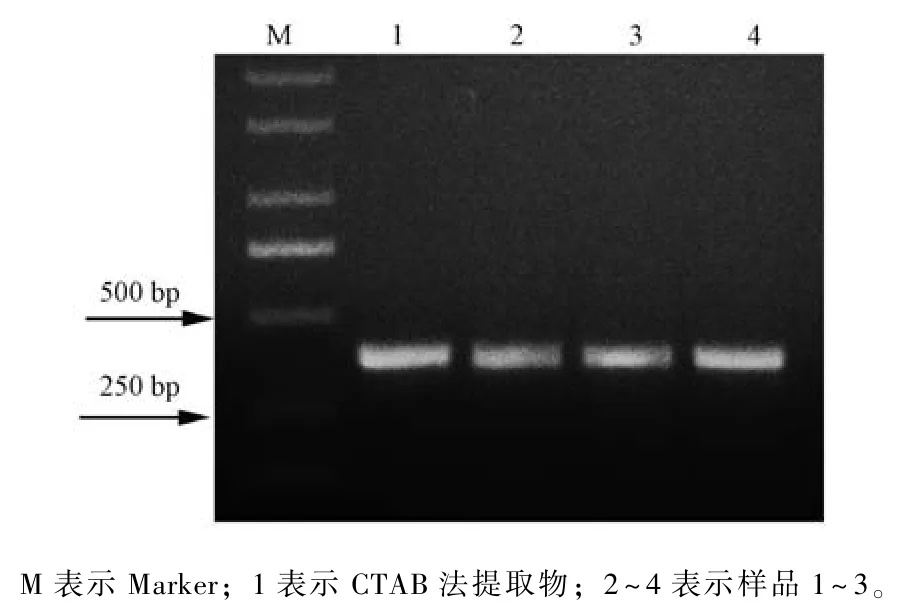
图4 保存3 个月后DNA 稀释20 倍的PCR 扩增结果
3 讨论
CTAB 法是抽提基因组DNA 最常用的方法,该方法提取的DNA 产量高、纯度好[4]; 但其提取过程中使用了有毒有害试剂氯仿等, 且抽提过程需在通风橱中进行, 提取过程操作繁琐、耗时较长。而高温水煮法提取DNA 过程中没有用到有毒有害的试剂, 且提取过程耗时相对较短, 因此, 该方法可用于对DNA 纯度要求不高的实验中, 用其来取代CTAB 法中对人体有害的试剂的提取方法[9-10]。本研究中, 以CTAB 法为对照, 比较了高温水煮法提取紫罗兰基因组DNA 的产量和质量, 结果表明,高温水煮法提取的DNA 产量低于CTAB 法, 但质量相当。因此, 可以用无危险试剂、操作简单的高温水煮法来替代有危险试剂、操作繁琐的CTAB 法提取紫罗兰基因组DNA。
进一步, 本研究简化了高温水煮法, 即舍弃沉淀和漂洗的过程, 建立了快速法, 缩短了提取的时间, 操作步骤简单、耗时少。提取紫罗兰基因组DNA 稀释20 倍后, PCR 扩增结果与CTAB 法提取的DNA 扩增结果一致。快速法在高温水煮法的基础上减少了沉淀和漂洗的过程, 缩短了提取的时间, 操作步骤简单、耗时少, 可大幅节约时间, 提高工作效率[12-13]; 也减少了试剂的使用, 节约成本。此外, 快速法提取的紫罗兰基因组DNA 保存时间较久, 可以满足一般实验周期的要求。因此,快速法特别适用于样本量大的基因型鉴定类的实验, 如分子标记辅助选择育种、转基因阳性苗鉴定等; 此外, 利用高通量磨样机、96 孔板及相关配套设备等可实现规模化的DNA 提取[14]。
