贝伐珠单抗与安罗替尼分别联合化疗药用于EGFR-TKI获得性耐药晚期肺腺癌的临床观察Δ
2023-10-28齐彦宇熊婷婷张军汪汉周从明蒋莎莎成都市第三人民医院肿瘤科成都60404四川省妇幼保健院四川省妇女儿童医院成都医学院附属妇女儿童医院临床药学科成都600成都市第三人民医院心血管内科成都60404
齐彦宇 ,熊婷婷 ,张军 ,汪汉 ,周从明 #,蒋莎莎 (.成都市第三人民医院肿瘤科,成都 60404;.四川省妇幼保健院/四川省妇女儿童医院/成都医学院附属妇女儿童医院临床药学科,成都 600;.成都市第三人民医院心血管内科,成都 60404)
近年来,我国肺癌的发病率和病死率均呈增长趋势,居恶性肿瘤第一位。肺癌患者早期症状不典型,多数患者就诊时已为中晚期,失去了手术根治的机会,需要多学科综合治疗,但效果仍然较差,五年生存率仅为20%左右[1]。肺腺癌是非小细胞肺癌(non-small-cell lung cancer,NSCLC)的一种分型,是肺癌最常见的病理类型,占肺癌患者总数的40%~45%[2]。目前晚期肺腺癌患者多选择放化疗、靶向治疗及免疫治疗,其中以铂类药物为基础的化疗方案常作为首选或靶向治疗耐药后的优选方案。
表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶信号通路是肺腺癌靶向治疗最经典的通路之一,45%~50%的肺腺癌患者伴有EGFR基因外显子19缺失或外显子21突变[3]。虽然EGFR酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitors,EGFRTKI)能有效针对上述靶点进行治疗,具有效果好、不良反应少及有助于延长生存期等特点,已成为EGFR突变阳性中晚期NSCLC患者首选的一线治疗方案,经过一段时间EGFR-TKI治疗后,会出现靶向信号通路的旁支形成或其他信号通路产生,造成靶向药物耐药,而致患者病情进展[4]。对于EGFR-TKI获得性耐药、病情进展且未检测到新的靶向药物治疗突变位点的晚期NSCLC患者,《非小细胞肺癌诊疗指南2022》推荐使用含铂方案联合化疗(肺腺癌首选培美曲塞联合铂类药物)或联合贝伐珠单抗化疗(非鳞癌患者)。
恶性肿瘤细胞的增殖主要依靠周围血管生成为其提供营养和能量支持,因此阻断肿瘤血管生成是抑制恶性肿瘤生长的主要方法之一。单克隆抗体贝伐珠单抗和小分子靶向药物安罗替尼是近年来临床应用较多的抗血管生成药物。贝伐珠单抗是人源化的血管内皮生长因子(vascular endothelial growth factor,VEGF)受体单克隆抗体,可与VEGF结合来阻止VEGF同血管内皮细胞表面的VEGF受体结合,从而发挥抗血管生成作用[5—6]。安罗替尼是多靶点TKI,能有效抑制血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)、血小板衍生生长因子受体(plateletderived growth factor,PDGF)、成纤维生长因子受体、干细胞生长因子受体等激酶的活性,进而发挥抗肿瘤血管生成和抑制肿瘤细胞生长的作用[7]。目前,已有研究肯定了安罗替尼在晚期NSCLC三线治疗中的疗效[8]。而该药用于晚期肺腺癌二线治疗的大型多中心临床对照研究较少,因此,对于该药是否可推荐用于临床二线治疗,尚需更多的前瞻性临床研究证实。为此,本研究比较了贝伐珠单抗和安罗替尼分别联合化疗药用于EGFR- TKI获得性耐药晚期肺腺癌的疗效和安全性,以期为临床用药提供参考。
1 资料与方法
1.1 纳入与排除标准
本研究的纳入标准包括:(1)病理组织标本基因检测示EGFR19Del或L858R位点突变阳性;(2)EGFRTKI一线治疗获得性耐药后病情进展;(3)未曾接受全身化疗,且二次基因检测示T790M位点突变阴性;(4)功能状态(Karnofsky performance status,KPS)评分≥70分;(5)有1个或多个可测量病灶,预计生存期>3个月;(6)无化疗及靶向治疗绝对禁忌证。
本研究的排除标准包括:(1)有咯血史者;(2)出现中枢神经系统转移者;(3)凝血功能异常者;(4)合并有严重肝肾疾病者;(5)出现蛋白尿者;(6)高血压未得到有效控制者。
1.2 资料来源
回顾性分析2019年6月-2021年10月在成都市第三人民医院治疗的84例EGFR-TKI获得性耐药晚期肺腺癌患者资料,按用药的不同分为化疗组(32例)、安罗替尼联合化疗组(24例)和贝伐珠单抗联合化疗组(28例),3组患者的年龄、性别、吸烟史等基本资料比较,差异均无统计学意义(P>0.05),具有可比性,结果见表1。本研究方案经成都市第三人民医院医学伦理委员会批准,伦理受理编号:成都三院伦[2021]-S-136。

表1 3组患者的基本资料比较(例)
1.3 治疗方法
化疗组患者给予的具体用药方法如下:每周期第1天静脉输注注射用培美曲塞二钠[江苏豪森药业集团有限公司,国药准字H20051288,规格0.2 g(以培美曲塞计)]500 mg/m2+卡铂注射液(齐鲁制药有限公司,国药准字H20020180,规格10 mL∶100 mg)(用药剂量以药-时曲线下面积=5计),每3周为1个周期。患者自化疗前1周口服多维元素片(29)(惠氏制药有限公司,国药准字H10950026),每日1次,每次1片,至化疗结束;化疗前1周肌内注射维生素B12注射液(哈药集团三精制药有限公司,国药准字H23021687,规格1 mL∶0.25 mg)1 mg,每3个周期用药1次;化疗前1 d口服醋酸地塞米松片(天津力生制药股份有限公司,国药准字H12020122,规格0.75 mg)5片,每日2次,连续服用3 d。针对化疗中和化疗后可能出现的消化道不良反应给予5-羟色胺受体拮抗剂、激素、神经激肽-1受体(neurokinin-1 receptor,NK-1)阻断剂等;针对中性粒细胞减少症给予重组人粒细胞集落刺激因子或巨噬细胞集落刺激因子;针对血小板减少给予重组人白介素-11。
安罗替尼联合化疗组患者在化疗组用药的基础上,于化疗第1天口服盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司,国药准字H20180002,规格按安罗替尼计10 mg)10 mg,每日1次,连续用药14 d,停药7 d,每3周为1个周期。
贝伐珠单抗联合化疗组患者在化疗组用药的基础上,于化疗前1 d给予贝伐珠单抗注射液[德国Roche Diagnostics GmbH,国药准字SJ20170035,规格100 mg(4 mL/瓶)]15 mg/kg,静脉滴注(第1次静脉滴注时间应持续90 min,之后可缩短至60 min),每3周为1个周期。
3组患者的总疗程为4个周期。两个联合化疗组患者在完成4个周期治疗后,继续给予相应的抗血管生成药物维持治疗,即安罗替尼联合化疗组患者使用安罗替尼维持治疗,贝伐珠单抗联合化疗组患者使用贝伐珠单抗维持治疗,均至患者疾病进展(progressive disease,PD)或者死亡。
1.4 疗效评价标准
3组患者均在治疗2个、4个周期后分别进行一次影像学评估,以评估疗效。按照《实体瘤疗效反应评价标准》(RECIST)1.1版,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和PD[9]。疾病控制率(disease control rate,DCR)=(CR例数+PR例数+SD例数)/总例数×100%;总有效率(overall response rate,ORR)=(CR例数+PR例数)/总例数×100%。CR、PR、SD均以治疗4个周期时的疗效评估结果计。
1.5 观察指标
记录患者的中位无进展生存期(median progressionfree survival,mPFS),mPFS指治疗开始至病灶出现进展或患者死亡的时间。观察治疗前及治疗4个周期后患者血清中肿瘤标志物[VEGF、癌胚抗原(carcinoma embryonic antigen,CEA)、神经元特异性烯醇化酶(neuronspecific enolase,NSE)]水平。3组患者均随访1年,统计患者的1年生存率。
1.6 不良反应评价标准
按照美国国家癌症研究中心制定的《常见不良事件评价标准5.0》(CTCAE 5.0)进行评价,分为Ⅰ~Ⅴ级[10]。
1.7 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计数资料以例数或%表示,采用χ2检验;计量资料以±s表示,采用t检验;使用Kaplan-Meier法绘制生存曲线。检验水准α=0.05。
2 结果
2.1 3组患者的近期临床疗效比较
治疗4个周期后,两个联合化疗组患者的ORR和DCR均显著高于化疗组,且安罗替尼联合化疗组患者的DCR显著高于贝伐珠单抗联合化疗组(P<0.05)。结果见表2。

表2 3组患者的近期临床疗效比较[例(%)]
2.2 3组患者的mPFS比较
安罗替尼联合化疗组患者的mPFS为8.2个月,贝伐珠单抗联合化疗组患者的mPFS为7.2个月,均显著长于化疗组(5.8个月)(P<0.05);两个联合化疗组患者的mPFS比较,差异无统计学意义(P>0.05)。结果见图1。
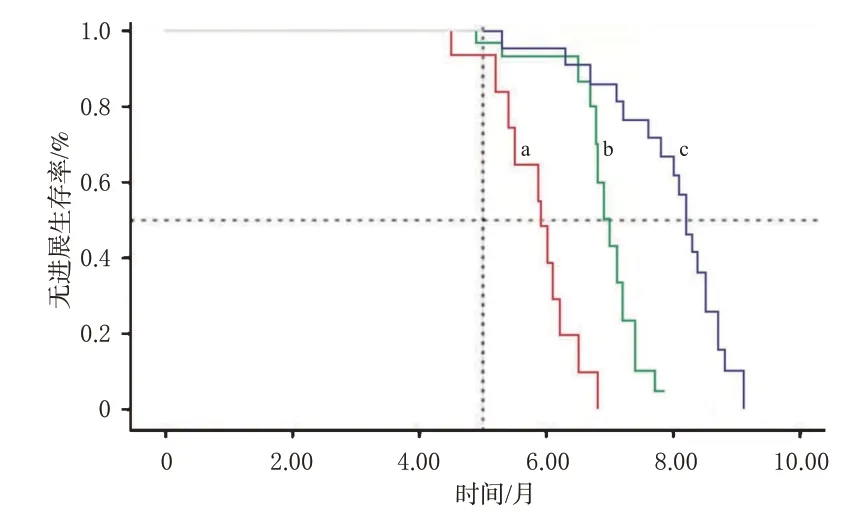
图1 3组患者的Kaplan-Meier生存曲线
2.3 3组患者治疗前后血清中肿瘤标志物水平比较
治疗前,3组患者血清中肿瘤标志物水平比较,差异均无统计学意义(P>0.05)。治疗4个周期后,3组患者血清中肿瘤标志物水平均显著低于同组治疗前,且两个联合化疗组均显著低于化疗组(P<0.05);两个联合化疗组患者血清中肿瘤标志物水平比较,差异均无统计学意义(P>0.05)。结果见表3。
表3 3组患者治疗前后血清中肿瘤标志物水平比较(±s,µg/L)

表3 3组患者治疗前后血清中肿瘤标志物水平比较(±s,µg/L)
a:与同组治疗前比较,P<0.05;b:与化疗组比较,P<0.05。
组别化疗组安罗替尼联合化疗组贝伐珠单抗联合化疗组n VEGF治疗前654.2±45.2 677.4±57.1 669.1±76.5 CEA治疗前68.2±8.2 72.3±4.5 66.5±6.1治疗后27.3±3.8a 22.5±6.2ab 25.2±3.5ab 32 24 28治疗后441.5±25.4a 324.2±71.3ab 358.3±54.6ab治疗后24.4±6.2a 9.2±5.1ab 12.1±7.4ab NSE治疗前37.5±4.5 41.2±5.6 42.7±6.2
2.4 3组患者的不良反应发生率比较
3组患者的主要不良反应包括恶心呕吐、骨髓抑制、肝肾功能异常和口腔溃疡等,多为Ⅰ~Ⅱ级,各不良反应发生率组间比较,差异均无统计学意义(P>0.05)。结果见表4。

表4 3组患者的不良反应发生率比较[例(%)]
2.5 3组患者随访1年后的生存率比较
随访1年,3组共有5例患者死亡,其中化疗组2例、安罗替尼联合化疗组1例、贝伐珠单抗联合化疗组2例,1年生存率分别为93.8%、95.8%、92.9%,3组患者的1年生存率比较,差异无统计学意义(P>0.05)。
3 讨论
晚期肺癌精准治疗技术的发展、多种癌驱动基因的发现和确定,以及具有相应基因突变位点靶向药物的研发上市,明显改善了NSCLC患者的预后,提高了生存率,延长了生存期[11]。多项随机对照研究显示,与化疗药物比较,EGFR突变阳性晚期NSCLC患者使用靶向药物一线治疗可显著延长患者的中位生存期,降低Ⅲ级以上不良反应的发生率[12—13]。但靶向药物治疗后大部分患者会出现获得性耐药,对于出现靶向药物耐药后的治疗,除病灶进展缓慢或寡转移可继续使用靶向药物联合局部治疗外,若基因检测未查到新的治疗靶点时,化疗仍是目前的经典方案,同时也可联合抗血管生成药物等手段,但不建议继续使用EGFR-TKI[14]。然而,临床实践中发现,EGFR-TKI耐药患者给予含铂双药化疗后,其DCR为20%~40%,mPFS为4~6个月。因此,寻求更为有效的治疗方法是临床研究的难点。
有研究发现,VEGF是肺癌血管生成的关键调节因子,可激活EGFR通路引起VEGF产生和VEGFR激活。EGFR-TKI耐药的发生与机体VEGF的高表达密切相关,EFGR-TKI能通过阻止EGFR通路来直接抑制肿瘤细胞生长,阻断VEGF下游信号通路,从而抑制血管生成,因此,化疗药联合抗血管生成药物用于EGFR-TKI耐药患者,能够抑制肿瘤细胞生长,控制疾病进展[15—16]。抗血管生成药物联合含铂化疗方案已成为中晚期驱动基因靶向治疗耐药后晚期肺腺癌患者的优选治疗方案,该方案不仅抗肿瘤效果良好,不良反应可控,还可延缓耐药,打破了晚期肺腺癌单纯化疗疗效的局限和瓶颈[17—18]。一项比较卡铂+紫杉醇+贝伐珠单抗与单纯化疗用于复发性或晚期肺腺癌患者的大型Ⅲ期多中心临床研究结果显示,卡铂+紫杉醇+贝伐珠单抗组患者较单纯化疗组的中位总生存期(12.3个月vs.10.3个月,P=0.003)显著延长,死亡风险下降21%,mPFS(6.2个月vs.4.5个月,P<0.001)也显著延长[19]。一项安罗替尼的Ⅲ期临床研究(ALTER0303)结果显示,与安慰剂比较,安罗替尼能够显著延长非鳞NSCLC患者的中位生存期(9.6个月vs.6.3个月,P=0.001 8)和mPFS(5.37个月vs.1.40个月,P<0.001),死亡风险下降32%,表明安罗替尼可作为多线化疗失败及难治性NSCLC患者新的治疗选择[20]。
本研究结果显示,两个联合化疗组患者的ORR和DCR均显著高于化疗组,且安罗替尼联合化疗组患者的DCR显著高于贝伐珠单抗联合化疗组。从机制上推测,这可能与安罗替尼的多靶点作用机制有关——安罗替尼可同时阻断肿瘤细胞的多个信号传导通路[21—22]。本研究结果还显示,治疗4个周期后,3组患者血清中肿瘤标志物水平均显著低于同组治疗前,且两个联合化疗组均显著低于化疗组,这表明抗血管生成药物联合化疗可增强化疗药物抑制恶性肿瘤侵袭水平及转移能力,治疗效果与肿瘤标志物变化具有一定的相关性[23—24]。安全性方面,3组患者的不良反应多为Ⅰ~Ⅱ级,患者基本都能耐受,恶心呕吐、骨髓抑制等不良反应发生率比较,差异均无统计学意义,这与相关研究结果一致[25]。此外,虽然安罗替尼单药已获批用于晚期NSCLC患者的三线治疗,但获益不高,且大多数患者的一般情况较差,联合化疗的副作用已不能耐受。而本研究中,安罗替尼联合化疗用于二线治疗时患者的一般情况尚可,可耐受相关副作用,可达到协同增效的作用。安罗替尼除具有抑制肿瘤血管生成作用外,还能抑制PDGF、成纤维生长因子受体、干细胞生长因子受体等激酶的活性,其疗效并不劣于贝伐珠单抗[26]。加之安罗替尼为口服给药,使用更加方便,其联合化疗可作为EGFR-TKI耐药患者的一种安全、方便、有效的治疗方案。
综上所述,贝伐珠单抗与安罗替尼分别联合化疗药用于EGFR-TKI获得性耐药晚期肺腺癌的疗效和安全性均较好。但本研究为回顾性分析,纳入的样本量较小,故所得结论尚需更多大样本的随机对照研究进一步验证。
