硫代硫酸钠对接受慢性血液透析的终末期肾病患者动脉僵硬度及PWV、lnCAC、CAVI的影响
2023-10-28陈文龙
陈文龙
河南大学第一附属医院,河南省开封市 475000
心血管疾病是接受维持性血液透析(HD)患者死亡的主要原因[1]。尽管传统心血管危险因素得到了良好控制,但由于非传统心血管危险因素存在,心血管发病率和死亡率高仍是HD患者的高风险因素。动脉僵硬度(AS)可以通过多种方法测量,包括脉压、增强指数和脉搏波速度(PWV),其中PWV衍生的AS值可能会因血压变化而改变,由于上述参数无法确定HD患者改善的AS值是由血压依赖性还是独立机制引起的,因此,心踝血管指数(CAVI)最近被作为评价为AS最新指标,其由PWV确定和计算,并根据血压值进行相关数值的调整,此外,CAVI已被证明与导致AS的相关危险因素关系密切[2]。硫代硫酸钠(STS,Na2S2O3)是一种还原剂,它能够与许多金属离子形成水溶性络合物,主要有螯合钙离子,具有抗氧化应激、舒展血管和钙化抑制作用。静脉注射(IV)STS可以预防、延缓和改善HD患者和尿毒症动物的血管钙化[3]。这种血管益处的潜在机制可能是由硫代硫酸盐和钙之间的阳离子螯合介导的,从而降低了磷酸钙沉淀的可能性[4]。此外,由于其还具有抗氧化应激的性能,可能有助于改善HD患者常见的内皮功能障碍及血管钙化情况,但关于STS治疗对HD患者AS作用的数据不足。因此,本文选择100名患有异常AS的HD男性患者,旨在评估STS对HD患者AS的疗效。
1 资料与方法
1.1 一般资料 选取医院2017年12月—2019年12月根据CAVI测量的100名患有异常AS的HD男性患者,按照随机抽签法分为观察组和对照组,每组50例。两组基本资料对比无统计学差异(P>0.05),见表1。
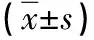
表1 两组患者基本资料对比
1.2 选择标准 纳入标准:(1)每周行HD2~3次的终末期肾病(ESRD)患者,透析时间>6个月;(2)存在异常AS(CAVI≥8分);(3)年龄>18岁;(4)患者依从性良好,且对研究知情同意。排除标准:(1)预期寿命<6个月;(2)参加其他研究,伴急性疾病或活动性恶性肿瘤、怀孕;(3)当前类固醇皮质激素治疗(>5mg/d),血清全段甲状旁腺激素(IPTH)≥585pg/ml;(4)肢体异常(例如截肢)和CAVI无法测量的严重肢体缺血。
1.3 方法 观察组患者均使用高通量透析器(如聚砜、聚醚砜或三醋酸纤维素)以250~400ml/min血流量和500ml/min透析液流量接受常规HD。HD频率为2~3次/周(4h/次)。在HD的最后1h内静脉注射12.5g 25%STS,2次/周,持续6个月。如果患者在静脉注射STS治疗后24~48h内出现持续性厌食和食欲不振的症状,则STS剂量减半。每次行静脉注射治疗后观察并记录不良反应,如厌食、恶心、呕吐、食欲不振、头晕、透析中低血压和严重的高阴离子间隙代谢性酸中毒。对照组患者使用高通量透析器(如聚砜、聚醚砜或三醋酸纤维素)以250~400ml/min血流量和500ml/min透析液流量接受常规HD。HD频率为2~3次/周(4h/次)。患者透析最后1h不进行STS的注射,其他治疗方式均相同。
1.4 观察指标 分别在治疗后3个月和治疗后6个月,观察两组肱动脉血压、PWV、lnCAC评分和CAVI。
2 结果
治疗后3、6个月两组患者的CAVI、PWV与治疗前比较差异无统计学意义(P>0.05),但治疗后6月两组的lnCAC评分高于治疗前,差异有统计学意义(P<0.05)。观察组治疗后3、6个月的PWV及治疗后6个月的CAVI、lnCAC评分均优于对照组,差异有统计学意义(P<0.05)。见表2。
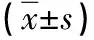
表2 两组治疗基本情况比较
3 讨论
AS是血管过早老化的一种表现,是ESRD患者心血管疾病发病率和死亡率高的关键因素。AS增加会导致动脉顺应性降低和一些显著的不良临床后果,包括孤立性收缩期高血压、左心室肥厚、左心室衰竭以及心肌灌注减少。如前所述,ESRD患者AS升高是血管钙化、炎症、内皮功能障碍、氧化应激等因素共同造成的结果。有几种治疗策略试图减少ESRD患者的AS,包括减少和预防动脉钙化、肾素—血管紧张素—醛固酮系统阻断、他汀类药物应用、体育锻炼和可以减少炎症状态的干预措施。但只有3项研究在HD患者中使用IVSTS治疗[5],而且仅报告了IVSTS治疗对CAC评分的影响,但并未确定存在AS。在Mathews等[6]的研究中,将AS作为二次输出进行检查,结果显示PWV没有变化。本文结果表明,IVSTS治疗可以减轻慢性HD患者的AS并维持CAC评分。HD患者IVSTS治疗后AS降低的潜在机制可能与血管壁钙沉淀的延迟或减少有关。本文中通过IVSTS治疗延迟CAC进展支持了这一假设,这与之前的动物和人类研究一致[7]。由于其抗氧化特性,STS已被提议通过抑制炎症来减少AS。先前针对HD患者血管钙化的STS治疗的非RCT研究,IVSTS治疗减少了炎症标志物,如hsCRP。在本研究中,hsCRP略有下降,但不显著。因此,还需要对更多的患者进行进一步的研究,以确立静脉注射STS在减少AS方面的炎症抑制作用。
在之前的研究中[8],2~3次/周HD后融合IVSTS,剂量范围为每次HD12.5~25g或0.18g/kg,治疗持续时间为3~5个月,使用这些方案,观察到的副作用包括厌食和食欲不振,报告的发生率很高(高达75%)。在最近的一项研究中,在HD的最后1h而不是HD后输注的IVSTS也为患有钙性尿毒症性动脉病的HD患者提供了生存益处。在本文中,为了避免HD后STS治疗的副作用,同时保持AS和CAC的STS有效性,在HD的最后1h内静脉输注STS,2次/周,持续6个月,通过该方案,仅12.5%的患者感觉到STS治疗副作用,这表明该方案比HD后方案更可行且耐受性更好。如本研究所示,在HD的最后1h输注STS可使透析前阴离子间隙显著升高,表明存在某些STS血清水平。尽管本文中的血清阴离子间隙值(HD方案的最后1h)略低于先前研究中提到的值(HD后方案)[9](平均阴离子间隙变化为2.3对2.5~6.6),所施用的STS剂量足以在降低AS和稳定CAC评分方面提供显著益处。然而,还需要进一步的药代动力学研究来确定在HD方案的最后1h使用的更理想的STS剂量。在本文中,观察组治疗后3、6个月的PWV及治疗后6个月的CAVI、lnCAC评分均优于对照组,差异有统计学意义(P<0.05)。本文中IVSTS后cfPWV衍生的AS值与Budoff等[10]研究存在差异。尽管IVSTS剂量非常相似,但可能是由通过PWV方法获得的AS值等因素引起的。
本研究局限性可能会使患者的观察结果产生偏差,而单中心方面可能会低估效应方差,因此这种设计可能会削弱结果。其次,由于样本量小、持续时间短(仅6个月),STS治疗的远期效果和预后尚不清楚。最后,本研究中没有测量某些蛋白质的修饰,例如胎球蛋白-A和骨保护素,它们是众所周知的STS治疗后异位钙化的全身抑制剂。
总之,本研究可能为证明透析中STS治疗可以显著降低通过CAVI测量的AS并稳定HD患者血管钙化的RCT提供临床证据。因此,STS可能是治疗HD患者功能性和结构性心血管异常的新治疗策略。
