哈萨克羊杂交群体多胎基因检测分析
2023-10-27玛尔孜娅亚森阿米妮古丽阿不来孜买坎沙力周喜荣于丽娟罗春彦奴丽曼古丽阿不拉邸全文张艳花
张 恺,玛尔孜娅·亚森,阿米妮古丽·阿不来孜,买坎·沙力,周喜荣,于丽娟,3,白 锋,罗春彦,奴丽曼古丽·阿不拉,邸全文,张艳花,3*
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.新疆畜牧科学院畜牧研究所,乌鲁木齐 830026;3.农业农村部畜禽资源(羊)评价利用重点实验室,乌鲁木齐 830026 4.新疆畜牧科学院畜牧业经济与信息研究所,乌鲁木齐 830026;5.哈密市伊州区柳树沟乡农业(畜牧业)发展服务中心,新疆 哈密 839003;6.新疆伊犁特克斯县乔拉克铁热克镇,新疆 特克斯 835500)
随着我国肉羊产业的发展及人们对肉产品需求量的增加,提高肉羊生产繁殖率是当前产业发展中亟待解决的问题。为提高哈萨克羊的产羔率,新疆特克斯县哈萨克羊养殖户于1990 年引进小尾寒羊公羊与本地哈萨克羊生产母羊杂交,经过30年的导入多胎基因进行杂交及选育,杂交群体的多胎率达90%以上。实践证明,通过这种生产方式,既提高了杂交群体的多胎率又保留了原有哈萨克羊群体的适应性。本研究旨在通过检测该群体FecB基因,找到影响该群体产羔率的因素,为利用小尾寒羊改良哈萨克羊繁殖性能提供依据,为哈萨克羊高繁品系的培育提供借鉴[1,2]。
1 材料与方法
1.1 实验材料
本次实验所需主要试剂有Ezup 柱式血液基因组DNA 抽提试剂盒(生工生物工程(上海)股份有限公司,产品编号:B518253);引物[3](上游引物:5’-GTCGCTATGGGGAAGTTTGGATG-3’,下游引物:5’-CAAGATGTTTTCATGCCTCATCAACACGGT-3’);2X San Taq Fast PCR MiX 预混液(含蓝染料)(生工生物工程(上海)股份有限公司,产品编号:B532062);Ava Ⅱ内切酶。主要仪器有低温离心机priao-R、PCR扩增仪-VeritiM 96-Well Thermal Cycler、水浴锅、电泳仪DYY-6C。
实验羊群来自特克斯县哈萨克羊杂交改良群体,每间隔4年导入一次小尾寒羊多胎基因。为防止近亲交配,公羊使用1~2 年淘汰,然后使用哈萨克公羊配种,如此交替延续近30 年。饲养方式为半舍饲,每年5月到10月在夏牧场放牧,11月至次年4月底为舍饲。
1.2 实验方法
1.2.1 样本采集本实验使用羊侧颈静脉采血,选择59 只健康的哈萨克羊杂交群体生产母羊,每只采集3 mL 静脉血样本,并将血液样本保存在抗凝管中,冷冻贮存,用于提取DNA。
1.2.2 DNA提取
使用Ezup 柱式血液基因组DNA 抽提试剂盒,首先取200 μL 的血液样品加入到1.5 mL 离心管中,再加入磷酸盐缓冲溶液(PBS Solution)使总体积达到200 μL,混匀。然后加入20 μL 蛋白酶K(Proteinase K)和200 μL 缓冲溶液DL(Buffer DL),混匀后在56 ℃水浴中加热10 min,再向离心管中加入200 μL的无水乙醇,混匀。将吸附柱放入收集管中,把溶液和半透明纤维状悬浮物全部加入吸附柱中,静置2 min后再以10 000 r/min的速度,室温离心1 min,倒掉收集管中废液,将吸附柱放回收集管中,向吸附柱中加入500 μL GW Solution 和700 μL Wash Solution,分别离心后倒掉废液。再将吸附柱重新放回收集管中,离心去除残留的Wash Solution。最后取出吸附柱,放入一个新的1.5 mL离心管中,加入50 μL CE 缓冲液(CE Buffer)静置3 min 后离心,收集DNA 溶液。提取的DNA在-20 ℃保存备用,以备后续PCR扩增使用。
1.2.3 PCR扩增
根据小尾寒羊的基因组序列信息,使用Primer Premier 5 软件进行引物设计,设计出上下引物的序列用于扩增FecB 基因的DNA 片段。PCR 反应体系包括PCR Mix、DNA 模板、上下引物和ddH2O。其中PCR Mix 包含了反应所需的各种物质,而DNA 模板则是PCR 反应的DNA 样本。上下游引物是用于PCR反应扩增FecB基因的DNA片段的引物序列。
上游引物:5’-GTCGCTATGGGGAAGTTTGGATG-3’
下游引物:5’-CAAGATGTTTTCATGCCTCATCAACACGGT-3’
PCR 反应程序包括预变性、变性、退火和延伸等步骤,共进行35 个循环。预变性阶段将反应体系加热至94 ℃,使DNA 解旋成单链;变性阶段温度94 ℃,持续30 s,使DNA 变性成单链;退火阶段将温度降至62 ℃,持续30 s,使引物与目标DNA 互补配对;延伸阶段将温度升至72 ℃,持续30 s,聚合酶开始合成新的DNA 链。最后温度保持在72 ℃,持续6 min 的延伸步骤,以确保DNA 链的完全合成[4]。
PCR 反应产物通过1%琼脂糖凝胶电泳检测,可以将不同大小的DNA 片段分离出来,验证PCR反应是否成功扩增出目标片段。在本次实验中,目的条带预计约在140 bp 左右,通过检测结果确认是否扩增成功。
1.2.4 PCR-RFLP
本实验使用聚合酶链式反应(PCR)扩增DNA 片段,然后将扩增产物进行酶切处理。酶切反应采用限制性内切酶对扩增产物进行切割,以产生不同长度的DNA 片段。根据所设计的位点,会出现三种基因型,分别为BB、B+、++,它们的长度分别为110 bp、30 bp 和140 bp、110 bp、30 bp 以及140 bp。由于30 bp 较短,因此在电泳成像图中可能不易辨认,但并不影响实验结果。酶切反应的体系包括3 μL ddH2O、1.5 μL 缓冲液、0.5 μL AvaII 内切酶和5 μL PCR 扩增产物。反应条件为在37 ℃水浴中加热4 h,然后在2%浓度的琼脂糖凝胶下进行电泳,并使用成像仪检测结果。
2 结果与分析
2.1 凝胶电泳图结果
2.2 PCR-RFLP分析
当FecB 基因的746 bp 处发生突变时,便会产生AvaⅡ酶的酶切位点,这在李东红[5]的研究中提到。在我们样本中有少部分血样保存不佳,DNA出现降解,无条带显示,不计入总数。
图1 中第M 泳道是2 000 bp 的marker,PCR 扩增产物在140 bp 左右,符合预期结果。图2 中第M泳道是50 bp 的marker,第1、5、6、8、9、11 泳道出现140 bp 和110 bp 两条条带,为B+(突变杂合型);第3、7、13 泳道出现140 bp 条带,为++(不含多胎主效基因);第12 泳道出现110 bp 条带,为BB(突变纯合型),统计结果见表1。
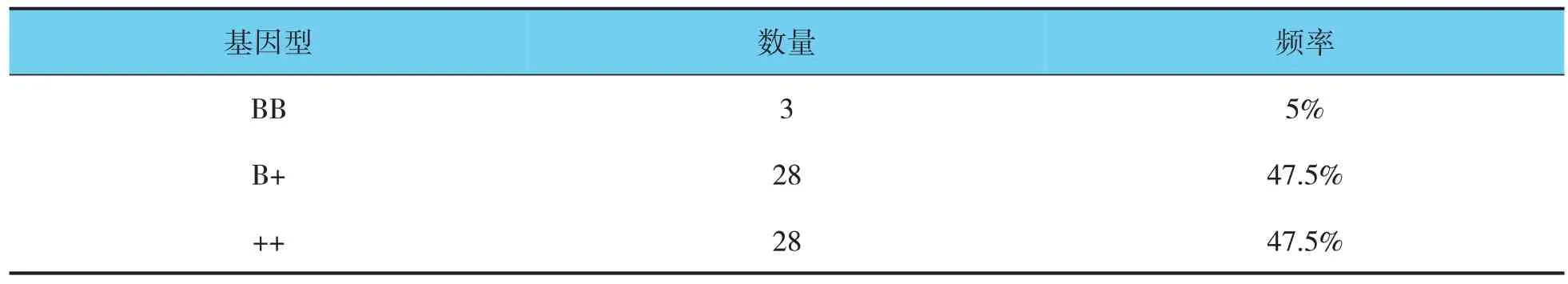
表1 多胎基因检测结果
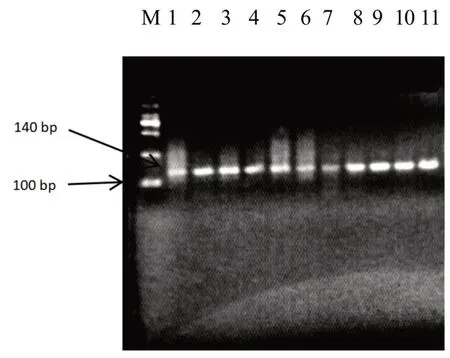
图1 FecB基因PCR产物电泳分析
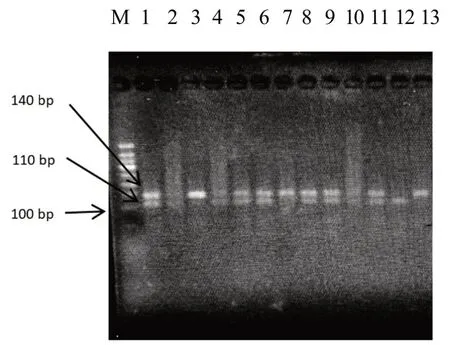
图2 PCR产物酶切产物电泳分析
3 讨 论
目前在提高绵羊产羔率的育种工作中,采用较多的是导入小尾寒羊或者湖羊多胎基因,提高原有品种的产羔率。
3.1 杂交导入小尾寒羊提高多胎率的效果
本实验发现利用杂交小尾寒羊可以有效地将FecB 基因导入哈萨克羊群体,该实验群体的实际多胎率高达90%,大大高于检测结果,可能是导入群体的多胎率除FecB 主效基因外,还有其他微效多基因影响;另外可能是实验群体的多胎率统计不准确,后续将进一步统计验证。
李彬[6]在甘肃省景泰县进行滩羊导入小尾寒羊的基因效果观察,试验组滩×寒滩F1 产羔率达184.38%,对照组滩母羊产羔率为103.3%。试验组比对照组的产羔率提高了80%有余。罗生金[7]在研究培育有多胎基因的哈萨克羊时将小尾寒羊作为父本或母本,并对F1代羊进行调查,结果为野生杂合性B+的比例比野生型++提高了63%,有效提高F1 代母羊的产羔数。吕彦庆[8]在新疆玛纳斯县羊场针对小尾寒羊的杂交做了更加仔细的记录,将黑头杜泊羊与小尾寒羊杂交,F1代母羊的单羔率为43%,产双羔率41.2%,产三羔率15.8%,群体产羔率172.8%。杂交后代的产羔率显著上升,与本实验的结果相符。
以上案例都是导入小尾寒羊杂交1 代和杂交2 代的实验分析,本实验研究群体为间隔4 年杂交小尾寒羊导入多胎基因,陆续导入7次,多胎率达到90%,除双羔外还有三羔四羔出现。实践证明通过杂交导入小尾寒羊多胎基因提高哈萨克羊多胎率效果显著。
3.2 杂交导入湖羊提高多胎率的效果
在伊利[9]等人的研究中提到,在新疆石河子、哈密、昌吉、阿克苏、喀什、博尔塔拉蒙古自治州等地,采用湖羊与哈萨克羊杂交培育的新类型具有较高繁殖力,在舍饲条件下各项生理指标正常,发病率低,能很好地适应本地气候环境。王伟萍[10]选择来自江苏西来原生态农业有限公司养殖的湖羊与乌骨羊的杂交后代作为研究对象,得出与湖羊杂交后的后代显著提升了繁殖率,并且在抗病性能和生长性能方面有显著的杂种优势。李丹妮[11]在西北农林科技大学金昌奶绵羊试验示范基地进行东佛里生羊和湖羊杂交实验,根据F2 代产羔数据统计,东湖杂二代羊(F2)的产羔率为189.51%,产单羔的母羊约占群体总数的42%。导入湖羊的多胎基因是作为其他肉羊品种提升产羔率的主流趋势。
综上所述,利用杂交导入小尾寒羊多胎基因在甘肃省景泰县、新疆玛纳斯县等地,对提高滩羊、黑头杜泊羊、哈萨克羊等品种的产羔率效果显著,试验组的产羔率达到184.38%。利用杂交导入湖羊多胎基因在新疆石河子、哈密、昌吉、阿克苏、喀什、博尔塔拉等地,对提高哈萨克羊、乌骨羊、东佛里生羊等品种的产羔率也有显著的效果,F2代产羔率为189.51%。
3.3 杂交导入小尾寒羊对产肉性状的影响
在苗玉华[12]所做的小尾寒羊与杜泊羊杂交实验中得出,杜寒杂交羊结合了小尾寒羊高产羔率的繁殖优势和杜泊父本快速生长、出色的产肉性能。与小尾寒羊羔羊相比,杜寒杂交羊一代肉羊的生产性能显著提高,具有明显的杂交优势和强大的适应性。
杂交后代天生具有优势,因为在遗传变异过程中,它们更好地保留了父代的优良基因。因此,杜寒杂交后代在生长发育性能、繁殖性能、育肥羊屠宰性能等方面都有所提高,肉质也得到了改善[12]。四子王旗尝试以东佛里生羊作为父本,小尾寒羊作为母本,培育出一种适合圈养、生长速度快、产肉率高且具有多胎性能的乳肉兼用品种。苗海芬[13]等人用杂交后代进行屠宰实验,结果表明,“东寒”杂交F1 代与小尾寒羊在宰前体尺和产肉性能方面差异不显著,但尾部重量占比和尾脂率显著减少。通过实现小尾化改良,本地肉羊产业的综合养殖效益得到了显著提升。这一举措不仅促进了当地肉羊产业的发展,也为当地社会经济的繁荣做出了巨大贡献。
综上所述,导入小尾寒羊多胎基因对改善产肉性状有显著影响。杂交后代在生长发育性能、繁殖性能、育肥羊屠宰性能等方面都有所提高,肉质也得到了改善。齐明[14]的实验也表明,杜×寒F1代和萨×寒F1代羔羊在6月龄时的体高、体长、胸围和产肉性能也均显著高于纯繁。
3.4 利用基因检测技术加快育种遗传进展
在荷斯坦牛的育种工作中,运用基因定位和分子检测等技术,为奶牛遗传进展带来前所未有的提升[15],规模化使用基因组选择技术进行育种工作是主流趋势[16]。
早在1994年中国农业科学院兰州兽医研究所的魏庆信[17]等人将PMHR 抗猪瘟病毒核酶基因导入湖北白猪,实验完成后四头仔猪检测出PMHR基因,成功地减缓了当时的猪瘟流行。
在羊的育种中应用较多的有OarJMP29基因,与绵羊体重、周长和角长有关;EDG1基因,与脂尾性状显著相关;ZEB1和DEPDC7基因可以筛选绵羊四乳头性状等[18]。通过对多胎基因型的选择,从数量遗传学的角度来看,采用基因检测技术和基因型选择技术,提高了选种的准确度,增强了选择强度,大大加快了遗传研究进程。
目前利用检测FecB 基因选择多胎性状已经是一个较为成熟的技术。本研究项目中,通过检测FecB 基因,选择多胎基因型的哈萨克羊留种,可以有效提高选择强度,加快繁殖率这一低遗传力性状的选育速度,这为地方品种多胎育种提供了有效的技术支持。
综上所述,本实验通过采用基因检测技术和基因型选择技术,为绵羊育种提供了有效的技术支持,为利用小尾寒羊多胎基因改良哈萨克羊繁殖性能提供依据,为哈萨克羊高繁品系的培育提供借鉴。
4 结 论
本实验发现通过杂交导入高繁殖性状的小尾寒羊多胎基因改良哈萨克羊,可以有效提高群体的繁殖率,利用基因检测技术,筛选出具有多胎基因的个体留种,对育种群体种羊进行精准选择,为地方多胎品种(系)的培育提供技术支撑。利用杂交导入小尾寒羊多胎基因培育哈萨克羊多胎品系,具有重要的实践意义和应用价值,可以有效提高地方品种肉羊的产羔率,是培育哈萨克羊多胎品系的途径之一。
本实验还发现在哈萨克羊群体中通过交替使用小尾寒羊公羊、哈萨克公羊配种,不但保证了群体的产羔率,而且保留了哈萨克羊原有的适应性强、耐寒、耐粗饲等特点,这种杂交方式不仅能够提高生产效率,还能够保证羊群的健康成长。通过不断引进新鲜血液,可以有效防止近亲繁殖导致的遗传缺陷。这种杂交模式可以在养殖生产中加以推广。
