多模态超声和增强CT在肾透明细胞癌与非透明细胞癌中的诊断价值比较
2023-10-27赵娇凤夏永升陈顺平季文斌
赵娇凤,夏永升,陈顺平,季文斌
1.温州医科大学附属第一医院 超声科,浙江 温州 325015;2.温州医科大学附属台州医院 放射科,浙江 台州 317000
肾细胞癌(renal cell carcinoma, RCC)是全球常见恶性肿瘤之一[1],近年来RCC的病死率明显下降,但据美国癌症协会统计,RCC的发病率呈稳步上升趋势[2],这与人们的生活方式及影像学检查的广泛应用有关。目前临床上将RCC分为透明肾细胞癌(clear cell renal cell carcinoma, ccRCC)与非透明肾细胞癌(non-clear cell renal cell carcinoma, non-ccRCC)进行治疗和管理[3],其中ccRCC占RCC的60%~85%,non-ccRCC主要包括乳头状肾细胞癌(papillary renal cell carcinoma,pRCC)、肾嫌色细胞癌(chromophobe renal cell carcinoma, chRCC)、透明乳头状细胞癌(clear cell papillary renal cell carcinoma, ccpRCC),分别占RCC的7%~14%、4%~10%、3%~4%。ccRCC和non-ccRCC的鉴别对于指导临床选择合适的治疗方案及判断预后有一定的价值[4]。目前CT和MRI是鉴别RCC亚型的主要影像手段,但不适用于部分肾功能不全、碘或钆造影剂过敏的患者。而超声具有高空间分辨率、背景减影效果好及安全等优点,适用于所有患者[5-6]。目前,比较超声和增强CT(contrastenhanced computed tomography, CECT)在ccRCC与non-ccRCC之间的诊断效能的报道较少。本研究通过回顾性分析多模态超声和CECT在ccRCC与nonccRCC中的影像学特征,比较两种检查方法的诊断价值,评估两种检查方法在观察者间的一致性。
1 对象和方法
1.1 对象 收集2013年1月至2023年2月于温州医科大学附属第一医院同时行多模态超声及CECT检查的RCC患者。纳入标准:①造影前未进行其他肾脏手术;②在我院手术且经病理科证实为RCC。排除标准:①临床资料及超声图像不完整;②仅行肾肿瘤穿刺活检者。共收集202例肾癌患者,排除超声图像不合格23例,无CECT 44例后,共121例患者包括125个RCC肿块,其中4例患者各有2个肿块。本研究获本院伦理委员会批准(批准号为KY2022-R055)。
1.2 仪器和方法
1.2.1 超声检查:采用美国飞利浦公司IU22、EPIQ5彩色多普勒超声诊断仪,使用C5-1探头;日本ALOKA公司LISENDO 880彩色多普勒超声诊断仪,使用C6-1探头。造影剂使用声诺维(意大利博莱科公司)。患者术前均行常规超声及超声造影(contrast enhanced ultrasound, CEUS)检查。嘱患者取侧卧位或(和)俯卧位先行常规超声检查,在二维超声下采集和测量肾肿瘤相关数据及特征参数,随后使用彩色多普勒显像技术观察并记录肿瘤内部和外周血流,最后选择肿瘤最大、最清晰的切面作为CEUS时的最佳观察切面,进入CEUS程序,经肘部浅静脉团注造影剂,随后用5 mL 0.9%氯化钠溶液冲管。在造影过程中嘱患者尽量进行浅慢呼吸,实时观察病灶造影剂强化过程,根据2017年欧洲医学和生物学超声学会联合会制定的非肝脏CEUS的应用指南将肾脏增强过程分为皮质期和实质期[7]。连续实时观察3 min,必要时需重复造影且2次造影间隔时间必须大于15 min。
1.2.2 CECT检查:所有患者行CT平扫及动态增强扫描,主要采用GE 64排螺旋CT机,扫描参数管电压120 kV,管电流40 mA,重建层厚5 mm;东软64排CT机,扫描参数管电压120 kV,管电流200 mAs,重建层厚5 mm;连影64排,扫描参数管电压120 kV, 管电流120 mAs,重建层厚5 mm;动脉期、静脉期及延迟期分别于注射造影剂后30 s、60~70 s和 2~3 min进行扫描。碘造影剂主要选用威视派克 (美国GE公司)270 mgI/mL、司倍清(浙江司太立制药有限公司)320 mgI/mL,按1.3 mL/kg计算,注射速率2.2 mL/s,患者屏气完成检查。
1.2.3 影像分析:所有图像均由两名5年以上腹部影像经验的医师独立分析。期间收集所有患者的临床资料,分别为性别、年龄、症状、相关疾病,其中症状包括血尿、腰痛、腹部肿块,相关疾病主要包括高血压、糖尿病、慢性肾病。常规超声包括肿瘤的侧性、位置、最大直径、内部回声、边界、形态、方向及液性坏死区。彩色多普勒参数包括瘤周边血流及内部血流分级(Adler法)[8-9]。CEUS特征包括造影剂的灌注和消退方式、皮质期和实质期强化程度、强化均匀性和周边环状增强。灌注方式分为快进、同进、慢进,表示造影剂到达病灶较周边正常肾皮质快、同时、慢;消退方式分为快退、同退、慢退,表示病灶造影剂消退速度较周边正常肾皮质快、同时、慢;强化程度定义为当造影剂在病变中达到峰值时与周边肾皮质相比,分为低增强、等增强和高增强,周边环状增强表示为假包膜[10]。CECT参数包括肿瘤的形态、边缘、钙化、坏死和出血,增强扫描时评估动脉期、静脉期、延迟期的强化程度、强化模式和假包膜情况。根据病灶CT净增强值确定其整体强化程度,具体定义分为:增加CT值小于 20 Hu为轻度强化,CT 20~60 Hu定义为中度强化,CT大于60 Hu定义为明显强化。
1.3 统计学处理方法 采用MedCalc软件进行数据分析。计量资料以±s或M(P25,P75)表示,计数资料频数和百分比(%)表示。采用Wilcoxon秩和检验、χ2检验或Fisher’s精确检验进行比较。采用向后变量选择的二元Logistic回归分析。通过ROC曲线评价CEUS和CECT的诊断性能,包括灵敏度、特异度,AUC之间的比较使用DeLong检验。不同观察者间的一致性分析采用Kappa一致性检验。P<0.05为差异有统计学意义。
2 结果
2.1 2 组患者的临床特征比较 ccRCC组88 例,non-ccRCC组37例,包括pRCC 15例、chRCC 18例和ccpRCC 4例。单因素分析结果显示non-ccRCC组与ccRCC组的有临床症状的比例差异有统计学意义(P<0.05),ccRCC组相关疾病比例高于non-ccRCC组(P<0.05),而两组间的性别、年龄、肿瘤侧性、位置及肿瘤直径差异均无统计学意义(P>0.05),见表1。
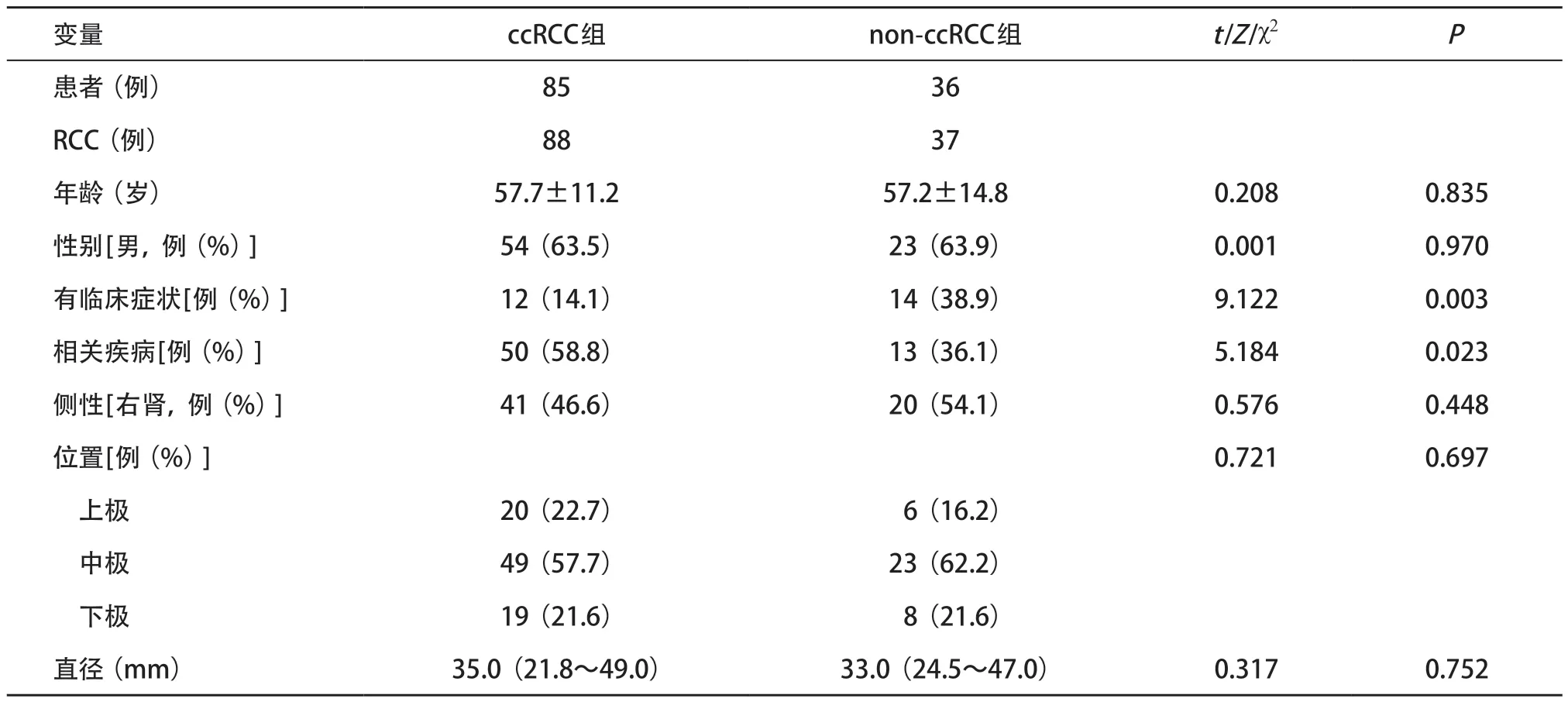
表1 2组患者的临床特征比较
2.2 2 组多模态超声结果比较 常规超声中ccRCC组液性坏死区和周边血流检出率显著高于nonccRCC组(P<0.05),而两组间的肿瘤形态、方向、边界、内部回声、回声均匀性及肿瘤内部血流差异均无统计学意义(P>0.05)。CEUS显示ccRCC较nonccRCC组造影剂灌注更快、消退更缓慢(P<0.001)。皮质期ccRCC组高增强的比例显著高于non-ccRCC组(P<0.001)。相比之下,实质期non-ccRCC组以低增强更常见(P<0.001)。而两组间的不均匀性增强和环状增强差异均无统计学意义(P>0.05)。见表2。
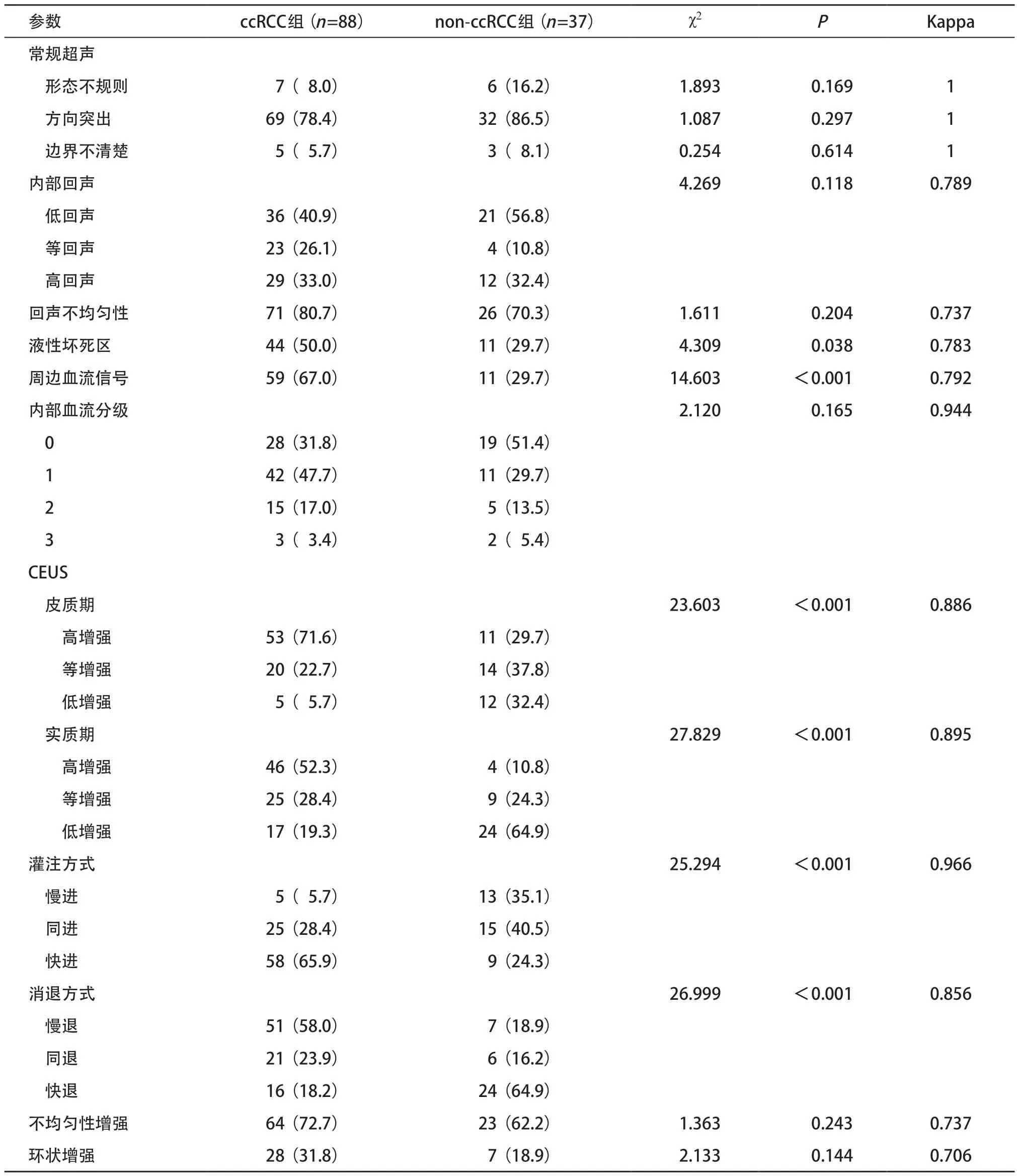
表2 2组多模态超声结果比较[例(%)]
2.3 2 组CECT检查结果比较 non-ccRCC组钙化的检出率显著高于ccRCC组(P<0.001);而ccRCC组出现坏死的比例明显高于non-ccRCC组(P<0.05)。两组间的边缘、形态及出血差异均无统计学意义(P>0.05)。动脉期ccRCC组主要表现为高或等增强,non-ccRCC主要表现为低增强(见图1),差异有统计学意义(P<0.001)。静脉期部分ccRCC仍表现为高或等增强(P<0.05)。关于增强模式,ccRCC组主要表现为快进快出和快进慢出,non-ccRCC组主要为持续强化和平台型,差异有统计学意义(P=0.001)。与non-ccRCC组相比,ccRCC的强化程度为明显强化(P<0.001),两组间的排泄期强化和假包膜差异无统计学意义(P>0.05)。见表3。
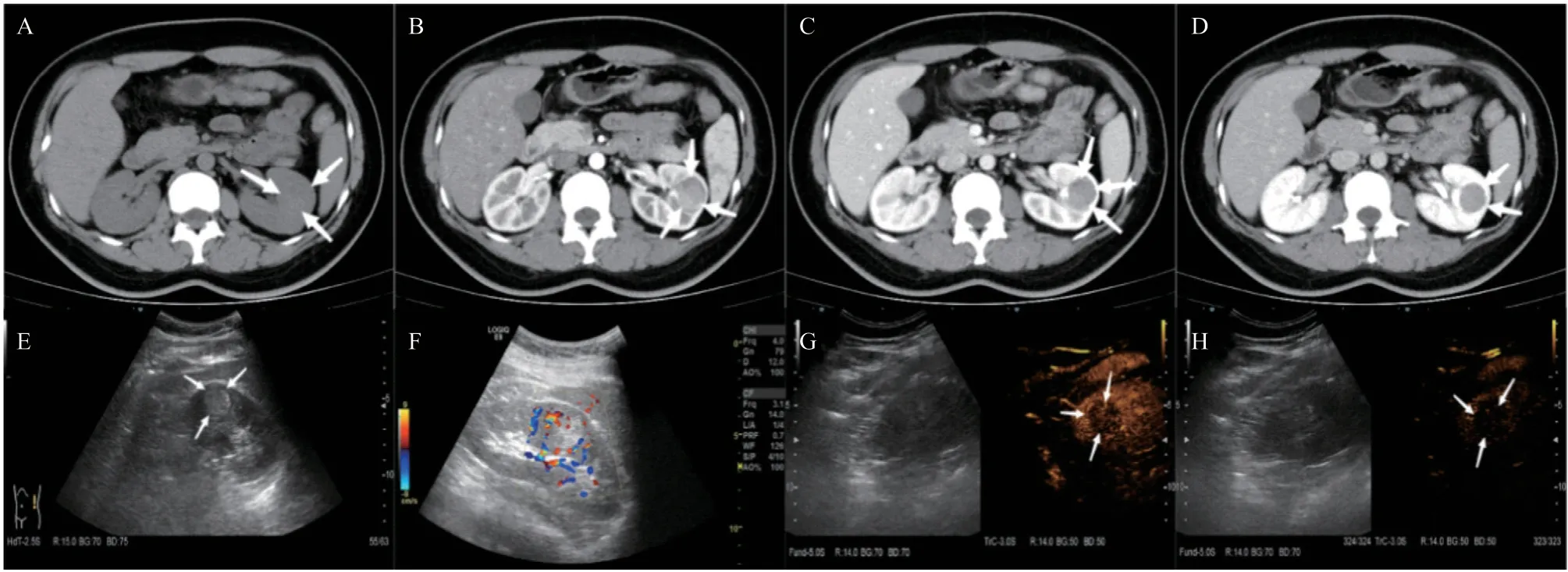
图1 non-ccRCC女性患者左肾中极直径约2.6 cm的内生性实质性肿块CT及超声影像
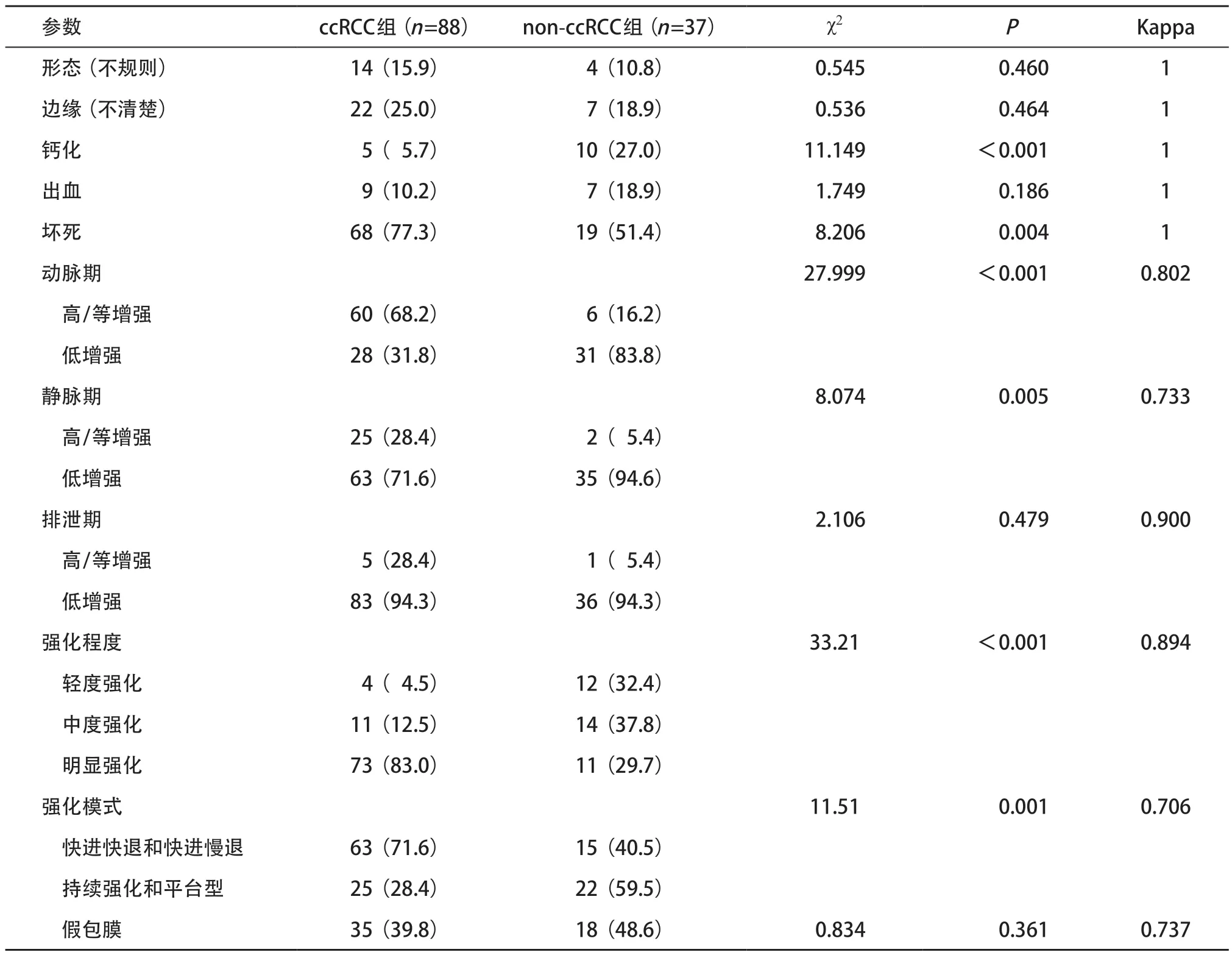
表3 2组CECT检查结果比较[例(%)]
2.4 多因素Logistic回归分析 多模态超声中液化坏死区(OR=2.744,95%CI=1.022~7.369,P= 0.045)、实质期强化程度(OR=4.102,95%CI=1.154~ 14.573,P=0.029)和消退方式(OR=0.226,95%CI= 0.083~0.613,P=0.004)是鉴别ccRCC和non-ccRCC的独立预测因子。CECT的参数包括坏死(OR=3.163,95%CI=1.181~8.468,P=0.022)、动脉期强化(OR= 4.103,95%CI=1.192~14.117,P=0.025)和强化程度(OR=4.942,95%CI=1.587~15.382,P=0.006)是区分ccRCC和non-ccRCC的独立预测因子。见表4。
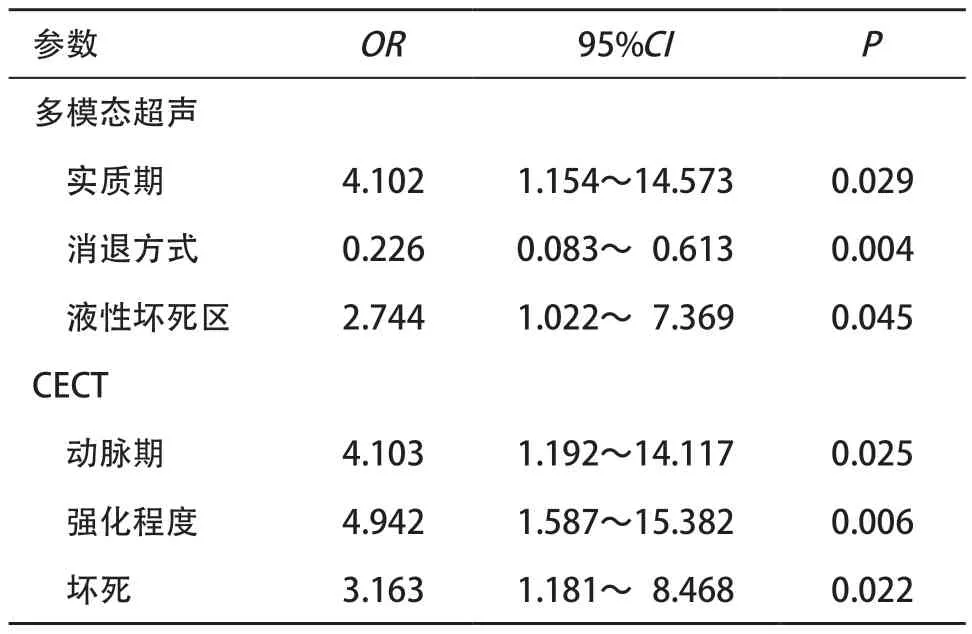
表4 多模态超声和CECT多因素Logistic回归分析结果
2.5 2 种方法的诊断性能比较 多模态超声和CECT在ccRCC和non-ccRCC的鉴别上均具有良好的诊断效能,AUC分别为0.832、0.838,灵敏度分别为81.8%和80.7%,特异度分别为75.7%和81.1%,两组间的AUC差异无统计学意义(P=0.875)。
2.6 观察者间协议的一致性 多模态超声和CECT有差异的特征间具有很好的一致性。多模态超声和CECT的Kappa值均为0.706~1.000,见表2、表3。
2.7 多模态超声和CECT的诊断准确率 125 例RCC肿瘤中,多模态超声正确诊断103例,误诊22例。其中10例ccRCC误诊为non-ccRCC,12例nonccRCC(chRCC 5例,pRCC 3例,ccpRCC 4例)误诊为ccRCC。CECT正确诊断96例,误诊29例。其中16例ccRCC误诊为non-ccRCC,13例non-ccRCC(chRCC 8例、pRCC 1例、ccpRCC 4例)误诊为ccRCC。125例RCC中有10例均被超声及CECT误诊。多模态超声和CECT诊断准确率分别为82.4%、76.8%,误诊率分别为17.6%、23.2%;两种影像方法鉴别ccRCC和nonccRCC的准确率差异无统计学意义(P=0.620)。
3 讨论
近年来,有研究[11-14]显示无论CECT还是CEUS,增强程度是鉴别ccRCC和non-ccRCC最有价值的特征,ccRCC大多表现为高增强,non-ccRCC主要为低增强,这与本研究结果相似。本研究CECT结果显示ccRCC主要在动脉期增强并明显强化,与周围正常肾皮质相比呈现高或等增强,而non-ccRCC在动脉期与静脉期大多表现为低增强。这种强化差异与肿瘤内部血流动力学和微血管密度有关[15]。ccRCC属于异质性富血管肿瘤,内含丰富毛细血管网,non-ccRCC反之。此外,CEUS结果显示在区分两者时实质期比皮质期更具有临床意义,这可能由于部分肿瘤在皮质期与周围正常肾皮质增强程度相近难以发现,当造影剂逐渐消退时病灶显现更加明显[16-17],这一特征反映了CEUS能动态地观察病灶内血流灌注的优势。
在CEUS增强模式上,ccRCC和non-ccRCC也存在明显的差异。有学者[18]认为造影剂快速消退是诊断直径<4 cm的non-ccRCC的独立预测因子,其灵敏度和特异度为77.78%、63.22%。ZHAO等[19]研究显示消退方式是区分ccRCC和non-ccRCC的独立预测因子,本研究也得出相同的结果。超声造影剂消退时ccRCC大多表现为缓慢或同步消退,non-ccRCC以快退为主,这与肿瘤内血管和动脉静脉瘘的数量呈相关性[20],当肿瘤内血管成分含量多,间质成分少或动-静脉瘘等因素使得病灶内造影剂消退时间加快,反之造影剂消退缓慢。本研究单因素分析也显示在CECT上两者增强模式的差异,ccRCC大多为快进慢出或快进快出,non-ccRCC主要表现为持续强化和平台型,但多因素分析显示ccRCC和non-ccRCC之间的增强模式无明显统计学意义。
本研究还显示肿瘤内液化和坏死区在鉴别ccRCC和non-ccRCC具有一定的临床作用。与nonccRCC相比,ccRCC肿瘤内更易出现液化、坏死。以往研究[21-23]认为ccRCC因为肿瘤生长速度较快,导致内部未成熟微血管急性缺氧,更易发生坏死和囊性变。早期文献[24-25]还证实肿瘤内坏死与ccRCC和chRCC预后相关,但与肿瘤分期和分级无关。
多模态超声和CECT在评估ccRCC和non-ccRCC特征上,不同观察者间均具有较好的一致性,表明两种影像方法在临床实践中的可重复性。ROC曲线结果显示两种影像方法在鉴别ccRCC和non-ccRCC方面均有较好的诊断效能,两种影像方法间无明显差异。目前CT造影剂不断更新换代,但其不良反应仍明显高于超声造影剂[26],此外,碘造影剂须经过肾脏排泄,不适用所有患者,尤其是碘造影剂过敏和肾功能较差的患者。
综上所述,多模态超声在鉴别ccRCC和nonccRCC时发挥明显的临床作用。在RCC的评估上多模态超声能够作为CECT的重要补充,尤其是碘造影剂过敏和肾功能不全的患者。
