U(Ⅵ)在芽孢杆菌Bacillus sp.dwc-2上的矿化动力学研究
2023-10-27郭豫齐李飞泽杨吉军杨远友廖家莉
郭豫齐,涂 鸿,李飞泽,兰 图,杨吉军,杨远友,刘 宁,廖家莉
(四川大学 原子核科学技术研究所 辐射物理及技术教育部重点实验室,四川 成都 610064)
众所周知,具有放射性和化学毒性的重金属元素铀(U)排放到环境中将可能对生态系统造成污染和破坏,并在迁移过程中随着食物链富集,最终威胁人类的健康[1-3]。微生物作为广泛分布的环境有机质,具有体积小、活性高的特点,可通过生物吸附、生物积累和生物矿化等方式与铀相互作用,改变铀的溶解度和化学形态,从而影响铀在环境中的化学形态与迁移行为[4-6]。其中,微生物诱导铀生物矿化,可将可溶性铀转变为溶解度较低的铀矿,影响铀的生物利用,阻止铀在环境中的迁移[7-9]。
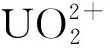
分析已有的研究可知,国内外众多学者已对可能影响U(Ⅵ)生物矿化行为的因素进行了大量考察,并对其机制进行了探讨。但迄今为止,这些研究主要集中于选用已处于某一生长阶段(对数期或稳定期)的微生物进行考察。但针对完整生长和繁殖阶段的微生物诱导U(Ⅵ)矿化的动力学行为研究较少,相关的机制也不明确[21]。为此,本文从某拟用作极低放射性废物处置场场所的土壤中分离出1株细菌Bacillussp.dwc-2[22],通过考察pH值、SGP浓度、U(Ⅵ)初始浓度等因素对U(Ⅵ)矿化行为的影响,揭示其在生长和繁殖过程中诱导U(Ⅵ)形成磷酸盐矿物的动力学行为,并对其相应的生物响应机制进行探讨,以便更好地理解微生物诱导铀矿化的行为与机制,为铀污染环境的生物修复提供具有参考价值的思路与方法。
1 实验
1.1 试剂与仪器
八氧化三铀(U3O8)购自湖北楚盛威化工有限公司,其余试剂均为分析纯。
LDZX-50KBS立式高压蒸汽灭菌锅,上海市申安医疗器械厂;TGL-16G台式离心机、FD-1-50冷冻干燥机,北京博医康实验仪器有限公司;pHS-3C精密pH仪,上海精密科学仪器有限公司雷磁仪器厂;DHP-9082电热恒温培养箱,上海一恒科学仪器有限公司;UV-2450紫外-可见分光光度计,日本岛津;DX-2700BH X射线衍射仪(XRD),丹东浩元仪器有限公司。
1.2 U(Ⅵ)储备溶液制备
铀储备溶液由U3O8制备。具体过程如下:将U3O8在800 ℃下加热30 min并冷却12 h,去除硝酸盐和硫酸盐等杂质;称取1.179 g预处理的U3O8,将其溶解在40~50 mL浓硝酸中;将所得溶液加热蒸发至体积尽可能小(无晶体沉淀);多次加入去离子水并加热以蒸发酸,直到溶液的总体积达到1 L,此时U(Ⅵ)浓度为1 g/L,系统的pH值约为2.7[23]。
1.3 U(Ⅵ)矿化实验
实验所用培养基为Luria-Bertani培养基(酵母粉5 g/L、蛋白胨10 g/L、NaCl 10 g/L、pH=7.0±0.2),溶液总体积为200 mL。在121 ℃下将溶解均匀的液体培养基湿热灭菌30 min。将甘油磷酸钠(C3H6NaO7P,SGP)通过0.22 μm滤膜过滤后加入到培养基中,之后将通过0.22 μm滤膜过滤的铀酰溶液加入到培养基中(防止U(Ⅵ)的沉淀),并确保最终的SGP和U(Ⅵ)浓度为所需要的值,最后加入Bacillussp.dwc-2并调节pH值至所需的值,在37 ℃下进行矿化反应。矿化时间为细胞的1个完整培养周期(48 h)。
1.4 磷酸盐浓度测定
采用磷钼蓝分光光度法测定矿化过程溶液中的无机磷酸盐浓度,具体方法如下。1) 配置26 g/L钼酸铵-酒石酸锑钾溶液(以总体积1 L为例):向300 mL去离子水中缓慢滴加300 mL浓硫酸,待溶液冷却后,加入200 mL 130 g/L的钼酸铵溶液混合均匀,最后加入200 mL 3.5 g/L的酒石酸锑钾溶液。抗坏血酸溶液的质量分数为10%。2) 将不同矿化时间点的培养基悬浊液在5 000 r/min下离心6 min,吸取1 mL上清液加入到25 mL容量瓶中,再依次加入2 mL 26 g/L的钼酸铵-酒石酸锑钾溶液、1 mL 10%抗坏血酸溶液,最后加入去离子水定容至25 mL,水浴锅20 ℃条件下反应20 min。3) 在710 nm处测定其浓度。
1.5 磷酸酶活性测定
矿化过程中菌体磷酸酶的活性通过对硝基苯磷酸二钠(pNPP)比色法测定。具体方法如下:吸取1 mL待测培养基悬浊液,加入至2 mL 100 mmol/L 的pNPP(Tris-HCl作为缓冲溶液)中,恒温振荡箱30 ℃条件下充分反应30 min;随后加入3 mL 10 mol/L NaOH溶液终止反应;最后采用紫外-可见分光光度计测定405 nm处反应溶液的吸光度。
1.6 磷酸酶催化反应速度测定
将Bacillussp.dwc-2接种在培养基中培养48 h,离心获取湿重为1.0 g的菌体,并用去离子水清洗2次。取清洗好的菌体放入装有50 mL不同浓度(0~200 mmol/L,梯度25 mmol/L,pH=7.0)SGP溶液的试管中,在30 ℃的振荡箱中恒温反应1、3、6 h,采用磷钼蓝法测量细菌代谢产生的磷酸盐浓度(cpi)并取平均值。无机磷酸盐代谢速率(v)采用v=cpi/t计算,其中t为反应时间。
1.7 生长曲线测定
吸取不同矿化时间点的菌体悬液,采用紫外-可见分光光度计测定其在600 nm处的吸光度,绘制矿化过程中吸光度随时间变化的菌体生长曲线。
1.8 矿化产物表征
1) 晶体结构表征
将不同矿化时间点的培养基悬浊液在5 000 r/min下离心6 min,离心所得菌体冷冻干燥(-50 ℃,20 Pa,2 d)、研磨,过200目筛,用X射线衍射仪进行表征。具体测量参数为:2θ模式,运行电压30 kV,Cu靶(Kα,λ=0.154 06 nm)、扫描步长0.04°,测量时间1 s,衍射角5°~60°。
2) 形貌及成分表征
不同矿化时间点的样品在5 000 r/min下离心5 min,将离心所得菌体用0.1 mol/L的NaCl溶液和已灭菌的去离子水清洗2次。取清洗后的菌体,在室温下用含2.5%(体积分数)戊二醛的固定液(pH=6.5)完全浸没,置于4 ℃冰箱中固定12 h。固定后的样品再次用灭菌的去离子水清洗2次,然后将所得样品用酒精梯度脱水,酒精梯度脱水的具体过程为:采用50%~100%(体积分数,梯度10%)乙醇水溶液逐步脱水,每次脱水30 min。酒精梯度脱水完成后,将样品进行CO2临界点干燥、镀膜。利用SEM扫描电子显微镜(型号Zeiss Gemini 300)对临界点干燥后的样品进行形貌测试,利用能量散射X射线谱(EDS)对样品的成分进行表征。
2 结果与讨论
2.1 U(Ⅵ)生物矿化行为的影响因素
1) U(Ⅵ)初始浓度
pH=7.0、SGP浓度125 mmol/L时,不同U(Ⅵ)初始浓度下U(Ⅵ)矿化沉积物的XRD谱示于图1。由图1可看出,U(Ⅵ)初始浓度为50 mg/L时,U(Ⅵ)在生长对数期(培养12 h)开始矿化,出现部分衍射峰,但沉积物仍以无定形为主;随着培养时间的增加,矿化程度基本不变,直到生长衰亡期(培养48 h),沉积物衍射峰逐渐尖锐,此时无定形沉积物转变为晶体矿物。通过与国际中心衍射数据库(ICDD)的标准卡片(PDF#00-029-1284)进行对比,确定Bacillussp.dwc-2矿化U(Ⅵ)形成的晶体矿物为钠铀云母(NaUO2PO4·3H2O)。U(Ⅵ)浓度增加到100 mg/L时,矿化效果有所提升,衍射峰在生长稳定期(培养24 h)逐渐尖锐,晶体矿物开始形成。而当U(Ⅵ)浓度增加到150 mg/L时,矿化速度显著提升,生长对数期(培养12 h)即形成明显的晶体矿物。由此可见,U(Ⅵ)的矿化作用随U(Ⅵ)初始浓度的增加而逐渐提升。
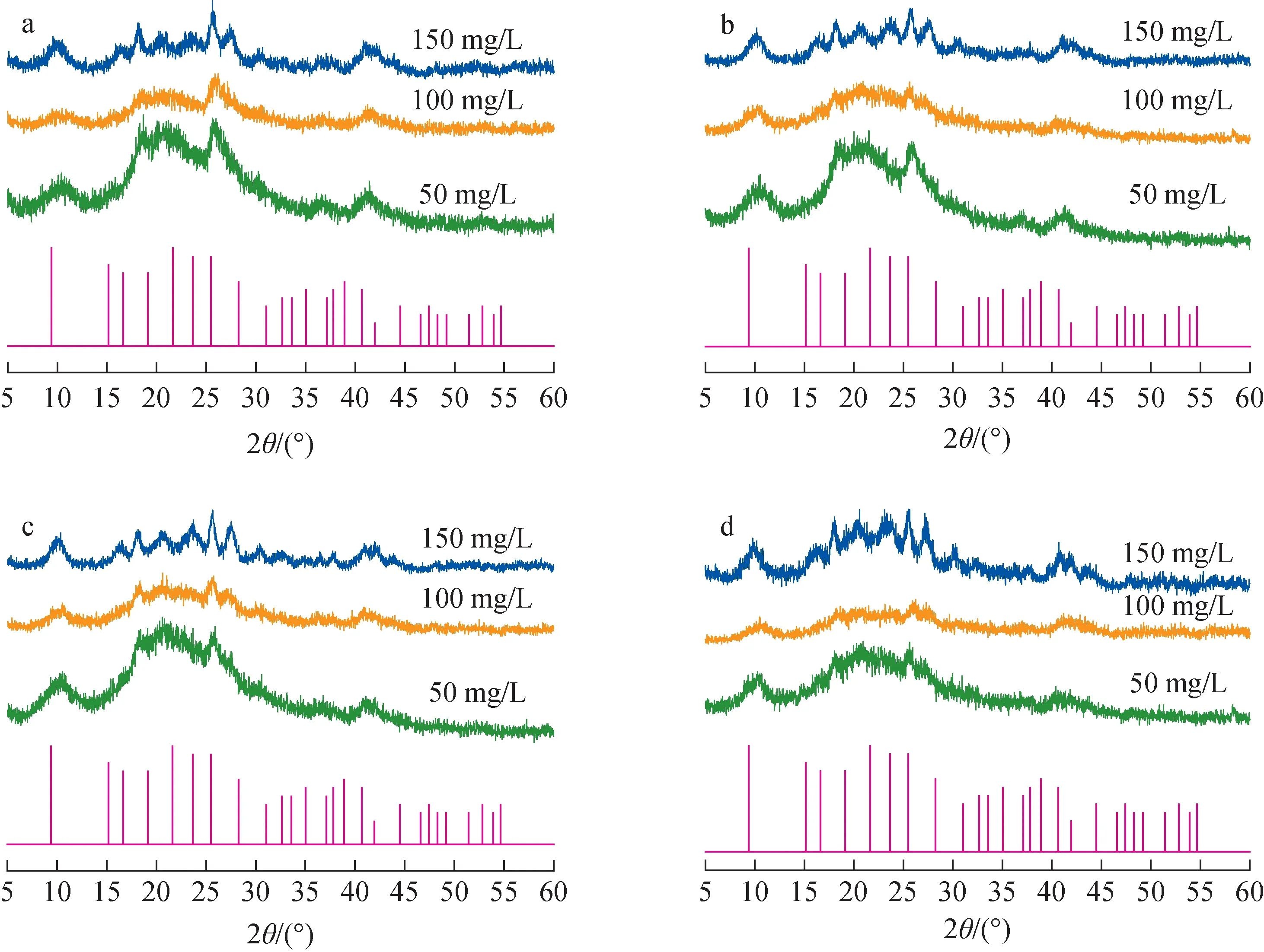
培养时间:a——12 h;b——24 h;c——36 h;d——48 h图1 不同U(Ⅵ)初始浓度下U(Ⅵ)矿化沉积物的XRD谱Fig.1 XRD patterns of U(Ⅵ) biomineralized sediment under different initial U(Ⅵ) concentrations
2) SGP浓度
pH=7.0、U(Ⅵ)初始浓度为150 mg/L时,不同浓度SGP下,U(Ⅵ)矿化沉积物的XRD谱示于图2。由图2可见,SGP浓度为25 mmol/L 时,生长稳定期(培养24 h)后衍射峰逐渐尖锐,沉积物从无定形产物明显转变为晶体矿物。随着SGP浓度的增加,沉积物向晶体矿物转变的时间逐渐提前。当SGP浓度增加至125 mmol/L及以上时,其对U(Ⅵ)矿化的促进效果达到饱和,无定形产物向晶体矿物转化的时间最快提前至生长对数期(培养12 h)。
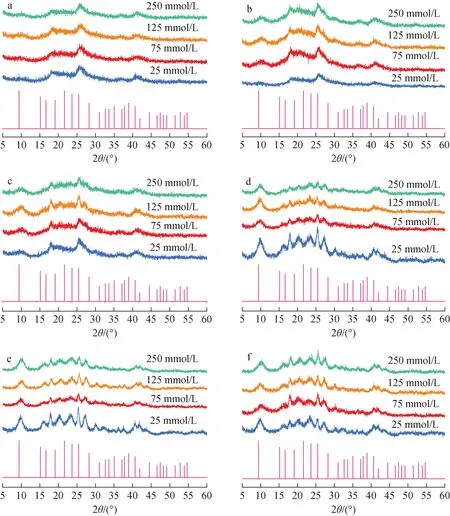
培养时间:a——8 h;b——10 h;c——12 h;d——24 h;e——36 h;f——48 h图2 不同SGP浓度下U(Ⅵ)矿化沉积物的XRD谱Fig.2 XRD patterns of U(Ⅵ) biomineralized sediment under different SGP concentrations
为进一步了解有机磷浓度对磷酸酶活性的影响,测定了磷酸酶在不同浓度SGP下的催化反应速率,结果如图3所示。由图3可见,SGP浓度小于25 mmoL/L时,磷酸酶催化反应速率随SGP浓度的增加而快速增加,表明磷酸酶代谢SGP产生磷酸盐的速率加快,有利于磷酸盐与U(Ⅵ)的络合沉积。而当SGP浓度大于125 mmol/L时,磷酸酶催化反应速率逐渐趋于饱和,代谢产生的磷酸盐与U(Ⅵ)矿化沉积的作用也逐渐趋于稳定,进一步证明无定形沉积物转变为晶体矿物的时间稳定在生长对数期(培养12 h)。

图3 磷酸酶对不同浓度SGP的催化分解速率Fig.3 Catalytic decomposition rate of phosphatase to different concentrations SGP
3) 初始pH值
SGP浓度为125 mmol/L、U(Ⅵ)初始浓度为150 mg/L时,不同初始pH值条件下U(Ⅵ)矿化沉积物的XRD谱示于图4。由图4可看出,与酸性(pH=5.5)条件相比,中性及碱性(pH=7.0、8.5)条件更有利于U(Ⅵ)的矿化。在此基础上进一步考察pH=7.0、8.5两种条件对U(Ⅵ)矿化的影响,结果示于图5,U(Ⅵ)初始浓度为150 mg/L。由图5可见,当体系的初始pH值从7.0增加到8.5时,U(Ⅵ)的矿化效果逐渐增强,即使SGP浓度只有25 mmol/L,Bacillussp.dwc-2仍能有效诱导U(Ⅵ)矿化,沉积物的结构从无定形转化为晶体的时间提前至生长对数期(培养8 h)。

图4 不同体系pH值下培养48 h时U(Ⅵ)矿化沉积物的XRD谱Fig.4 XRD patterns of U(Ⅵ) biomineralized sediment cultured for 48 h at different initial pH values

培养时间:a——8 h;b——10 h;c——12 h;d——24 h;e——36 h;e——48 h图5 不同体系pH值及SGP浓度下U(Ⅵ)矿化沉积物的XRD谱Fig.5 XRD patterns of U(Ⅵ) biomineralized sediment under different initial pH values and SGP concentrations
2.2 矿化产物的形貌及成分
初始pH=7.0、SGP浓度为125 mmol/L、U(Ⅵ)初始浓度为150 mg/L条件下所形成的U(Ⅵ)矿化沉积物中菌体的形貌及分布随矿化时间的变化如图6所示。由图6可看出,与U(Ⅵ)接触后,菌体原先光滑的表面逐渐皱缩以及粗糙。生长对数期(培养8 h),菌体表面已开始有颗粒状沉积物形成,随着培养时间的增加,U(Ⅵ)不断被菌体吸附,沉积物逐渐增多聚集,并附着在菌体表面。

图6 矿化过程中菌体的SEM图像及EDS分析结果Fig.6 SEM image and EDS analysis results of Bacillus sp.dwc-2 during biomineralization
沉积物的EDS分析结果显示,大片颗粒状矿物中所含元素包含C、N、O、P、U等。P和U的存在表明沉积物可能是Bacillussp.dwc-2诱导U(Ⅵ)矿化过程中产生的磷酸盐矿物。在生长衰亡期(培养24~48 h),营养缺乏和溶菌酶的作用会造成菌体结构瓦解,而U(Ⅵ)的存在可能会抑制溶菌酶的作用。这一结果提示,即使在衰亡期菌体活性下降并部分死亡,但完整的菌体结构仍可继续矿化U(Ⅵ)并将其固定在菌体表面,阻止U(Ⅵ)在环境中的迁移,这对于铀污染环境的生物修复具有重要意义。
2.3 矿化过程中的生物响应机制
1) 矿化过程中菌体的生长变化
不同条件下矿化过程中Bacillussp.dwc-2的生长变化如图7所示。由图7可看出,生长迟滞期至对数期(培养0~12 h),菌体生长与对照组中没有明显差距,仍可正常生长繁殖并诱导U(Ⅵ)的沉积/矿化。结合图1、2、5进一步分析可知,菌体处于生长迟滞期(培养0~4 h)时,数量还未形成规模,还不足以诱导U(Ⅵ)沉积/矿化。随着矿化时间的增加,U(Ⅵ)的矿化程度逐渐提升,并在生长对数期(培养8 h)形成一定量的沉积/矿化物。而在生长对数期至衰亡期(培养12~48 h),含U(Ⅵ)矿化组中细胞的活性明显低于无U(Ⅵ)对照组的细胞活性,且U(Ⅵ)浓度越高,细胞活性下降越快。细胞活性的变化可能会影响磷酸酶活性的表达和有机磷的代谢,从而影响其矿化行为。

图7 不同U(Ⅵ)初始浓度(a)和pH值(b)条件下矿化过程中的细胞活性Fig.7 Cell activity during biomineralization under different initial U(Ⅵ) concentrations (a) and pH values (b)
2) 矿化过程中磷酸酶活性及有机磷代谢的变化
不同条件下矿化过程中磷酸酶的活性变化示于图8。由图8a可知,生长迟滞期至对数期(培养0~12 h),含U(Ⅵ)矿化组中的磷酸酶表达了较高的活性,且高于对照组,提示U(Ⅵ)在一定程度上刺激了菌体磷酸酶活性的表达,且随着U(Ⅵ)浓度的增加,这种促进作用增强。但在生长衰亡期(培养24~48 h),含U(Ⅵ)矿化组中磷酸酶活性快速下降,且低于对照组。结合图7分析,这可能是因为细胞活性的下降在一定程度上影响了磷酸酶的活性。由图8b可知,含U(Ⅵ)培养基中,在生长迟滞期(培养0~4 h),中性(pH=7.0)条件下磷酸酶表现出最高的活性。随着矿化时间的增加,碱性(pH=8.5)条件下的磷酸酶活性快速增长,并在对数期(培养8 h)超过中性(pH=7.0)条件下的磷酸酶活性。在生长迟滞期至对数期(培养0~12 h),中性及碱性(pH=7.0、8.5)两种条件下的磷酸酶活性始终高于酸性(pH=5.5)条件。

图8 不同U(Ⅵ)初始浓度(a)和pH值(b)条件下矿化过程中的菌体磷酸酶活性Fig.8 Enzymatic activity of bacteria during biomineralization under different initial U(Ⅵ) concentrations (a) and pH values (b)
磷酸酶活性的变化会影响有机磷的代谢。磷酸盐浓度在矿化过程中的变化如图9所示。由于磷酸酶在分解SGP的过程中会产生磷酸盐,使得培养基中的磷酸盐浓度不断增加。但在生长衰亡期(培养24~48 h),由于磷酸酶活性降低,导致磷酸盐浓度的增速减小。磷酸酶代谢产生的磷酸盐将用于U(Ⅵ)的矿化沉积,磷酸盐的消耗量越高,U(Ⅵ)的矿化作用越强。图9a显示,随着U(Ⅵ)初始浓度的增加,培养基中磷酸盐的浓度在整个矿化周期始终低于未加U(Ⅵ)的对照组。U(Ⅵ)初始浓度越高,培养基中的磷酸盐浓度越低,即磷酸盐消耗量越高。由图9b可知,不同pH值条件下均有磷酸盐的消耗。中性及碱性(pH=7.0、8.5)条件下,生长迟滞期(培养0~4 h)已有磷酸盐的消耗,而在酸性(pH=5.5)条件下,磷酸盐则在10 h后开始逐渐消耗。

图9 不同U(Ⅵ)初始浓度(a)和pH值(b)条件下矿化过程中的溶液磷酸盐浓度Fig.9 Phosphate concentration in solution during biomineralization under different initial U(Ⅵ) concentrations (a) and pH values (b)
上述结果表明,较高的U(Ⅵ)初始浓度、中性和碱性条件更加有利于酶活性的表达和磷酸盐的消耗,进而有利于U(Ⅵ)的矿化沉积。这种促进作用主要发生在菌体生长的迟滞期至对数期(培养0~12 h)。因此当体系中U(Ⅵ)初始浓度较高,且处于中性及碱性条件时,U(Ⅵ)在菌体生长的对数期(培养8~12 h)即可有效矿化,这与2.1节所得结果相吻合。而在菌体的衰亡期(培养24~48 h),磷酸酶活性和SGP的代谢受到细胞活性的影响而下降,进而在一定程度上抑制了U(Ⅵ)的矿化。
3) 矿化过程中菌体对体系pH值的调节
细菌在生长和繁殖的过程中会调节体系pH值,而体系pH值的变化会影响酶的活性,进而影响U(Ⅵ)的矿化。不同条件下矿化过程中体系pH值的变化如图10所示。由图10可看出,随着矿化时间的增加,含U(Ⅵ)矿化组与无U(Ⅵ)对照组的pH值均呈上升趋势,并最终控制在近中性和弱碱性范围内。这表明菌体会调节体系pH值至适宜生长繁殖和有利于U(Ⅵ)矿化的范围内,该结果与2.1节所得结果相吻合。但在U(Ⅵ)初始浓度(图10a)和初始pH值(图10b)不同的U(Ⅵ)矿化组中,体系pH值的升高较无U(Ⅵ)对照组慢,表明U(Ⅵ)的沉积/矿化会影响菌体调节体系pH值的能力。
3 结论
本文通过考察初始pH值、SGP浓度、U(Ⅵ)初始浓度等因素对处于生长和繁殖阶段的Bacillussp.dwc-2诱导U(Ⅵ)矿化动力学行为的影响,得到如下结论。
1)Bacillussp.dwc-2可诱导U(Ⅵ)形成钠铀云母(NaUO2PO4·3H2O)晶质铀矿。
2) U(Ⅵ)的矿化效果随U(Ⅵ)初始浓度的增加而逐渐提升,在生长迟滞期及对数期(培养0~12 h),U(Ⅵ)会刺激菌体磷酸酶活性的表达,促进SGP的分解和磷酸盐的消耗,有利于U(Ⅵ)的矿化;在生长衰亡期(培养24~48 h),U(Ⅵ)初始浓度越高,细胞活性下降越快,磷酸酶活性的表达和SGP的分解受到抑制,阻止了U(Ⅵ)的矿化。
3) SGP浓度越高越有利于磷酸酶催化分解SGP的进行,U(Ⅵ)的矿化程度越明显,当SGP浓度增加至125 mmol/L及以上时,酶促反应速率达到饱和值,矿化沉积物转变为晶体矿物的时间稳定在生长对数期(培养12 h)。
4) 中性及碱性条件下,生长迟滞期至对数期(培养0~12 h)的菌体磷酸酶活性更高、增长速度快,有利于SGP的分解和U(Ⅵ)的矿化,当体系pH值从7.0提高至8.5时,沉积物转变为晶体矿物的时间可从对数期培养12 h提前至对数期培养8 h。
