早期不同能量比例肠内外营养支持对重型颅脑损伤病人营养指标和免疫功能的影响
2023-10-27余小琴王科何琦陈英
余小琴 王科 何琦 陈英
重型颅脑损伤会引发病人致残或致死[1]。Balakrishnan等[2]研究显示,重型颅脑损伤常处于高代谢的能量消耗状态,若能量补充不够或不及时,导致病人免疫力低下、营养不良及住院时间过长。有研究发现,重型颅脑损伤还可导致病人肠道生态屏障遭受破坏,一旦生态屏障受损,则引起一系列不良反应[2]。早期不同能量比例肠内外营养支持对重型颅脑损伤病人治疗效果及改善预后尤为重要,亦是降低病人死亡的关键[3]。早期肠内营养支持的方法不当可导致病人发生严重并发症甚至死亡[4]。本研究探讨早期不同能量比例肠内外营养支持对重型颅脑损伤病人营养指标和免疫功能的影响。
对象与方法
一、对象
二、方法
1.低能量组:于病人入院后置鼻胃管,伤后24小时予以肠内营养支持和肠外营养支持。总能量的50%由肠内营养支持,50%由肠外营养支持。肠内营养支持使用营养泵间断连续性泵入。起始速度以20 ml/h,24小时后增加至40 ml/h,如耐受性良好,48小时后增加至60 ml/h,最终速度可达到80 ml/h。肠外营养支持均由中心静脉导管用输液泵均速输入,24小时内完成。能量需要量和蛋白质需要量营养支持指导师意见为依据,每天25 kal/kg为病人的初始能量,后等病人病情平稳后,每天增加至30~35 kal/kg。15%为蛋白质供能比。
2.高能量组:使用营养泵间断连续性泵入。肠内营养支持的方式、起始速度及调控与低能量组相同,100 ml/h为最终可达到的速度。保障72小时至少达到营养目标量的60%。肠内营养泵控制量与浓度。能量需要量和蛋白质需要量营养支持指导师意见为依据,每天35 kcal/kg为病人的初始能量,后等病人病情平稳后,每天增加至35~40 kcal/kg。30%为蛋白质供能比。
当肠内营养制剂所提供蛋白质不能满足推荐摄入量时,以蛋白粉添加或18AA复方氨基酸注射液补充。肠外营养支持由葡萄糖和脂肪乳剂双能源供给,适当给予微量元素、维生素、水与电解质按出入量平衡给予,配置成全营养混合液滴入。两组研究对象的干预时间为10天,10天后根据病人胃肠道耐受情况及能量需求,血清营养指标情况,停止肠外营养支持以降低静脉感染并发症的发生率,充分保证病人肠道屏障功能。当肠内营养制剂所提供蛋白质不能满足推荐摄入量时,以蛋白粉添加或18AA复方氨 酸注射液补充。肠外营养支持由葡萄糖和脂肪乳剂双能源供给,适当给予微量元素、维生素、水与电解质按出入量平衡给予,配置成全营养混合液滴入。
3 .观察指标:主要营养指标血红蛋白(Hb)、总蛋白(PA)、血清白蛋白(Alb)、转铁蛋白(TF)[6]。于病人入院后和营养支持后10天收集清晨空腹外周静脉血。外周血T淋巴细胞亚群(CD3+、CD4+、CD8+及CD4+/CD8+):采用流式细胞计数仪进行检测。免疫球蛋白A(IgA)、免疫球蛋白M(IgG)、免疫球蛋白M(IgM):采用免疫散射比浊法进行检测。记录两组感染情况,如有无切口感染、肺部感染等。
4.预后:2个月后进行随访,按照格拉斯哥预后量表(GOS)评价其预后情况,分为5项,分别为恢复良好、轻度残疾、重度残疾、植物生存及死亡。预后良好例数=恢复良好+轻度残疾。
三、统计学分析

结果
1.营养指标情况对比:治疗前,低能量组和高能量组营养指标对比均无显著差异(P>0.05);治疗后,低能量组营养指标中Hb、TF、Alb及PA水平均高于高能量组,组间对比存在显著差异(P<0.05)。见表2。

表2 两组治疗前后营养指标情况对比
2.免疫指标对比:治疗前,低能量组和高能量组免疫功能指标对比均无显著差异(P>0.05);治疗后,低能量组IgA、IgG、IgM、CD3+、CD4+、CD8+及CD4+/CD8+均高于高能量组,组间对比存在显著差异(P<0.05)。见表3。
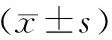
表3 两组治疗前后免疫指标对比
3.感染情况对比:治疗后,低能量组总感染率低于高能量组,差异有统计学意义(P<0.05)。见表4。
4.预后情况对比:治疗后,低能量组预后良好率高于高能量组,差异有统计学意义(P<0.05)。见表5。
讨论
重型颅脑损伤病人通常处于高分解状态下,是由于机体蛋白质和脂肪在应激状下大量分解以满足自身的需要所致[7]。Dickerson等[8]研究显示,人体处于应激状态下会引发内分泌系统、脑神经系统及免疫系统紊乱,一旦人体免疫功能紊乱,应激状态下的人体易出现脑神经、内分泌及免疫系统紊乱,而免疫功能紊乱会导致病人头部和肺部发生感染,直接影响病人治疗效果[9]。肠内营养对诸多疾病病人而言尤为重要[10]。
人体免疫功能指标以IgA、IgG、IgM为主,属于人体内活化B细胞分泌的效应物质[16],其中IgA为一种分泌型细胞和血清型细胞,血清型IgA的含量与IgG相似;分泌型IgA存在人体胃肠液中,属于肠黏膜局部免疫的重要组成部分,其作用为黏膜保护、抑制微生物粘附,最终达到病毒繁殖[17]。而IgM属于分子量最大的免疫球蛋白,是抗原刺激后出现的第一种抗体,可起到溶解细菌和血细胞作用。
相关研究表明,调节肠道可以改变人类的神经系统和精神治疗结果,创伤性脑损伤会导致肠道的变化,包括其结构、功能、微生物群和免疫功能,表明肠道菌群和大脑之间双向通信通路[18]。脑肠轴是大脑和胃肠道系统之间主要的双向通信通路,包含传入和传出信号,涉及神经元、激素和免疫通路。存在双向关系,称为微生物群-肠-脑轴。
本研究结果显示,早期低能量肠内外营养支持治疗后病人营养指标Hb、TF、Alb及PA水平均高于早期高能量肠内外营养支持。表明用低能量的肠内外营养支持可改善其营养情况,这可能与高能量组早期大量使用的营养液含有较多的乳清蛋白水解物等物质有关[19]。早期低能量肠内外营养支持治疗后病人IgA、IgG、IgM、CD3+、CD4+、CD8+及CD4+/CD8+均高于早期高能量肠内外营养支持治疗后的病人。分析原因为应激状态下人体多系统功能紊乱,特别是肠道功能会严重失调,高能量组高能量的摄入会加重肠道负担,不利于肠道功能的恢复和营养吸收;而低能量逐渐提高摄入量更有助于肠道功能的康复和营养物质的消化吸收。这一结果也提示,低能量肠内外营养支持对重型颅内脑损伤病人机体细胞免疫和体液免疫功能改善效果更为显著。早期低能量肠内外营养支持治疗后病人总感染率低于早期高能量肠内外营养支持。早期低能量肠内外营养支持治疗后预后良好率高于早期高能量肠内外营养支持。
综上所述,相较于早期高能量肠内外营养支持,早期低能量肠内外营养支持对重型颅内脑损伤病人的效果更为显著,可显著改善病人营养状况和免疫功能,降低感染率,预后效果良好,更能促进病人康复。
