松材线虫cul-1基因的表达特性与功能*
2023-10-27杨雪晴刘文义孙士淼周立峰胡加付
杨雪晴 刘文义 陈 静 孙士淼 周立峰 胡加付
(浙江农林大学 杭州 311300)
松材线虫病是由松材线虫(Bursaphelenchus xylophilus)寄生在松树体内引起的具毁灭性的森林病害,该病自1982年传入我国以来,扩散蔓延迅速,全国已有20多个省(区、市)发生,导致大量松树枯死,造成巨大的经济和生态损失,严重影响我国的森林生产和生态安全(陈凤毛等,2005;潘宏阳等,2009;王永生,2019)。在25 ℃环境下,松材线虫每个世代只需5天即可完成,每对成年线虫在短短2天内能够繁殖20万条松材线虫(王曦茁等,2018);30 ℃时,其生长周期缩短至3 天。松材线虫病流行的原因之一即是松材线虫生长发育速度快、交配效率高(陈茜等,2022),研究松材线虫中与生长发育相关的基因具有重要意义。
对松材线虫进行生物信息学分析发现,Cullin蛋白家族成员cul-1基因或在调控虫体生长发育方面发挥着重要作用,Cullin蛋白家族成员作为支架参与泛素连接酶E3的构成,共同参与蛋白质泛素化级联反应(高志远等,2021)。哺乳动物Cullin蛋白家族包括8个成员(cul-1至cul-7和PARC),均含有保守的Cullin同源结构域(Cullin homology domain,CH),其中cul-1至cul-7 组装多亚基复合物 (CRL,Cullin-ring E3 ubiquitin ligase), Cullin 蛋白将底物靶向单元(通常通过接头蛋白)和 CRL 中的 RING 组件连接起来,由Cullin 组织的 CRL 将底物定位在靠近 RING 结合的E2 泛素结合酶的位置,该酶催化泛素向底物转移(李衍辉等,2015)。 此外,Cullins 与泛素样分子Nedd8 结合可调节相应 CRL 复合物的激活,这可能是通过 Cullin 的羧基末端尾部和 CRL 的 RING 亚基之间相互作用的构象调节(Panet al.,2004)。CRL 靶向多种底物,对一系列生物过程产生影响,包括细胞生长、发育、信号转导、转录控制和基因组完整性。
在黑腹果蝇(Drosophila melanogaster)、秀丽隐杆线虫(Caenorhabditis elegans)、拟南芥(Arabidopsis thaliana)和酵母(yeast)中均发现cul-1(Sarikaset al.,2011),Kipreos 等(1996)将 Cullins 鉴定为参与线虫细胞周期调控的基因家族。在模式线虫(C. elegans)中,cul-1是细胞周期负调控所必需的。细胞周期蛋白依赖性蛋白激酶(cyclin-dependent kinases,CDK)与细胞周期蛋白复合时形成全酶的催化亚基,是真核生物细胞周期进程的主要调节因子(Nigg, 1995)。这些激酶受多种机制调节,通过磷酸化关键底物产生连续活性波,启动细胞周期调控。虽然一些CDK存在于整个细胞周期中,但不同细胞周期蛋白基因在每个阶段均有表达(Motokuraet al.,1993;Nasmyth,1993)。在秀丽隐杆线虫cul-1突变体中,不同组织类型的细胞无法产生或响应细胞周期退出或程序性细胞死亡的正常发育信号,受影响的胚细胞过度分裂,产生小细胞,这些胚胎在早期分裂时看起来完全正常,但因细胞过多而停滞,使秀丽隐杆线虫无法正常生长发育(Kipreoset al.,1996)。综上说明,cul-1基因在生长发育过程起着重要作用。
为探究松材线虫的生长发育机制,本研究对松材线虫Bxy-cul-1基因进行功能探索。首先,通过生物信息学分析,确定其同源性并明确其进化地位,采用原位杂交和实时荧光定量PCR技术明确Bxy-cul-1基因的表达特性,利用RNA干扰技术阐述该基因的生物学功能,揭示该基因在松材线虫生长发育的重要作用,验证Cullin蛋白的重要功能,研究结果为从生长发育角度探索特异性的线虫种群增长控制措施提供理论基础。
1 材料与方法
1.1 供试线虫和培养条件
本研究所用松材线虫由中国林业科学研究院森林生态环境与自然保护研究所提供,是从浙江省宁波市马尾松(Pinus massoniana)的病死松木中分离获得的,编号为NXY61株系。将松材线虫接种到长满灰葡萄孢菌(Botrytis cinerea)的马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)平板上,25 ℃黑暗恒温条件下培养。
1.2 不同龄期同步线虫的获得
将在PDA平板上25 ℃黑暗恒温条件下培养3 天的松材线虫,采用Baermann漏斗分离出来,分离出的线虫用无菌水清洗2~3次后置于培养皿中,25 ℃黑暗恒温环境放置1~2 h让其产卵,利用松材线虫卵的黏壁性,倒掉上清,即可从培养皿中收集到同步卵。于25 ℃黑暗恒温环境下让其孵化24 h后,获得同步的2龄(J2)幼虫,收集含有2龄虫的液体低速离心3 min,然后将其接种到长满灰葡萄孢菌的PDA平板上,25 ℃分别培养29、48、72 h,随后分别采用Baermann漏斗分离出同步3龄(J3)幼虫、4龄(J4)幼虫和成虫(Xuet al., 2014; Zhouet al., 2020)。
1.3 Bxy-cul-1基因的克隆
采用TRIZOL法从每个样品中(不同发育阶段的松材线虫)提取总RNA,使用NanoDrop®ND-2000超微量紫外分光光度计(Thermo Fisher Scientific Inc.,Waltham,MA,USA)进行分析。反转录使用Prime-Script™ RT reagent Kit with gDNA Eraser(TaKaRa Bio Inc.,Shiga,Japan)试剂盒,以获得cDNA。设计特异性引物,扩增松材线虫的Bxy-cul-1基因,扩增体系及条件参照陈莎妮等(2021)。将PCR 扩增产物克隆pGEM®-TEasy载体上,送往北京擎科生物有限公司测序。
1.4 Bxy-cul-1基因的生物信息学分析
根据测序获得的核苷酸序列预测Bxy-cul-1基因的蛋白序列,利用NCBI保守域数据库确定其保守结构域 (https://www.ncbi.nlm.nih.gov/cdd/)(Marchler-Baueret al.,2017);使用ExPASy(https://web.expasy.org/cgi-bin/protparam/protparam)预测蛋白质的理化性质;运用PRABI网站的SOPMA程序对蛋白质的二级结构进行预测;利用Swiss Model(http://swissmodel.expasy.org/)进行三维结构建模,并采用PyMOL软件进行可视化和编辑;使用DNAMAN 8.0软件进行氨基酸序列比对,采用MEGA10邻接法进行系统发育分析。
1.5 原位杂交试验
为明确Bxy-cul-1基因的时空表达模式,采用地高辛标记的探针对松材线虫不同发育阶段进行mRNA原位杂交试验。根据目的基因的cDNA序列,利用Primer Premier 5.0设计目的基因正反向引物(表1),分别将其正反向引物与M13正反向引物(表1)配对进行PCR反应,以鉴定目的片段的插入方向。使用DIG-RNA标记试剂盒(Roche Gmbh,Mannheim,Germany)参照使用说明进行ssRNA制备。原位杂交试验的具体步骤参考Motohashi 等(2006)方法并稍作改动,染色完成后使用琼脂糖固定垫固定线虫样本,制备临时玻片;在将光学显微镜下观察线虫的染色部位,对线虫整虫及染色部位进行记录和拍照。
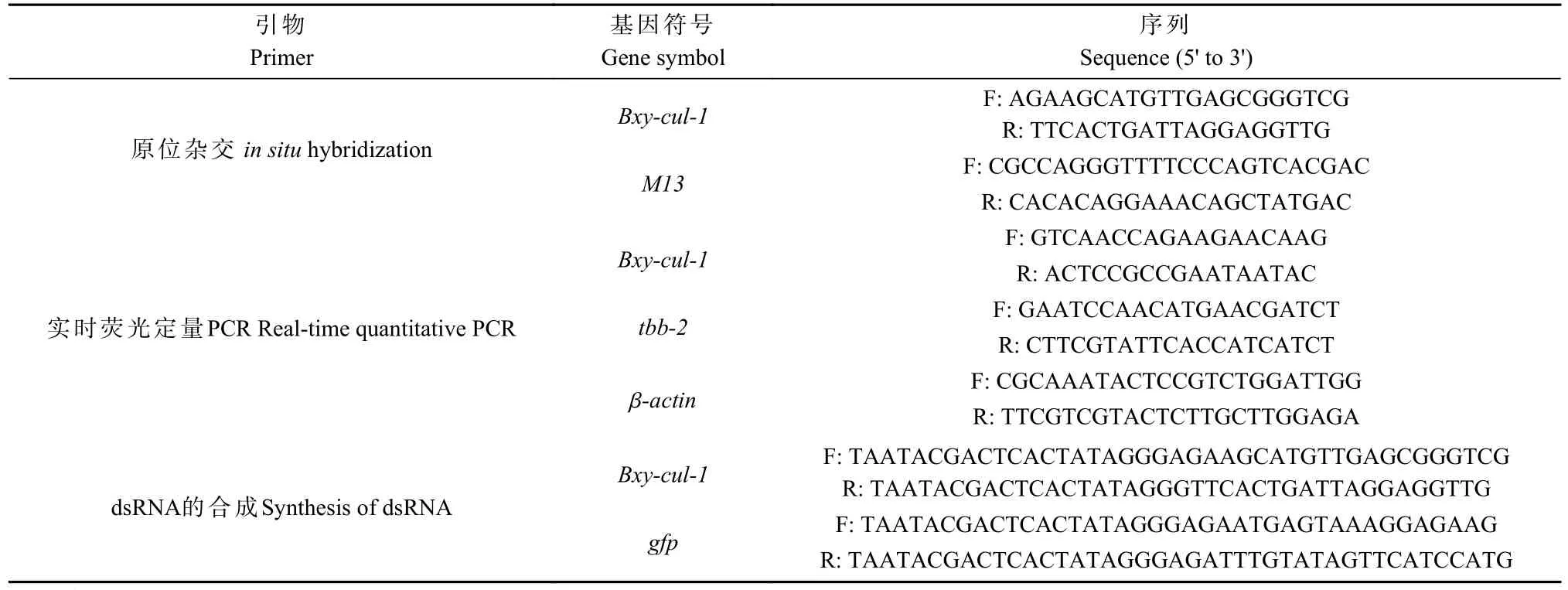
表1 本研究使用的引物①Tab. 1 Primers used in the present study
1.6 实时荧光定量分析
使用实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)技术分析Bxy-cul-1基因在松材线虫不同发育时期的表达水平。利用Beacon Designer 7.0设计Bxy-cul-1的RT-qPCR引物(表1),以tbb-2、βactin作为内参基因(Zhouet al,2021),在ANALYTIK JENAAG qTOWER 2.2 荧光定量 PCR 仪进行SYBR Green RTqPCR 试验,反应体系(20 µL)为:TB Green Premix ExTaqII 10 µL、cDNA模板2 µL、上下游引物 F(10 µmol·L-1)各0.8 µL、灭菌ddH2O补平至20 µL。RT-qPCR 扩增程序:95 ℃预变性5 min;95 ℃ 30 s,60 ℃30 s,40个循环。RT-qPCR 试验结果分析采用 2-ΔΔCt法,取2个内参的几何平均值计算干扰效率,具体计算方法参照 Milstein 等(2013)。不同龄期样品分别进行3次生物学重复,每个样品设置4个技术复孔。
1.7 RNA干扰试验
1.7.1 dsRNA的合成 以公司测序返回的质粒DNA为模板,将含有T7启动子(周天鸿等,2000)的特异性引物(表1)对Bxy-cul-1基因和外源gfp基因(孟和等,2004)进行PCR扩增并进行胶回收,以获得含有T7启动子的目的片段。根据MEGAscript®T7 High Yield Transcription Kit说明书体外合成dsRNA,并用NanoDrop®ND-2000超微量紫外分光光度计测定样品。
1.7.2 RNAi浸泡试验 将松材线虫洗涤浸泡在干扰液中,25 ℃黑暗环境下处理24 h。将相同数量的松材线虫浸泡在缓冲液中,进行相同处理,作为对照组。每组均含有4 µL 5×soaking buffer,干扰液中的dsRNA终质量浓度为0.6 µg·µL-1,最后用ddH2O定容至20 µL,现配现用(马芮等,2022)。
1.7.3 孵化率的统计 将在PDA平板上25 ℃黑暗恒温条件下培养3天的松材线虫成虫采用Baermann漏斗分离出来,分离出的线虫用无菌水清洗2~3次,将线虫悬浮液(此时的雌虫大部分处于产卵期)吸入到载玻片上,置于25 ℃黑暗环境让其产卵1~2 h,之后用无菌水洗去线虫,即可获得同步卵,向载玻片上的卵分别滴加干扰液和对照液,黑暗环境处理24 h后,在光学显微镜下观察,统计其孵化率,对照组和处理组各3~4次重复。
1.7.4 运动情况和性状观察 浸泡在干扰液中的同步线虫处理24 h后,首先将干扰液吹打混匀,接着吸出1 µL线虫悬浮液到载玻片上,加无菌水稀释静置10 min,在光学显微镜下观察虫体活力情况,并对松材线虫30 s之内的头部摆动频率进行计数,对照组和处理组各3次重复,每次对液滴中的10条线虫进行头摆计数,并对每组线虫性状进行观察记录(陈茜等,2022)。
1.7.5 发育进度试验 将怀卵的雌性成虫吸入到载玻片上,25 ℃黑暗恒温环境产卵1~2 h,然后用无菌水洗去线虫,获得同步卵,接着将获得的同步卵在黑暗环境培养24 h后,孵化出2龄虫,向载玻片上的2龄虫分别滴加干扰液和对照液,对照组和处理组各3次重复,黑暗环境处理24 h后,将干扰组和对照组的2龄虫分别接至长满灰葡萄孢的PDA平板上继续培养72 h,72 h后采用Baermann漏斗将松材线虫从平板中分离,离心,然后在Zeiss(Observer.A1)显微镜下观察干扰组和对照组的虫态。
2 结果与分析
2.1 生物信息学分析
2.1.1Bxy-cul-1基因结构功能域的分析 以松材线虫cDNA 为模板,采用特异性引物 PCR 扩增后得到Bxy-cul-1基因CDS全长为 2 292 bp。NCBI ConservedDomains预测其主要功能区为Cullin、Cullin_Nedd8,是泛素依赖性蛋白质降解所需的结构相关蛋白质家族,参与线虫细胞周期调节,如图1a所示。
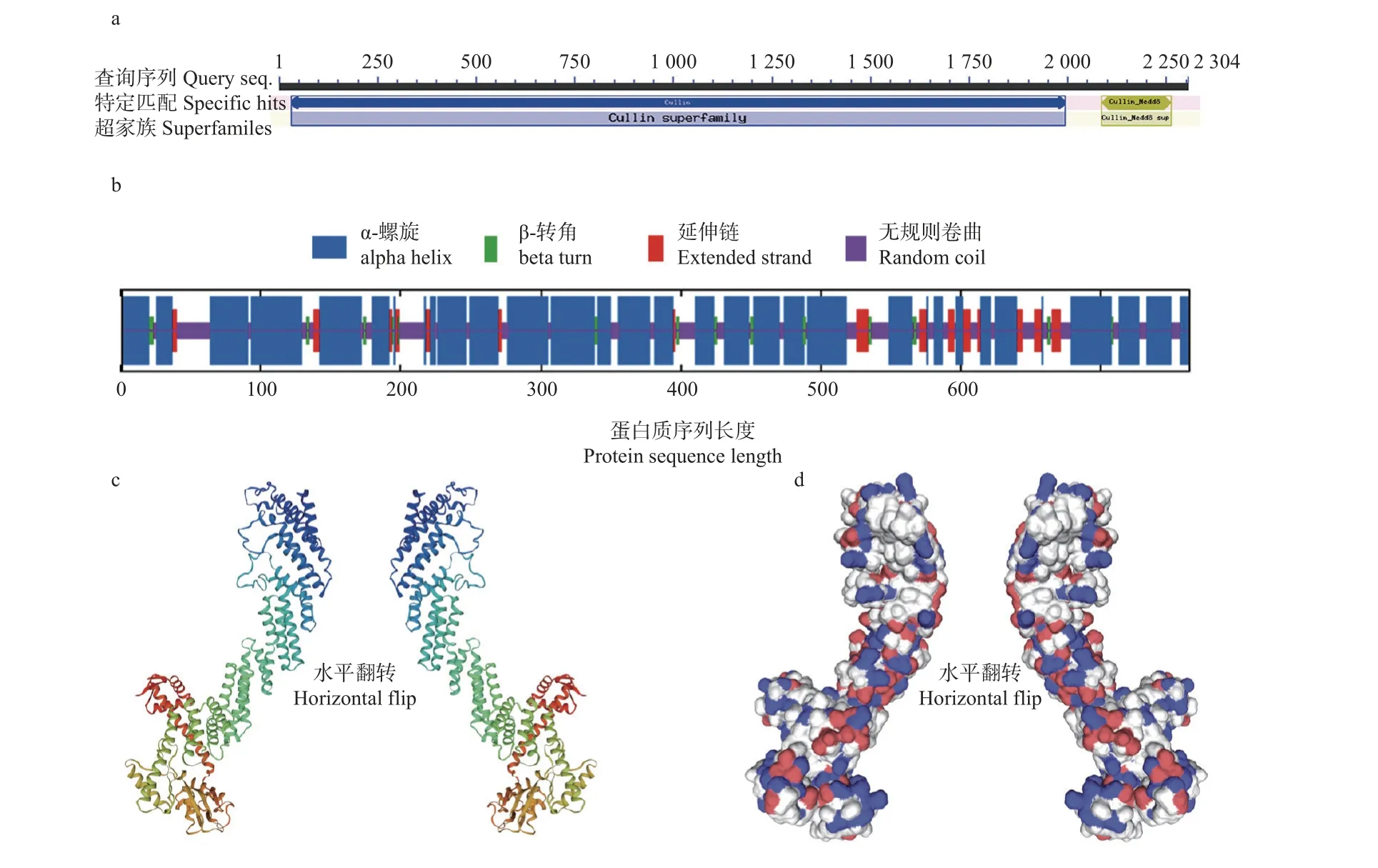
图1 Bxy-cul-1基因的生物信息学分析Fig. 1 Bioinformatics analysis of Bxy-cul-1 genea: Bxy-cul-1保守结构域Structure and functional domain analysis of Bxy-cul-1;b: Bxy-cul-1蛋白的二级结构预测 Secondary structure prediction of Bxy-cul-1;c: Bxy-cul-1 蛋白三级结构卡通图Bxy-cul-1 protein in cartoon representation;d: Bxy-cul-1 蛋白三级结构表面表征图Bxy-cul-1 protein in surface representation.
2.1.2Bxy-cul-1编码蛋白质的理化性质分析ExPASy ProtParam工具预测基因编码蛋白的分子式为C6914H11529N2301O2851S517,分子质量为189 083.32 Da,理论等电点为4.90,推测在哺乳动物网织红细胞体外培养半衰期为4.4 h,在酵母体内培养半衰期大于20 h,在大肠杆菌体内培养半衰期大于10 h,不稳定指数(II)为42.47,是一类不稳定蛋白。
2.1.3Bxy-cul-1编码蛋白质的二级和三级结构预测SOPMA程序预测的蛋白质二级结构分析结果表明,该蛋白的二级结构主要由α-螺旋(alpha helix)结构构成,Bxy-cul-1编码的蛋白质二级结构中,α-螺旋在多肽链中共有 501个,占比65.66%,β-转角(beta turn)共有27个,占比3.54%,延伸链(extended strand)共有58个,占比7.60%,无规则卷曲(random coil)177个,占比23.20%。该基因α-螺旋是多肽链中大量的结构元件,散布在整个肽链中,其次为无规则卷曲,然后为延伸链,β-转角最少,如图1b所示。在SWISS-MODEL上对Bxy-cul-1蛋白进行同源建模,结构图如图1c、d所示,该基因编码蛋白结构与Cand1-Cul1-Roc1复合物的晶体结构1u6g.1最为相似,GMQE为0.72,QMEAN为0.68 ± 0.05,蛋白序列一致性为47.06%,这表明预测结果可信度较高,蛋白模型匹配度较好,该基因编码蛋白属于Cullin蛋白家族。
2.1.4Bxy-cul-1的多重比对及系统发育树构建 利用DNAMAN软件将Bxy-cul-1基因所编码的氨基酸序列与Caenorhabditis elegans(NP_499 309.1)、Caenorhabditis briggsae(XP 045096468.1)、Bursaphelenchus okinawaensis(CAD5227534.1)、Ditylenchus destructor(KAI1730446.1)、Aphelenchus avenae(KAH7719034.1)、Loa loa(XP_020303961.1)、Brugia malayi(XP_042932007.1)、及Wuchereria bancrofti(EJW 84 073.1)的氨基酸序列进行多重序列比对,结果如图2a所示,Bxy-cul-1基因的氨基酸序列与不同线虫cul-1基因的氨基酸序列具有较高保守性。利用 MEGA 软件,采用邻接法构建系统发育树,该进化树包含Bursaphelenchus、Aphelenchus、Brugia 、Caenorhabditis等属, 涉及 10 个物种。由图2b可知,Bxy-cul-1基因氨基酸序列与多种线虫的cul-1氨基酸序列聚类在一起,与黑腹果蝇的cul-1氨基酸序列区别开来,进一步证实线虫cul-1基因的同源性。其中,Bxy-cul-1基因与冲绳线虫基因亲缘关系较近,这为Bxy-cul-1基因的生物学研究提供了参考。


图2 Bxy-cul-1 基因序列比(a)对及系统发育分析(b)Fig. 2 Bxy-cul-1 gene sequence alignment (a) and phylogenetic analysis (b)a: Bxy-cul-1基因序列比对The sequence alignment of Bxy-cul-1; b: Bxy-cul-1系统发育分析。分支数字表示支持率,比例尺表示进化距离(每个位置 0.1 个替换)Phylogenetic analysis of Bxy-cul-1. The branch number indicated the support rate; scale bar indicates evolutionary distance (0.1 substitutions per position).
2.2 Bxy-cul-1基因的时空动态表达特性
2.2.1 原位杂交试验 原位杂交结果如图3 所示,其具体表达特性为:Bxy-cul-1基因从松材线虫胚胎期开始表达,并贯穿整个发育阶段。胚胎期全胚胎表达(图3a);2龄期广泛表达(图3c);胚胎期、2龄期染色较深,说明Bxy-cul-1在以上龄期表达量较高。在 3龄期的肠道、性腺及附近的体壁肌肉表达(图3d);在 4龄期的性腺及尾部表达(图3e)。在成虫期,Bxy-cul-1基因分别在松材线虫雄虫的腹部、交合刺和尾部表达(图3f);雌虫的卵母细胞及阴户部位表达(图3g)。
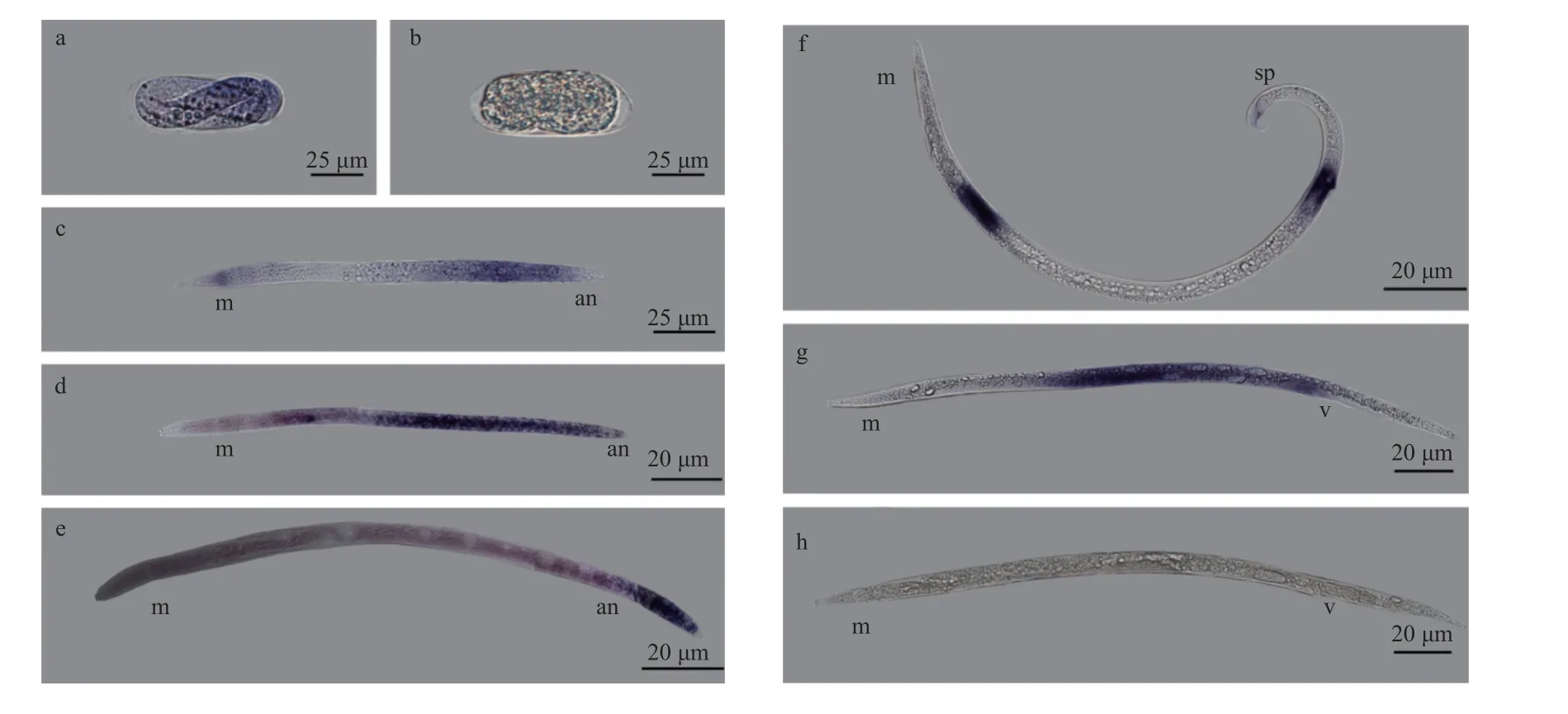
图3 Bxy-cul-1基因在松材线虫不同发育阶段的原位杂交结果Fig. 3 Results of in situ hybridization of Bxy-cul-1 gene at different developmental stages of Bursaphelenchus xylophilusa:胚胎Embryo;c:2龄幼虫The second stage of juvenile;d:3龄幼虫The third stage of juvenile;e:4龄虫The fourth stage of juvenile;f:雄性成虫Adult male;g:雌性成虫Adult female;b:胚胎(对照组)Embryo(CK);h:雌性成虫(对照组)Adult femal(CK).m:食道球Metacorpus;v:阴户Vulva;sp:交合刺Spicules;an:肛门Anus.
2.2.2 RT-qPCR试验分析 如图4所示,Bxy-cul-1基因在2龄期表达量最高,与其他龄期相比差异显著,与原位杂交结果相对应;胚胎期表达量也较高;3龄期、4龄期和成虫期表达量逐渐降低,其中,成虫期表达量最低。
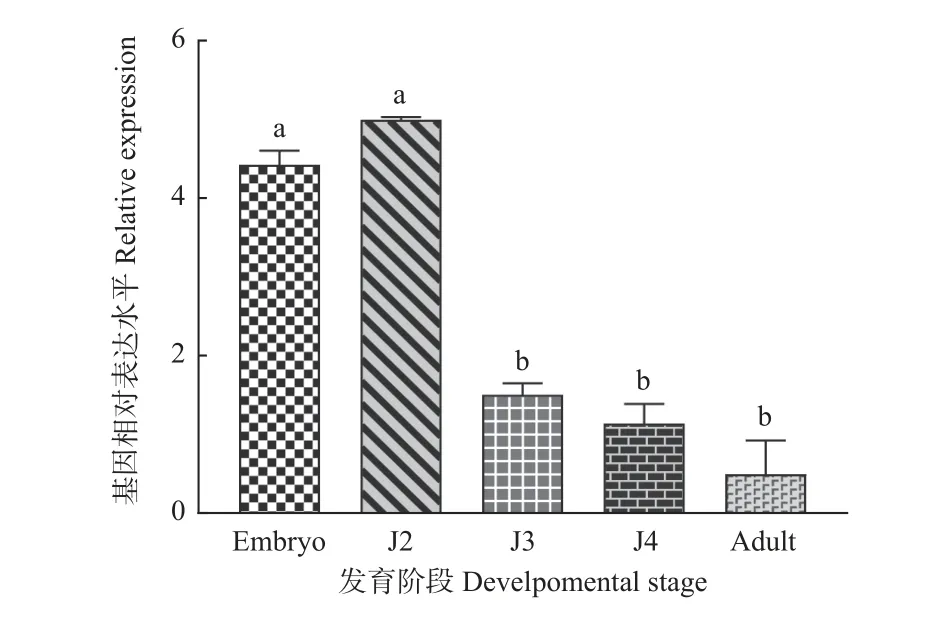
图4 Bxy-cul-1基因在松材线虫不同发育阶段的表达水平Fig. 4 Expression level of Bxy-cul-1 indifferent stages of Bursaphelenchus xylophilusEmbryo:胚胎期Embryo stage;J2:2龄时期The second stage of juvenile;J3:3龄时期The third stage of juvenile;J4:4龄时期The fourth stage of juvenile;Adult:成虫期Adult stage. 不同小写字母表示差异显著(P<0.05)The adult stage. Different lowercase letters meansignificant difference at 0.05 level.
2.3 基因功能
2.3.1Bxy-cul-1基因干扰效率分析 RT-qPCR检测Bxy-cul-1基因在不同龄期干扰效率的结果如图5所示,gfp对照组与对照组相比,线虫的Bxy-cul-1基因表达略有下降,但差异不显著;与处理组相比,Bxycul-1基因的表达量差异显著下降(P<0.05),胚胎期、2龄期以及3龄期目的基因均下降50%以上,4龄期下降44.33%,成虫期下降22.73%,说明经dsRNA处理后,松材线虫各龄期的Bxy-cul-1基因表达水平受到抑制,且表达量差异显著。

图5 利用荧光定量PCR分析RNAi效率Fig. 5 The RNAi efficiency quantified by RT-qPCREmbryo:胚胎期Embryo stage;J2:2龄时期The second stage of juvenile;J3:3龄时期The third stage of juvenile;J4:4龄时期The fourth stage of juvenile;Adult:成虫期Adult stage. **, P <0.01; *, P <0.05. Embryo**, P= 0.001;J2**, P= 0.006;J3**, P =0.008;J4*, P =0.01;Adult*, P =0.03.
2.3.2Bxy-cul-1基因对胚胎的影响 对松材线虫的同步胚胎干扰24 h,处理组的胚胎孵化率为84.36%,与对照组(94.85% ± 0.72%)相比下降10.49%(N=9,df=34,t=5.116,P<0.05),未孵化出的胚胎大多停留在1龄末期,虫体腹部形成畸形肿大,不能突破卵壳,如图6c、d所示,推测该基因可能参与调控松材线虫胚胎的细胞分裂、细胞生长,影响其生长发育,进而导致干扰后胚胎孵化率降低。部分孵化出来的2龄虫也出现畸形性状,畸形虫无法正常伸展,中部食道腺异常膨大,尾部蜷缩,如图6g、h所示。

图6 Bxy-cul-1基因的生物学功能Fig. 6 Biological function of Bxy-cul-1 genea:对照组胚胎Control embryo;b:gfp对照组胚胎gfp control embryos;c、d:用特定 dsRNA 浸泡胚胎 24 h后出现的畸形胚胎Malformed embryos after soaking embryos for 24 h with specific dsRNA;e:对照组孵化出的2龄虫J2 worms hatched from the control group;f:gfp对照组孵化出的2龄虫J2 worms hatched from the gfp control group;g、h:孵化出的畸形2龄虫The hatched deformed J2 worms;i:对照组2龄虫Control group J2 worms;j:gfp对照组2龄虫gfp control group J2 worms;k、l:用特定 dsRNA 浸泡2龄虫24 h后出现的畸形2龄虫Malformed J2 worms appearing after soaking J2 worms with specific dsRNA for 24 h.
2.3.3Bxy-cul-1基因对2龄虫的影响 对松材线虫的2龄虫干扰24 h,结果如图6k、l所示,与对照组相比,部分处理组的2龄虫出现畸形性状,畸形虫体形短小,头部、食道腺异常膨大,尾部和腹部扭转在一起,虫体无法正常运动。
2.3.4Bxy-cul-1基因对虫体活力的影响 为研究Bxycul-1基因对虫体活力的影响,对处理组的虫体头部摆动频率进行统计,结果如图7所示,胚胎孵化出的2龄虫对照组的头摆频率为每30 s 18.20次,干扰后则下降至每30 s 14.93次;2龄虫对照组的头摆频率为每30 s 17.60次,干扰后则下降至每30 s 12.70次;3龄虫对照组的头摆频率为每30 s 26.50次,干扰后下降至每30 s 22.50次;4龄虫头部摆动频率没有明显变化。胚胎孵化出的2龄虫、2龄虫以及3龄虫头部摆动频率与对照组相比大大降低,且差异显著(胚胎孵化出的2龄虫:N=30,df=58,t=5.008,P<0.05;2龄虫:N=10,df=18,t=4.636,P<0.05;3龄虫:N=10,df=18,t=2.813,P<0.05),虫体表现出活跃度降低、运动缓慢的现象。
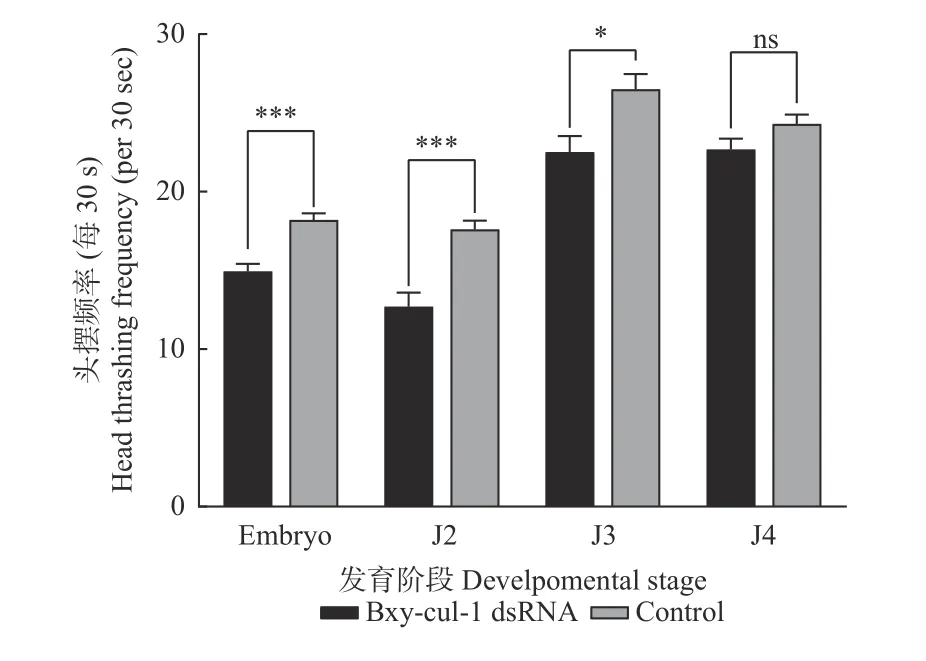
图7 Bxy-cul-1基因干扰后的头部摆动频率Fig. 7 Head swing frequency of Bxy-cul-1 gene interference Embryo:胚胎期Embryo stage;J2:2龄时期The second stage of juvenile;J3:3龄时期The third stage of juvenile;J4:4龄时期The fourth stage of juvenile;数据为来自3个独立个体平均值±标准误值Data are shown as mean ± SE of tissues from three separate individuals. ***, P <0.001; **, P <0.01;*, P <0.05. Embryo***, P= 0.000 1;J2***, P= 0.000 3;J3*, P=0.012 5.
2.3.5Bxy-cul-1基因对发育进度的影响 为研究干扰后对松材线虫生长发育的影响,进行松材线虫Bxy-cul-1 dsRNA发育进度试验。如图8所示,对照组的2龄虫接至长满灰葡萄孢的PDA平板上培养3天后,2龄虫全部发育至成虫;而干扰组的2龄虫并未发育至成虫,仍然是2龄虫。将其继续培养观察发现:第4天仍是2龄虫;第5天为2龄虫和3龄虫,占比分别为75.54%、24.46%;第6天为2龄虫、3龄虫和4龄虫,占比分别为61.45%、15.09%、23.46%;第7天出现成虫,但仍存在2、3和4龄虫,混虫中2龄虫占34.50%,3龄虫占28.65%,4龄虫占14.03%,成虫占22.82%。由此可知,对照组的2龄虫发育至成虫仅需要3天,而干扰组的2龄虫发育至成虫需要7 天,其生长发育速度大大降低。
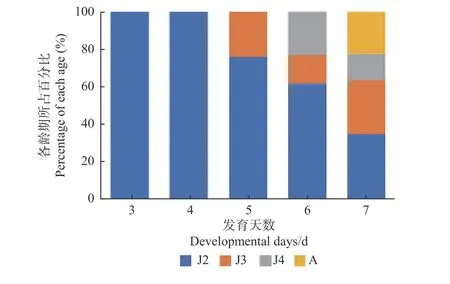
图8 Bxy-cul-1基因干扰后的发育进度Fig. 8 Developmental progress after Bxy-cul-1 gene interferenceJ2:2龄时期The second stage of juvenile;J3:3龄时期The third stage of juvenile;J4:4龄时期The fourth stage of juvenile;A:成虫期Adult stage.
3 讨论
本研究首次从松材线虫中克隆获得Bxy-cul-1基因,其基因CDS全长 2 292 bp,编码 763 个氨基酸, 是Cullin 蛋白家族中的一员。结合生物信息学方法对其氨基酸序列进行分析,结果表明Bxy-cul-1基因的氨基酸序列与其他线虫的cul-1基因的氨基酸序列具有较高保守性。构建系统发育树显示,松材线虫cul-1基因与冲绳线虫cul-1基因位于同一分支,这为研究松材线虫cul-1基因提供参考。
利用原位杂交和RT-qPCR技术,检测到Bxy-cul-1在松材线虫不同发育阶段均有表达,且二者结果基本吻合。Bxy-cul-1基因在2龄期表达水平较高,且分布幼虫全身,这可能因为该时期线虫的生殖系细胞在整个胚胎后期持续分裂(Kimbleet al.,1979),且松材线虫开始取食,是生长发育的活跃期(叶为民等,1993),该基因广泛参与松材线虫2龄期的细胞分裂、生长发育过程。
采用RNAi技术研究该基因的功能,发现Bxy-cul-1在RNAi组中的表达量显著低于对照组,这表明dsRNA能有效降低Bxy-cul-1的表达水平。松材线虫被干扰后出现胚胎孵化率下降、部分胚胎和J2虫致畸,且畸形虫体形短小以及发育进度减缓的现象,说明Bxy-cul-1基因和松材线虫胚胎的发育以及个体生长发育密切相关。类似的功能在其他物种中也有报道。敲除小鼠(Mus musculus)cul-1基因,其胚胎在第6.5天原肠胚形成之前发育停止,cul-1基因小鼠敲除试验揭示其在细胞周期进程和早期胚胎发生中不可或缺的作用(Wanget al.,1999)。在秀丽隐杆线虫中,cul-1基因是细胞周期负调控所必需的。在cul-1突变体中,不同组织类型的细胞无法产生或响应细胞周期退出或程序性细胞死亡的正常发育信号,受影响的胚细胞过度分裂,产生小细胞,这些胚胎在早期分裂时看起来完全正常,但因细胞过多而停滞,使秀丽隐杆线虫正常的生长发育受影响。干扰沉默该基因还会使其幼虫出现组织增生、腹侧中体扩张、肌肉增生等现象(Sulstonet al.,1977;Kipreoset al.,1996)。
Cullin 家族蛋白参与多种功能,包括细胞周期控制、DNA 复制和发育等(田烨等,2013), 并且Cullin家族蛋白的主要生理功能已通过对多种模式生物(包括小鼠、果蝇和秀丽隐杆线虫)的基因敲除试验进行揭示(Sarikaset al.,2011)。Arai等(2003)在确定cul-7是一种泛素连接酶亚基后,还获得cul-7敲除小鼠,结果发现小鼠出生后由于呼吸窘迫而死亡,胚胎发育从12.5天开始表现出明显生长阻滞现象。Fbx29是一种F-盒蛋白,其可与cul-7组装成SCF样的泛素连接酶。对Fbx29基因敲除小鼠的观察发现有2/3后代在胚胎期死亡,1/3后代可正常出生并发育到成年,但个体较小(郭晓强等,2010)。Fbx29敲除小鼠显示出子官内生长停滞和胎盘发育异常,这与cul-7基因缺陷小鼠表型非常类似(Tsunematsuet al.,2006)。人类cul-7突变也可造成相应疾病的发生,3-M综合征(3-M syndrome)是一种常染色体隐性遗传病,其特征是出生前后出现生长阻滞,出生后还常常伴有面部畸形,头围大,但患者智力和内分泌功能正常(Huberet al.,2005;2009)。对于黑腹果蝇的研究发现,cul-2、cul-5与卵巢的发育有关,cul-2在所有的生殖系细胞中广泛表达,cul-2缺失后表现为多种发育缺陷,主要是生殖细胞的减少和滋养细胞的变性,而cul-5缺失后也观察到了相似的表型(Yoheiet al.,2007)。本研究仅揭示cul-1基因在松材线虫中的作用,后续会继续探究Cullin 家族其他成员在线虫生长发育中的调控功能,完善该基因家族的功能多样性,为进一步研究松材线虫分子生物学提供分子理论基础。
4 结论
松材线虫Bxy-cul-1基因是Cullin蛋白家族中的一员,在松材线虫各发育阶段均有表达,发育初期广泛表达,表达水平较高,发育后期表达水平较低。同时,Bxy-cul-1基因在功能上影响松材线虫的个体发育进度,这为研究松材线虫的生长发育提供了理论基础,也为松材线虫的病害防治提供新思路。
