干扰素基因刺激蛋白(STING)通路对乙型肝炎肝硬化患者外周血单核细胞炎症因子分泌及吞噬功能的影响
2023-10-25杨逸帆杜万威王霞杨广德李丽傅涓涓潘修成
杨逸帆, 杜万威, 王霞, 杨广德, 李丽, 傅涓涓, 潘修成
徐州医科大学附属医院感染性疾病科, 江苏 徐州 221002
肝硬化是多种慢性肝病的共同阶段,在我国HBV慢性感染是其主要病因。进展期肝硬化或失代偿期肝硬化等晚期肝硬化阶段往往伴随突出的免疫功能障碍,被称为肝硬化相关免疫障碍(cirrhosis-associated immune dysfunction,CAID)[1]。一方面表现为全身性炎症反应,而另一方面表现为免疫功能低下[2]。
在肝硬化状态下,肠源性脂多糖通过Toll样受体(TLR)4激活单核巨噬细胞分泌大量炎症因子被认为是系统性炎症反应的主要机制[3-4]。近年研究[5-6]发现,微生物或宿主细胞来源的DNA通过环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)-干扰素基因刺激蛋白(stimulator of interferon genes,STING)诱导炎症分子表达在机体抗感染免疫和系统性炎症反应中发挥重要作用。
STING是调控Ⅰ型IFN基因表达的重要接头蛋白。细胞内游离的双链DNA在cGAS作用下,催化合成的环鸟苷酸-腺苷酸(cyclic GMP-AMP,cGAMP)直接激活STING蛋白,然后通过TANK结合激酶1(TBK1)介导IFN调节因子3核转移进而诱导Ⅰ型IFN表达以及通过核因子-κB诱导IFN-β、IL-6和TNF-α表达[7-10]。
笔者前期研究[11-13]发现肝硬化患者肝组织单核/巨噬细胞STING表达明显升高,这些细胞的激活导致血清促炎细胞因子水平增加,包括TNF-α、IL-6、Ⅰ型IFN和IL-17等。然而迄今为止,尚无关于肝硬化状态下CAID与STING通路诱导的固有免疫应答之间关系的研究报道。本研究拟通过STING信号通路对乙型肝炎肝硬化患者外周血单核细胞功能的影响,进一步阐明乙型肝炎肝硬化患者免疫失调的发生机制,从而为乙型肝炎肝硬化的免疫治疗提供新的思路和靶点。
1 资料与方法
1.1 研究对象 选取2020年5月—10月于本院感染性疾病科住院治疗的乙型肝炎肝硬化患者。纳入标准:(1)HBsAg阳性,病程超过6个月;(2)肝硬化病史诊断明确,诊断标准参照2016年美国肝病学会的实践指南[14]。排除标准:(1)混合感染HCV、HDV、HIV;(2)合并其他肝脏疾病,包括脂肪性肝病、酒精性肝病、自身免疫性肝病、肝豆状核变性与血色素沉积;(3)合并任何恶性肿瘤或其他严重慢性疾病;(4)孕妇;(5)无法对患者本人或法定代理人知情告知。另选取同期本院体检中心健康体检者作为对照。
1.2 材料 人外周血单核细胞分离液试剂盒(Solarbio,中国),IFN-α、IFN-β、IL-6、TNF-α ELISA试剂盒(Elabsience,中国),2′,3′-cGAMP(Invitrogen,法国),STING抑制剂CCCP(Selleck,美国),Phagotest单核细胞吞噬活性定量测定试剂盒(Glycotope Biotechnology GmbH,德国)。
1.3 主要方法
1.3.1 外周血单核细胞的分离纯化 分别采集乙型肝炎肝硬化患者和健康体检者外周静脉血,使用外周血单核细胞分离液试剂提取其单核细胞,重悬细胞后用单核细胞培养基以106个/mL的密度重悬细胞,将细胞铺于细胞板中,置于细胞培养箱中进行贴壁培养2~4 h。除去细胞培养上清,加入含有2% EDTA和2%FBS的PBS,置于细胞培养箱中消化2~3 min,镜下看到贴壁细胞形状变圆后加入含10% FBS的RPMI1640终止消化,常温离心细胞后重悬单核细胞。
1.3.2 单核细胞培养及处理 将乙型肝炎肝硬化患者外周血单核细胞分为Control组、cGAMP组和cGAMP+CCCP组,Control组细胞加入等量的PBS后将细胞置于细胞培养箱培养12 h;后两组细胞加入cGAMP(1 μg/mL),其中cGAMP+CCCP组于培养1 h后加入CCCP(l μmol/L)。留取培养上清,置于-80 ℃冰箱保存。
1.3.3 ELISA法检测细胞因子 根据ELISA试剂盒说明书分别检测研究对象细胞培养上清IFN-α、IFN-β、IL-6和TNF-α水平。
1.3.4 单核细胞吞噬实验 采集乙型肝炎肝硬化患者与健康体检者外周静脉血3 mL,分为Control、cGAMP、cGAMP+CCCP三组,分别加入PBS(1 μg/mL)、cGAMP(1 μg/mL)、cGAMP(1 μg/mL)+ CCCP(l μmol/L)(培养1 h后加入CCCP)室温静置12 h。将荧光标记E.coli加入以上各组共同孵育。实验严格按照Phagotest试剂盒说明书中的步骤进行操作。经处理后的样本使用流式细胞仪分析单核细胞吞噬细菌能力。
1.4 统计学方法 采用SPSS 16.0统计学软件进行数据分析,使用GraphPad Prism 8.0软件绘制统计图。计量资料以表示,两组间比较采用成组t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入乙型肝炎肝硬化患者35例(乙型肝炎肝硬化组),其中男19例,女16例,平均年龄(41.43±8.60)岁。纳入健康体检者10例(健康组),其中男6例,女4例,平均年龄(45.52±11.15)岁。两组研究对象在年龄、性别方面差异均无统计学意义(P值均>0.05)。
2.2 cGAMP诱导乙型肝炎肝硬化患者外周血单核细胞炎症因子的分泌 乙型肝炎肝硬化组外周血单核细胞接受cGAMP刺激后所分泌的IFN-α、IFN-β、IL-6和TNF-α均显著高于健康组(P值均<0.05)(表1)。此外,cGAMP组IFN-α、IFN-β、IL-6和TNF-α水平均明显高于cGAMP+CCCP组和Control组(P值均<0.05),而cGAMP+CCCP组与Control组比较,各炎症因子水平差异均无统计学意义(P值均>0.05)(表2)。
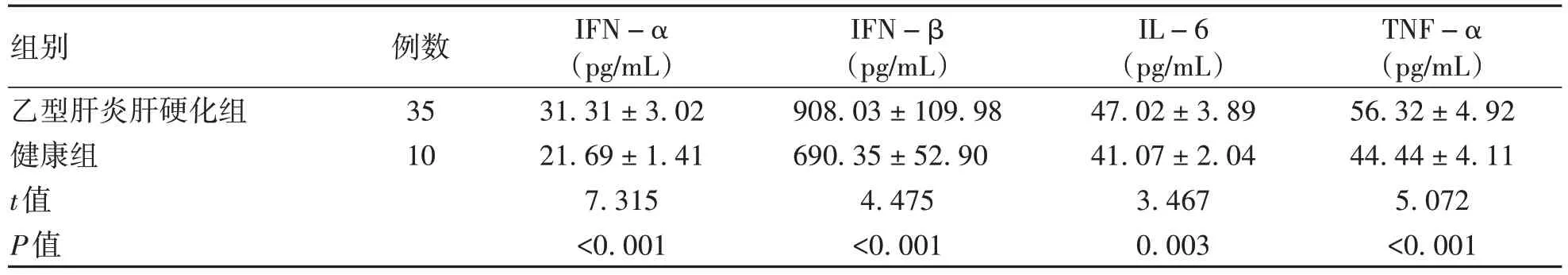
表1 cGAMP作用下乙型肝炎肝硬化患者和健康成人外周血单核细胞炎症因子分泌水平比较Table 1 Comparison of inflammatory factor secretion levels in peripheral blood mononuclear cells of patients with hepatitis B cirrhosis and healthy adults under the effect of cGAMP

表2 cGAMP作用下乙型肝炎肝硬化患者外周血单核细胞炎症因子分泌水平Table 2 Inflammatory factor secretion levels in peripheral blood mononuclear cells of patients with hepatitis B cirrhosis under the influence of cGAMP
2.3 cGAMP刺激人外周血单核细胞后的吞噬杀菌能力 乙型肝炎肝硬化患者外周血单核细胞在有或无cGAMP /cGAMP+CCCP处理下,吞噬细菌能力均较健康组显著降低(t值分别为4.647、2.790、2.504,P值均<0.05)(图1)。而cGAMP或cGAMP+CCCP处理对乙型肝炎肝硬化患者外周血单核细胞吞噬细菌能力均无明显影响(P值均>0.05)(图2)。

图1 不同处理情况下乙型肝炎肝硬化组和健康组外周血单核细胞吞噬细菌能力比较Figure 1 Phagocytic ability of peripheral blood mononuclear cells in patients with hepatitis B cirrhosis and healthy people under different treatments

图2 不同处理情况下乙型肝炎肝硬化患者外周血单核细胞吞噬细菌能力比较Figure 2 Phagocytic ability of peripheral blood mononuclear cells in patients with hepatitis B cirrhosis under different treatments
3 讨论
有研究[15-16]报道,从肝硬化特别是失代偿期肝硬化患者外周血循环中检测出DNA分子,主要来自于细菌或宿主细胞的裂解。因此理论上,肝硬化患者外周血单核细胞STING通路应该受到影响。笔者在前期的工作中发现,肝硬化患者外周血单核细胞STING蛋白表达较健康体检者显著升高,推测在肝硬化状态下,外周血单核细胞STING通路可能参与全身炎症反应的发生机制。
本研究以cGAMP刺激外周血单核细胞STING通路,结果显示肝硬化患者外周血单核细胞分泌IFN-α、IFN-β、IL-6和TNF-α水平均显著高于健康组和Control组,进一步证实肝硬化状态下外周血单核细胞STING通路处于高度活化状态,对肝硬化状态下全身炎症反应的发生可能发挥了重要作用。同时,在STING通路被特异性抑制剂CCCP阻断后,本研究发现IFN-α、IFN-β、IL-6和TNF-α四种炎症细胞因子的表达水平与cGAMP组相比均显著下降,并且与Control组无显著差异。提示可以通过特异性阻断STING通路,进而减轻肝硬化状态下的全身炎症反应,这为今后晚期肝病全身炎症反应综合征的治疗提供了新的选择。
进展期肝硬化尤其是失代偿期肝硬化为主的晚期肝病,往往伴随CAID的出现[17-18],一方面表现为全身性炎症反应,另一方面表现为固有免疫和适应性免疫功能的低下或缺陷,增加了感染风险。其中固有免疫功能低下,主要表现为中性粒细胞、单核巨噬细胞等免疫细胞吞噬细菌能力下降[19],其确切机制尚未完全清楚。Ashare等[20]研究证实了慢性肝病患者循环系统中性粒细胞和/或单核细胞的细菌清除功能受损。此外,肝硬化状态下肝组织炎症微环境和外周炎症反应状态影响了吞噬细胞杀菌能力。为进一步研究STING通路活化是否会影响肝硬化患者单核细胞的吞噬功能,本研究检测了肝硬化患者外周血单核细胞的吞噬细菌能力,结果发现乙型肝炎肝硬化患者单核细胞吞噬细菌能力较健康成人显著降低,与Bernsmeier等[21]研究结果一致,而STING通路激活或抑制对单核细胞吞噬细菌功能无显著影响,提示肝硬化状态下外周血单核细胞吞噬细菌功能低下,但是STING通路的激活与否对其无明显影响。
综上所述,本研究结果表明,外周血单核细胞STING通路的活化参与了乙型肝炎肝硬化状态下全身性炎症反应的发生机制,并可能发挥重要作用,这为乙型肝炎肝硬化患者免疫紊乱状态的诊断和免疫治疗提供了新的靶点。
伦理学声明:本研究方案于2020年7月2日经由徐州医科大学附属医院伦理委员会审批,批号XYFY2020-KL075-01,入组患者均采取自愿原则,并签署知情同意书。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:杨逸帆、杜万威、潘修成负责课题设计;杨逸帆、杜万威、李丽负责实验操作,资料分析和撰写论文;杨逸帆、李丽、王霞、杨广德、傅涓涓参与收集数据,修改论文;潘修成负责拟定写作思路,指导撰写文章并最后定稿。
