生长分化因子11(GDF11)调节非酒精性脂肪性肝病的机制研究
2023-10-25张涛殷雪翠任飞飞董琳张佳卢高峰
张涛, 殷雪翠, 任飞飞, 董琳, 张佳, 卢高峰
郑州大学第二附属医院消化内科, 郑州 450014
非酒精性脂肪性肝病(NAFLD)是一种慢性疾病,全球患病率超过25%[1],主要包括非酒精性脂肪肝(NAFL)和非酒精性脂肪肝炎(NASH)[2-3]。NAFLD的特点是脂肪堆积,可进一步发展为NASH、肝硬化或肝癌[4]。在生理条件下,肝脏是碳水化合物和脂质代谢的中心枢纽,脂肪酸(fatty acid,FA)的摄取、酯化、氧化和分泌均发生在肝细胞中。相当大比例的FA来源于饮食(肝脏FA池的15%~30%)、脂肪的从头合成(肝脏FA池的30%)和禁食期间脂肪组织释放的FA再循环[5]。存在于肝脏中的FA以脂滴的形式储存在肝细胞中,脂滴是动态的细胞溶质细胞器,具有疏水核心,包含并储存新合成或饮食获得的中性脂质[1-2]。在健康肝脏中,脂滴的数量和大小受到严格调节,FA过量时形成过多的脂滴可导致严重的病理状况[6]。NAFLD期间肝细胞中脂滴的过度积累可促进脂毒性,同时增加活性氧(reactive oxygen species,ROS)的产生并损伤线粒体膜和DNA[7-8]。肝细胞中氧化应激的持续增加导致细胞凋亡率增加,进而激活受影响肝组织中的炎症过程。当肝实质中的坏死性炎症复发或持续存在时,将严重阻碍组织再生并刺激纤维化的发展[9-10]。在所有确诊的NAFL病例中,多达15%可发展为NASH——一种伴有纤维化病变的炎症状态,并可进一步发展为肝硬化,进而肝功能衰竭和肝细胞癌的发生风险增高,病死率显著升高[11]。
生长分化因子11(growth differentiation factor 11,GDF11)是TGF-β亚家族成员,在哺乳动物胚胎发育过程中具有多效性。其特点是在不同组织(心脏、骨骼肌、神经系统、肾脏、胰腺和肠道)中的表达强度不同[12]。最近报道[13]GDF11可缓解高脂饮食引起的肥胖、高血糖、胰岛素抵抗和NAFLD。另有研究[14]证实,补充GDF11不改变野生型或肥胖小鼠的肝脂质积累,而可能诱导轻度肝纤维化。目前,GDF11对肝脏的应激反应和脂质积累的全身影响尚存争议。对此,本研究拟通过体外细胞实验探析GDF11在NAFLD中的作用和发生机制,为NAFLD的分子靶向治疗研究提供参考。
1 材料与方法
1.1 实验材料 AML-12细胞(小鼠正常肝细胞)由郑州大学马歇尔实验室赠予;重组GDF11购自美国MedChemExpress公司;DMEM培养基购自美国Gibco公司;油红O染色液购自北京索莱宝科技有限公司;油酸(oleic acid,OA)、棕榈酸(palmitic acid,PA)购自美国Sigma公司;甘油三酯测定试剂盒购自北京索莱宝科技有限公司;ROS检测试剂盒与线粒体膜电位检测试剂盒购自中国碧云天公司;氯喹(自噬抑制剂)购自美国AbMole公司;兔抗微管相关蛋白1轻链3(LC3B)单克隆抗体、兔抗腺苷酸活化蛋白激酶(adenosine activated protein kinase,AMPK)单克隆抗体、兔抗p-AMPK单克隆抗体均购自英国Abcam公司;兔抗p62(自噬受体蛋白)单克隆抗体购自中国Affinity公司;荧光二抗购自中国武汉三鹰生物技术有限公司;Cell NavigatorTM荧光法脂滴检测分析试剂盒购自AAT Bioquest公司。
1.2 实验分组 AML-12细胞用含10%胎牛血清的DMEM完全培养基悬浮,接种至培养皿中,轻轻摇晃混匀,37 ℃、5% CO2饱和湿度条件下培养。AML-12细胞分为对照组、对照+GDF11组、模型组、GDF11组及GDF11+氯喹组。对照组用完全培养基培养48 h;对照+GDF11组在完全培养基的基础上加入GDF11(100 ng/mL);模型组使用含FFA(1 mmol/L,油酸∶棕榈酸=2∶1)的完全培养基48 h诱导肝脂肪变性[15];GDF11组同时加入FFA和GDF11(100 ng/mL);GDF11+氯喹组用含1 mmol/L FFA的完全培养基48 h诱导肝脂肪变性,同时加入GDF11和氯喹(20 μmol/L)。
1.3 脂滴荧光染色 取生长状态良好的细胞接种到共聚焦培养皿中,按上述不同分组处理48 h后弃掉培养基,4%多聚甲醛固定10~15 min后PBS洗2~3次,加入1 mL Nile Green染色溶液,将细胞在37 ℃,5%CO2培养箱中孵育10~30 min,弃去Nile Green工作液,PBS洗2遍,加入DAPI复染10 min后PBS洗2遍,加入培养液或者PBS,使用激光共聚焦显微镜观察。
1.4 检测甘油三酯含量 将细胞接种至12孔板中,按上述不同的分组处理48 h后,收集细胞到1.5 mL EP管中,1 000 r/min离心10 min,弃上清液,留细胞沉淀,用PBS清洗2次,再次离心去上清,留细胞沉淀;加入0.2 mL匀浆介质进行匀浆,水浴条件下超声波破碎(300 W,3~5 s,间隔30 s,重复3次);甘油三酯检测试剂盒进行检测。
1.5 蛋白印迹法检测细胞自噬相关蛋白的表达 收集各组细胞,加入适量RIPA裂解液和蛋白酶抑制剂于冰上裂解30 min,使用研磨仪破碎胶状物,4 ℃、12 000 r/min离心10 min,提取上清液与5×蛋白上样缓冲液(4∶1体积比混合),沸水浴10 min,然后行蛋白电泳分离蛋白,分离后将蛋白转移至聚偏氟乙烯膜,使用含5%脱脂奶粉的TBST封闭液浸泡聚偏氟乙烯膜,室温摇床封闭2 h;加入一抗,4 ℃封闭过夜;次日,洗膜后二抗孵育1 h,洗膜后用ECL超特敏发光液和化学发光成像仪曝光显影。
1.6 免疫荧光检测自噬相关蛋白(p62、LC3B)的表达 LC3B被具有蛋白内切酶活性的Atg4在羧基端剪切,生成胞质LC3B-Ⅰ。LC3B-Ⅰ通过Atg7和Atg3参与的泛素样反应,生成LC3B-Ⅱ,它可以附着到自噬体的膜上,是自噬体的结构蛋白。自噬相关的特异性自噬底物p62升高,LC3B-Ⅱ下降,表明自噬活力受到抑制;p62下降,LC3B-Ⅱ水平升高,表明自噬功能恢复。取生长状态良好的细胞接种到共聚焦培养皿中,按上述不同的分组处理48 h后弃掉培养基,4%多聚甲醛固定10~15 min后PBS洗2~3次(5 min/次),加入1 mL含0.05% Tween-20的柠檬酸钠于95 ℃烘箱中孵育20 min,室温冷却,PBS洗3次,加入含3%脱脂奶粉、5%山羊血清的PBST封闭2 h,之后加入稀释好的一抗,4 ℃孵育过夜,第二天吸出一抗,PBST洗3遍,二抗孵育2 h,PBST洗3遍,加入DAPI复染,封片后置于共聚焦显微镜下观察。
1.7 细胞ROS及线粒体膜电位的检测 JC-1是荧光亲脂性羰花青染料,主要应用于测量线粒体膜电位,在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体(monnmers),产生绿色荧光;膜电位较高时,JC-1形成聚合物(aggregates),可以产生红色荧光,红绿荧光的相对比例来衡量线粒体去极化的比例。将共聚焦专用玻片置于24孔板中,将生长状态良好的细胞接种于24孔板,按上述分组处理细胞48 h,弃去培养液,ROS检测试剂盒与线粒体膜电位检测试剂盒用于检测细胞内ROS水平,使用共聚焦显微镜观察及测量荧光强度。
1.8 统计学方法 采用GraphPad Prism 8.0进行数据分析。多组间计量资料比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 GDF11减少FFA诱导的肝细胞内脂质积累 采用共聚焦显微镜观察:模型组细胞内绿色脂滴明显增加,即FFA诱导细胞脂肪变性;GDF11组细胞内脂滴的积累程度较模型组减轻(图1)。高倍镜下,不同组别的脂滴形态存在明显区别,模型组较GDF11组细胞内脂滴体积明显增大(图2)。对照+GDF11组细胞中甘油三酯水平与对照组比较差异无统计学意义(P>0.05),模型组细胞中甘油三酯水平与对照组相比明显升高(P<0.000 1),GDF11组甘油三酯含量较模型组明显下降(P<0.000 1)(图3)。
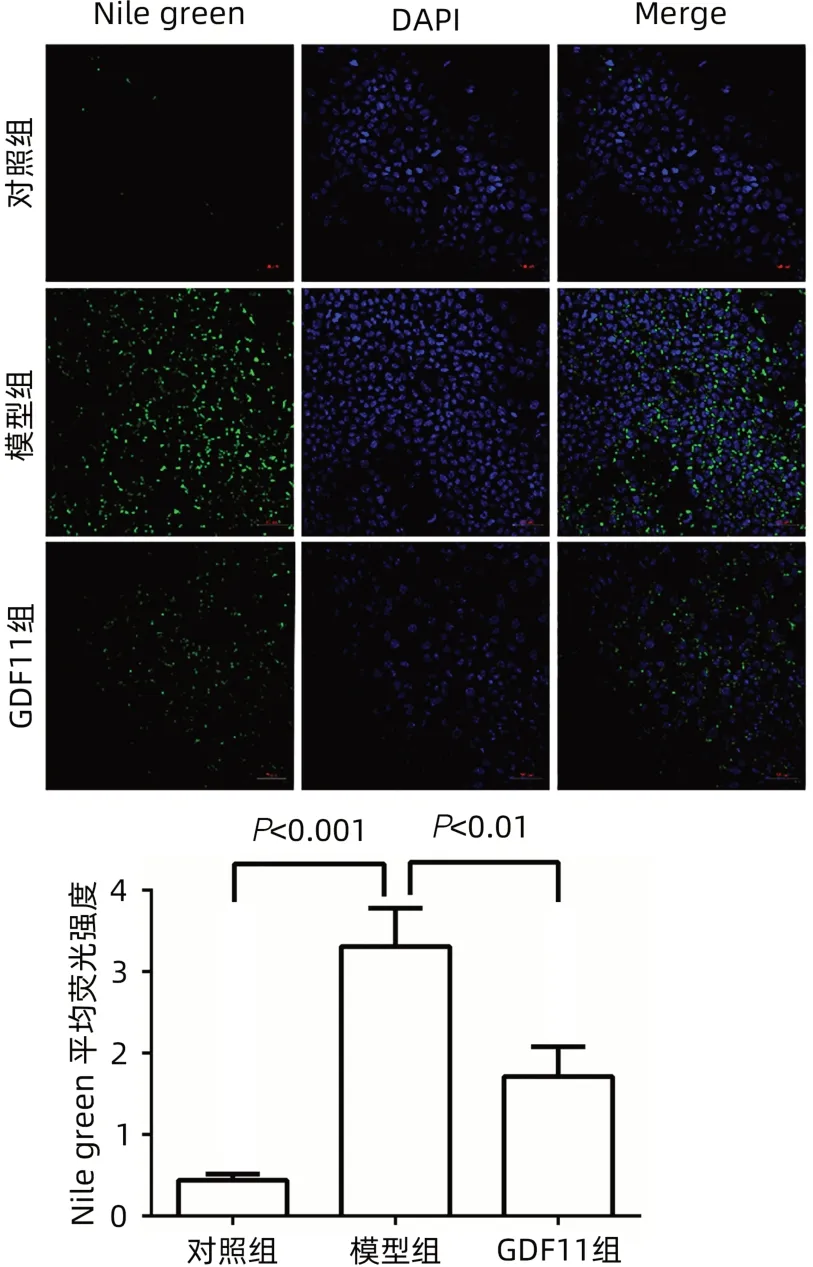
图1 FFA和GDF11处理48 h的Nile green染色及荧光定量结果(×100)Figure 1 Nile green staining and fluorescence quantitative results of FFA and GDF11 treatment for 48 h(×100)
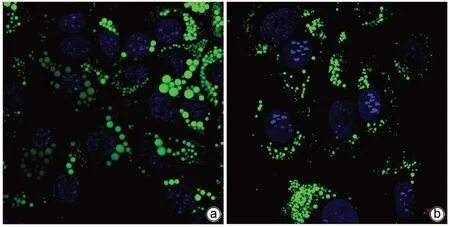
图2 高倍镜下脂滴的荧光染色结果(×630)Figure 2 Fluorescence staining results of lipid droplets at high magnification (×630)
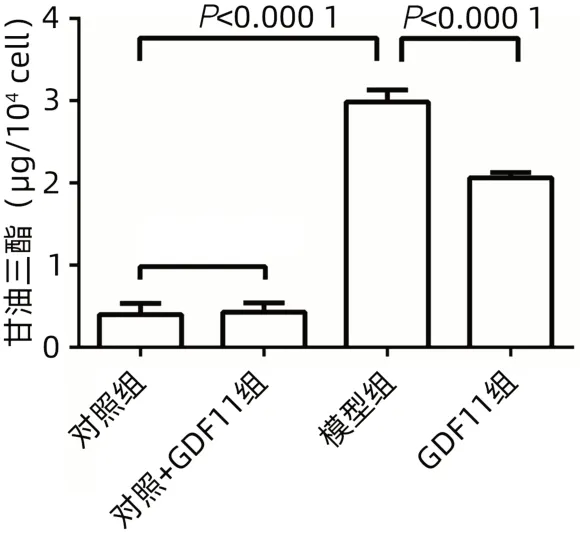
图3 各组细胞内甘油三酯水平比较Figure 3 Comparison of intracellular triglyceride levels in each group
2.2 GDF11可逆转FFA诱导的肝细胞自噬受限 模型组细胞内p62的含量明显上升,LC3B-Ⅱ与LC3B-Ⅰ比值减少,自噬被抑制;GDF11组p62下降,LC3B-Ⅱ与LC3B-Ⅰ比值增加,自噬增强(图4a)。免疫荧光检测结果与Western Blotting结果一致(图5、6)。GDF11+氯喹组LC3B-Ⅱ的积累高于FFA模型组和对照组(图4b)。与FFA模型组相比,GDF11组p-AMPK的表达增加(图4c)。与GDF11组比较,GDF11+氯喹组细胞内甘油三酯含量升高(P<0.001)(图7)。

图4 p62、LCB3、AMPK/p-AMPK表达的Western-Blot检测结果Figure 4 Western-Blot results of p62, LCB3, AMPK/p-AMPK expression
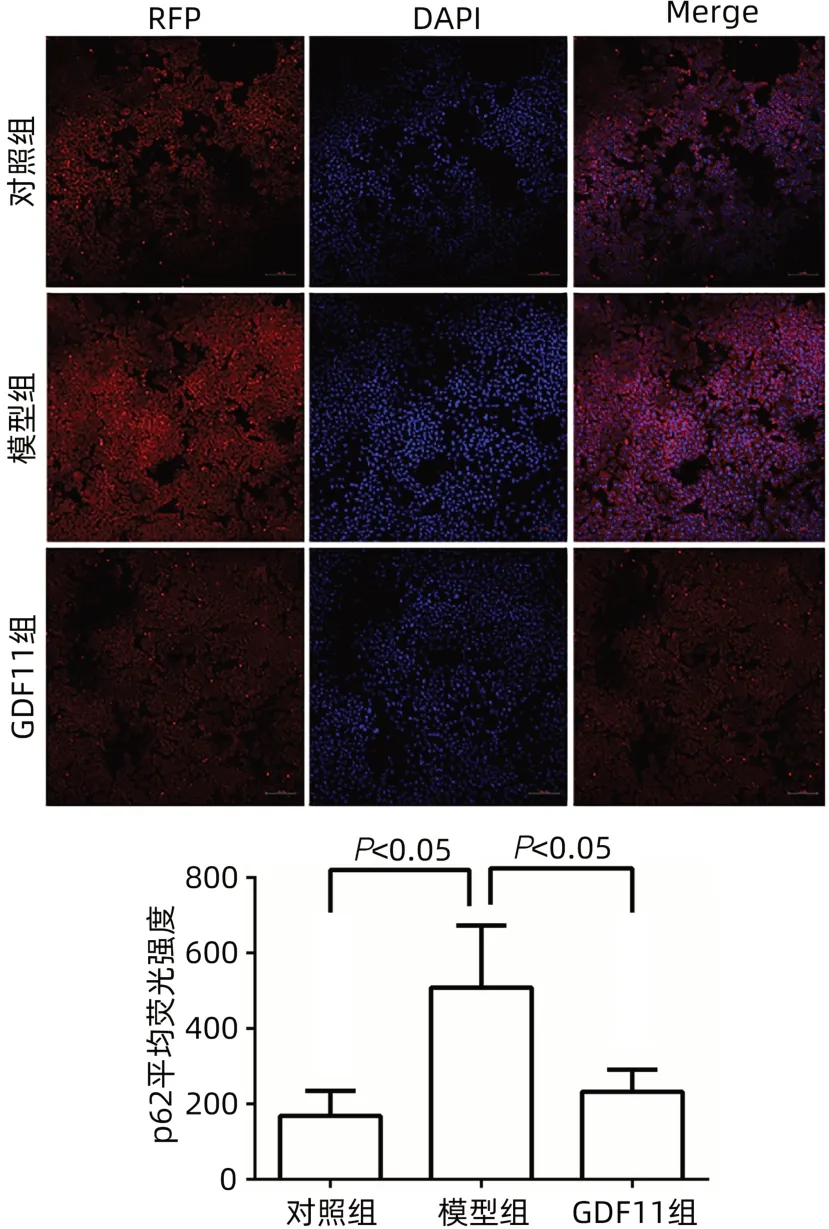
图5 p62的免疫荧光及定量结果Figure 5 Immunofluorescence and quantitative results of p62

图6 LC3B的免疫荧光及定量结果(×100)Figure 6 Immunofluorescence and quantitative results of LC3B(×100)
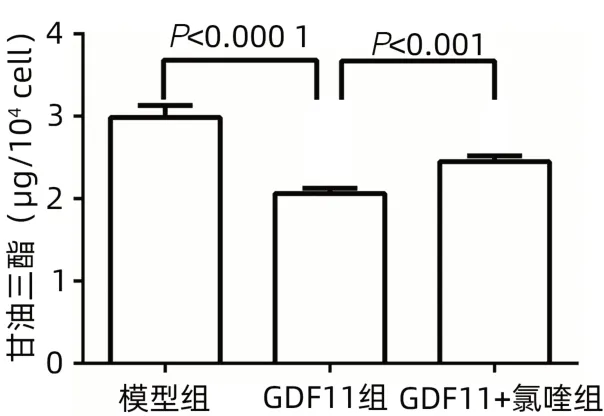
图7 各组细胞内甘油三酯水平比较Figure 7 Comparison of intracellular triglyceride levels in each group
2.3 GDF11减少FFA诱导脂肪肝细胞ROS的产生在脂肪积累条件下,细胞将产生大量ROS,过量的ROS可导致细胞中DNA、蛋白和脂质氧化损伤,并最终导致细胞死亡。通过检测细胞内ROS的变化可见,经过GDF11处理后,FFA引发的氧自由基含量明显减少(图8)。
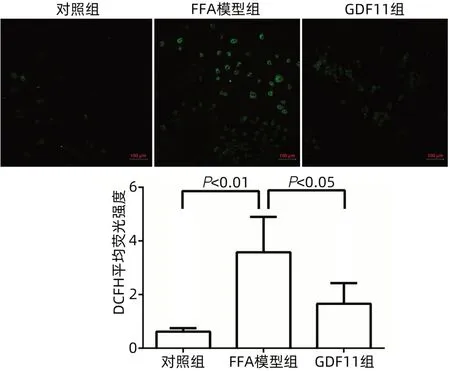
图8 FFA处理细胞后ROS荧光成像及水平比较(×100)Figure 8 ROS fluorescence imaging and level comparison after FFA treatment(×100)
2.4 GDF11改善FFA诱导条件下细胞的线粒体膜电位改变 FFA诱导过后,胞质中的绿色荧光明显升高,与对照组比较,模型组JC-1单体/聚合物升高(P<0.000 1),细胞线粒体膜电位下降;加入GDF11后,绿色荧光强度减弱,与模型组比较,GDF11组JC-1单体/聚合物下降(P<0.05),线粒体膜电位回升(图9)。

图9 GDF11改善FFA诱导条件下细胞的线粒体膜电位改变(×400)Figure 9 GDF11 improved the changes of mitochondrial membrane potential in FFA-induced cells(×400)
3 讨论
NAFLD是在没有过量饮酒情况下,肝细胞脂肪堆积,与代谢综合征密切相关,例如肥胖(尤其是中枢性肥胖)。随着肥胖和2型糖尿病(T2DM)患病率持续上升,NAFLD在发达国家和发展中国家的患病率也在升高[16]。自噬是一种进化上保守的管家应激诱导的溶酶体降解途径,可回收大分子、受损蛋白质或细胞器、细胞质和代谢物以满足代谢需求,并调节细胞能量稳态[17]。受损的自噬与代谢紊乱的发展有关[18]。NAFLD的特征是代谢过程的广泛失调,包括抑制肝脏中的自噬[19]。增强自噬可以防止肝脂肪变性,既往研究[20]使用雷帕霉素诱导自噬,可通过调节脂质代谢、降低甘油三酯水平和改善高脂饮食诱导的肥胖小鼠的胰岛素敏感性以保护肝脏免于脂肪变性。考虑到雷帕霉素对人体免疫系统有不良影响,目前尚无针对NAFLD的特效治疗药物。
有研究[21]表明,GDF11在纤维化的人和小鼠肝脏中升高,并揭示了GDF11在慢性肝病组织重塑中的新的潜在作用,尽管是TGF-β超家族的成员,但功能获得实验表明GDF11可通过促进LGR5+(富含亮氨酸重复序列G蛋白偶联受体5阳性)肝祖细胞的扩增以减轻肝纤维化。
有研究[22]表明,GDF11可能通过促进自噬保护心肌细胞免受缺氧诱导的细胞凋亡。但在肝脏中,GDF11与自噬的关系从未被探讨。本研究发现,当FFA诱导肝细胞出现脂肪变性时,p62的水平明显升高,LC3B-Ⅱ水平明显下降,表明自噬活力受到抑制;在加入GDF11后,LC3B-Ⅱ水平升高,p62水平下降,表明GDF11可恢复NAFLD肝细胞中受损的自噬功能。自噬是一个动态过程,细胞将自噬物吞噬到自噬小体,指导自噬溶酶体形成并降解自噬物的过程被称为自噬流,LC3B-Ⅱ作为自噬小体的标志,如果LC3B-Ⅱ表达增加,一方面可能由于前期自噬小体增多导致,另一方面可能由于后期自噬溶酶体清除失败使其积累,因此单一时间点LC3B-Ⅱ的表达改变并不能体现自噬流的改变。本研究通过氯喹阻断自噬溶酶体的形成,使LC3B-Ⅱ在细胞内积累,以便分析自噬流的改变。加入氯喹后可见GDF11处理后LC3B-Ⅱ的积累明显要高于FFA模型组,表明GDF11增强了NAFLD细胞的自噬流。此外,本研究证实GDF11通过增强自噬来减少NAFLD细胞的脂质积累:首先,在经过GDF11处理后,细胞内的脂滴含量及脂滴大小明显小于NAFLD细胞,之后使用氯喹,消除了GDF11对细胞内甘油三酯水平的影响。同时,本研究发现GDF11还可以减弱脂肪肝细胞内的ROS水平及改善线粒体膜电位,从而起到保护作用。
综上所述,GDF11可通过上调细胞自噬,消除高脂导致的肝细胞脂质积累,并减少ROS的积累,提升线粒体膜电位,从而改善NAFLD。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:张涛负责课题设计,实验实施,收集数据,资料分析,撰写论文;殷雪翠参与采集数据,分析数据;任飞飞、董琳、张佳参与统计分析;卢高峰参与课题设计,审核论文并对论文负责。
