吉林省长春市城乡活禽市场H9N2亚型禽流感病毒的检测与分子遗传进化分析
2023-10-25任永宁刘新鑫闫巍文姜姗姗汪思捷沙雨欣王梦君徐小洪尹仁福
任永宁,刘新鑫,闫巍文,姜姗姗,汪思捷,沙雨欣,王梦君,徐小洪,丁 壮,高 超,尹仁福
(吉林大学动物医学学院预防兽医学系人兽共患病研究教育部重点实验室,人畜共患传染病重症诊治全国重点实验室,长春 130062)
H9N2亚型AIV自1992年首次在我国检测到[1],如今已广泛分布在全国。现有数据显示我国H9N2已经取代H5和H7亚型,成为AIV中优势亚型[2-3]。研究证明H9N2亚型AIV可为新型重组的H5N1、H5N6、H5N2和H7N9等高致病性流感病毒提供基因片段,为其变异提供材料[4-5]。且近些年来,人感染H9N2禽流感的病例也愈发增多。因此,定期开展AIV的流行病学调查不可或缺。本研究在长春市周边活禽市场展开调查,对鉴定为阳性的样本进行全基因组测序及系统发育分析,为当前国内H9N2亚型AIV的流行病学研究提供数据参考。
1 材料与方法
1.1 材料
1.1.1 样本来源与鸡胚 本实验所涉及的样本收集来自2021年9月至2023年4月在长春市周边城乡活禽市场,共计170份。SPF鸡胚购于济南赛斯家禽科技有限公司,由本实验自行孵化至10日龄胚。
1.1.2 主要试剂 Trizol LS Reagent购自Sigma公司;6×loading buffer、DL2000 Marker购自北京聚合美生物科技有限公司;NovoScript®One-Step RT-PCR Kit一步法RT-PCR试剂盒购自苏州近岸蛋白质科技股份有限公司。
1.2 方法
1.2.1 病毒分离 待检测样品取上清液接种至10日龄SPF鸡胚,置于37 ℃培养箱中观察,72 h后收集鸡胚尿囊液。经HA-HI检测后对无血凝性的样品盲传2代,如仍未有血凝效价则认为AIV阴性。通过血凝抑制实验确定分离的病毒亚型以及混合感染。血凝阳性样本总RNA提取按照制造商的建议用Trizol Reagent 分离。使用NovoScript®One-Step RT-PCR Kit 一步法RT - PCR试剂盒鉴定AIV。结果为阳性按照有限稀释法纯化病毒并进行全基因组测序。全基因组扩增引物信息参考霍夫曼引物[6]。对PCR产物进行1%琼脂糖凝胶电泳,将阳性条带送至生工生物工程(上海) 股份有限公司测序。
1.2.2 序列比对与遗传进化分析 使用Lasergene11软件进行序列拼接及同源性分析,利用NetNGlyc 1.0预测3株分离株的HA和NA基因糖基化位点。在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)及全球流感基因共享数据库(Global Initiative on Sharing All Influenza Data, GISAID)中下载参考毒株,使用MEGA 7软件设置邻接法(Neighbor-joining, NJ, Bootstrap=1000)进行多序列比对,对各基因片段绘制遗传发生树。
2 结 果
2.1 样品的检测与病毒的分离鉴定 本实验所涉及的样本收集于长春市周边城乡活禽市场共计170份,鉴定为AIV的26份,其中选取3株具有代表性H9N2毒株使用有限稀释法连传三代纯化后进行全基因组测序。三株AIV序列已上传至GENEBANK,序列号为OR230154至OR230177。将其分别命名为A/chicken/Jilin/HL45/2022、A/pigeon/Jilin/HL55/2022、A/pigeon/Jilin/HL56/2022简称(CK/JL/45/22、PGN/JL/55/22、PGN/JL/56/22))并进行后续研究。
2.2 HA基因序列及关键氨基酸位点分析 3株H9N2亚型分离株均来自于长春市活禽市场,HA基因ORF全长均为1683 bp,编码560个氨基酸。其中HA的蛋白裂解位点为PSKSSR↓GLF,属于不连续碱性氨基酸序列,未发现连续多碱性氨基酸的插入,符合LPAIV特征。分离株之间HA基因核苷酸同源性为99.7%~99.9%。与经典毒株对比后,发现3株分离株与A/Chicken/HongKong/G9/1997的同源性最高为 87.3%~87.6%。对3株分离株HA基因受体结合位点进行分析如表1所示,发现Q226L位点、Q227M(H3编号)发生突变,Q226L位点突变更倾向于结合α, 2-6唾液酸受体,导致亲嗜性由禽类转变为哺乳动物。此外,分析发现3株分离株381位氨基酸位点存在E381K突变,先前研究表明此为一个有利于AIV气溶胶传播的关键位点[7]。对3株分离株HA蛋白的糖基化位点进行分析发现,3株分离株的HA蛋白具有8个潜在糖基化位点,在29-31、82-84、141-143、298-300、305-307、313-315、492-494、551-553位出现潜在糖基化位点。分离株在313位增加了一个糖基化位点,这会导致病毒介导的细胞融合和受体结合能力增强[8]。HA基因系统发育树分析如图1所示,3株分离株HA基因均属于BJ-94 like分支。与厦门人流感A/Fujiansiming/19/2021基因高度同源,在进化树属同一分支。
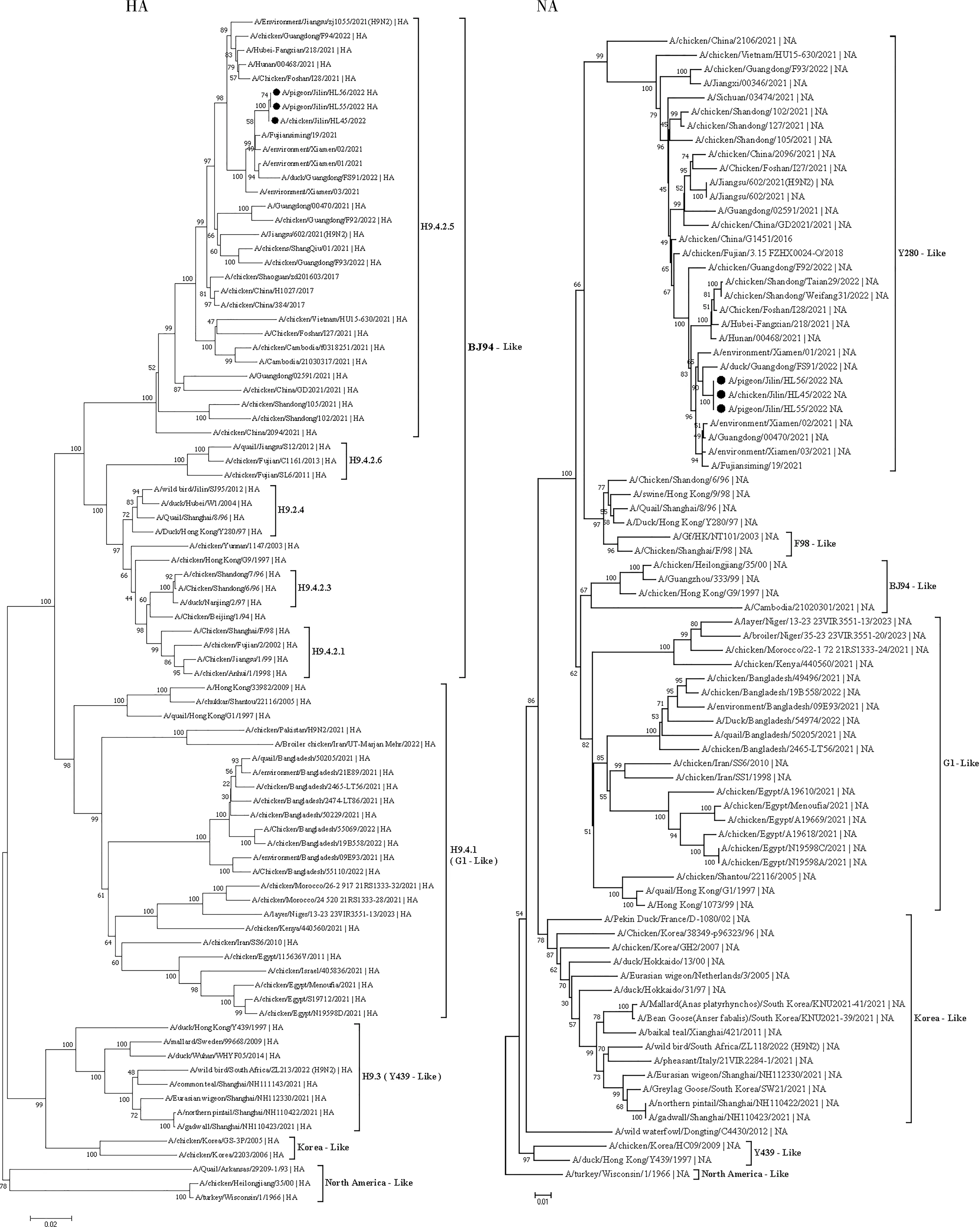
图1 HA、NA基因系统发育树Fig 1 The phylogenetic tree based on genes of HA and NA

表1 H9N2亚型AIV分离株HA关键氨基酸位点分析及潜在糖基化位点分析Tab 1 Analysis of key amino acid sites and potential glycosylation sites in HA of H9N2 subtype AIV isolates
2.3 NA基因序列及关键氨基酸位点分析 3株H9N2分离株NA基因ORF全长均为1463 bp,编码466个氨基酸。3株分离株核苷酸同源性为99.6%~99.9%。与经典毒株氨基酸比对分析如表2所示,发现3株分离株在NA茎部62-64位都缺少三个氨基酸,这表明毒株对小鼠的毒力可能增强[9]。在红细胞吸附位点上存在K68 N、D369S突变,而在431-433位及活性中心位均未发现突变现象。在氨基酸N70S位点发生突变,该位点突变可以产生对扎纳米韦的耐药性[10],而在119、274、292位中没有出现对达菲有耐药性的突变位点。3株H9N2分离株NA蛋白糖基化位点如表2所示,其均存在44、66、83、143、197、231、365、399位的糖基化位点。3株H9N2分离株的NA基因均属于Y280-like分支,其基因系统发育树分析如图1所示。
2.4 内部基因序列及关键氨基酸位点分析 对3株H9N2 亚型AIV毒株内部核苷酸同源性基因进行分析,各基因节段同源性为: PB2:99.7%~99.8%、PB1:99.5%~99.8%、PA:99.5%~99.7%、NP:98.9%~99.3%、M:95.0%~96.2%、NS:97.6%~98.6%。3株H9N2分离株的PB2、M基因均属于G1谱系;PB1、PA、NP、NS均属于F-98谱系,其内部6个基因系统发育树分析如图2所示。对3株H9N2分离株的PB2蛋白关键氨基酸进行分析,发现在E627K、D701 N均未发生突变。而在V147I、A184T、I292V、R389K、A588V、T598I、L648V和T676M位点均存在突变。其中V147I突变会增加小鼠致病性、A588V突变提高了病毒在宿主体内的适应性并使其获得了在哺乳动物间的传播能力[11]。此外,对PB1蛋白关键氨基酸的分析发现PB1上发生了能增强AIV在雪貂中传播能力的I368V突变[12]。此前有研究表明PA蛋白672L是影响H9N2亚型AIV气溶胶传播特性的关键氨基酸位点[7],本研究3株毒株PB1蛋白第672位点均不为L。M基因编码M1和M2蛋白,在M1上第231位没有发生与大鼠适应性相关的D231 N突变,而在M2基因片段中发现S31 N点突变,该位点突变使得病毒对金刚烷胺类药物产生耐药性[13]。NS基因编码NS1蛋白和NS2蛋白,其中NS1蛋白的第42位发生P42S的突变,这导致AIV对哺乳动物的致病性增强[14]。NS1 V149A突变后,则能够使病毒在鸡体内复制,从而影响病毒对鸡的致病性[15]。

图2 PB2、PB1、PA、NP、M、NS基因系统发育树Fig 2 The phylogenetic tree based on genes of PB2, PB1, PA, NP, M and NS
3 讨 论
H9N2亚型AIV作为全球广泛流行的AIV之一,其对世界养殖业的危害日益增加,这也是相关从业者亟待解决的问题之一。本研究于2021年9月至2023年4月长春市周边城乡活禽市场采样检测并分离鉴定3株H9N2亚型AIV并进行全基因组测序。补充了国内该亚型AIV毒株的生物学信息,同时对其分子生物学特性展开分析。经对其核苷酸序列分析,发现在3株分离株出现HA-Q226L,这表明分离株更倾向于结合α,2-6唾液酸受体结合,导致亲嗜性由禽类转变为哺乳动物。3株分离株HA基因均属于BJ-94 like分支,与厦门人流感A/Fujiansiming/19/2021基因高度同源,在进化树属同一亚分支[16]。这表明我国当前AIV传播迅速,传播范围广泛。家禽业的从业者要加强防护措施。分子遗传进化分析显示3株毒株的HA基因归属于BJ-94谱系中h9.4.2.5亚分支;NA基因归属Y280谱系;PB2、M基因均属于G1谱系;剩余内部基因均属于F-98谱系,这表明本文中分离3株H9N2亚型AIV均属于G57基因型[17]。有研究表明,自2013年以来,G57基因型AIV病毒为我国主要流行毒株[18]。3株分离株在NA茎部62-64位都缺少三个氨基酸,已经被推测为这种缺失模式的短茎NA可能是水禽传播到陆生家禽,并对其逐渐产生适应性的一个重要分子标记[19]。PB2 588位点作为PB2-F6 组合突变的关键共适应位点,在鸟类和哺乳动物中获得了比PB2 588位点单突变更高的AIV适应性,这表明PB2 588位点与其他突变位点的协同作用可以进一步增强这种共适应性,共同适应的出现不仅增加了对鸟类和哺乳动物的威胁,而且还可能导致鸟类之间的大流行,并跨越哺乳动物的种间障碍[20]。在针对耐药性方面发现在NA在氨基酸N70S位点发生突变,该位点突变可以产生对扎纳米韦的耐药性[10],而在119、274、292位中没有出现对达菲有耐药性的突变位点。在M2基因片段中发现S31 N点突变,该位点突变使得病毒对金刚烷胺类药物的产生耐药性,而在L26F、V27A、A30V/T/S和G34E位点均未出现耐药性突变位点。
H9N2亚型AIV如今已被认为是AIV基因的主要供体,通过重组共循环的流感病毒可导致人畜共患重组[21]。自2013年以来, AIV已在中国造成5次连续人间流行。蒲娟等[22]发现H9N2在第五次大流行前发生了包含哺乳动物适应性突变的PB2和PA基因的新的H9N2病毒亚分支被重组为共循环的H7N9病毒,形成了一种新的显性H7N9病毒基因型。过去的研究表明活禽市场是人感染禽流感的传播源甚至是潜在的孵化器。本次实验结果表明在城乡结合地区中仍能检测出H9N2亚型AIV,且和不经适应直接感染人的禽流感毒株高度同源。因此,应在已有成绩之上继续完善一体化的防控机制,加强城乡结合地区的监管力度,实现人病兽防,关口前移、在人与动物间切断传染源,以降低人类感染AIV的风险。
