外源有机物添加种类对农田黑土有机碳激发效应的影响及作用机理*
2023-10-25李娜滕培基雷琬莹龙静泓李禄军
李娜,滕培基,雷琬莹,龙静泓,李禄军
(1.黑土地保护和利用全国重点实验室/中国科学院东北地理与农业生态研究所 哈尔滨 150081;2.中国科学院大学 北京 100049)
土壤碳库是陆地生态系统最大的碳库,其微小变化都可能对大气CO2浓度和气候变化产生深远影响[1]。农田土壤有机碳库受人类活动影响剧烈,不同管理措施和外源有机物输入会直接影响土壤有机碳(SOC)矿化、周转和稳定。向土壤中加入外源有机物后,土壤原有SOC 的分解速率会在短期内发生强烈变化,这一现象称为激发效应[2]。激发效应在调节土壤有机质分解、碳释放和碳库储量方面起着至关重要的作用。植物凋落物、细根和根系分泌物等不同种类的外源有机物输入均可产生激发效应,加速土壤碳流失[3-4]。已有研究表明,激发效应可使土壤有机质分解增加15%~59%[5-9]。有研究提出将激发效应纳入地球系统模型可提高未来全球变化下土壤碳库损失和碳储量的预测精度[3,10]。因此,研究土壤碳库的动态变化,不能忽视外源有机物添加对SOC 矿化和激发的影响[11]。
外源添加物的种类和数量是影响SOC 矿化和激发的重要因素。不同种类的外源添加物对SOC 矿化激发量不同,土壤微生物的利用效率和策略也不同,进而影响SOC 矿化和外源有机碳向土壤中的转化[12-13]。通常来说,结构简单的有机物更易被微生物分解利用,对SOC 矿化激发的影响更剧烈,而含纤维素、木质素及蜡质等,且结构相对复杂的外源有机物则需要较长的时间被降解,激发效应较缓慢持久[14]。Dijkstra 等[15]研究发现简单的代谢化合物比复杂结构的植物成分(如木质素等)底物利用效率更高。结构简单的外源有机物可形成更多的溶解性有机质、碳水化合物和多肽,而针叶凋落物和木材等结构复杂的有机物以二氧化碳形式损失大部分的碳[12]。Hamer 等[16]比较了果糖、丙氨酸、草酸和邻苯二酚对两种森林土壤和1 种农田土壤不同土层SOC 矿化的影响,发现果糖和丙氨酸引起的正激发效应最强。Luo 等[17]比较了葡萄糖、柠檬酸和草酸对SOC 的影响,发现在低碳土壤中,酸性根系分泌物有降低SOC分解速率的潜力。土壤微生物通过体外修饰和体内周转过程参与调控土壤有机碳库的动态变化[18-19],外源添加物的质量不同,微生物群落的组成、结构及其调控有机碳激发的机制也不同。Blagodatskaya 等[20]提出,r 策略微生物对激发效应的贡献主要为表观激发效应,真实激发效应则由k 策略微生物主导。Yu等[21]研究发现,激发效应过程中微生物群落由细菌主导向真菌主导接替,证明了微生物群落接替与激发效应间的联系。同时,外源有机物的碳氮比也会影响微生物群落结构,碳氮比较高的外源有机物可能会使真菌比例增大[22-23]。由此可见,关于SOC 激发效应及微生物机制的研究已有很多,但研究结果因土壤类型、生态系统类型、添加有机物种类和土壤SOC 背景值不同而差异较大,而针对同一土壤类型同一生态系统中不同SOC 含量的土壤激发效应仍不清楚,激发效应过程中土壤微生物的群落组成、结构和碳源利用能力及如何调控SOC 的矿化激发也有待深入研究。
为此,本研究利用东北黑土区自然发育的典型黑土带旱地农田表层土壤,采集不同有机碳含量的农田表层土壤样品(SOC 含量范围为10~70 g·kg-1),利用室内控制培养试验,通过添加13C 标记的不同种类外源有机物,利用13C 稳定同位素标记、傅里叶红外光谱、磷脂脂肪酸(PLFA)等技术,阐明不同外源有机物添加下不同SOC 含量农田黑土SOC 的矿化和激发特征,结合有机碳红外光谱结构特征和微生物群落结构变化特征,解析调控农田黑土SOC 激发和稳定的微生物作用机制。研究结果对预测不同来源外源有机物输入对黑土有机碳动态和碳库稳定具有重要意义。
1 材料和方法
1.1 样品采集与前处理
供试土壤样品为我国东北黑土区自然形成的典型黑土带旱地农田0~15 cm 表层土壤。采样区属于大陆性季风气候,年均气温-1.0~5.4 ℃,年均降水量约500~700 mm,南部地形多平原,北部多为漫川漫岗,土壤为典型黑土。在黑龙江省北安市和海伦市、吉林省榆树市和四平市4 个地点的农田采集4 个SOC 含量的供试土壤样品,分别用SOC68、SOC32、SOC21 和SOC11 表示,当季种植作物均为玉米(Zea mays)。待秋季作物收获后在每个采样点设置3 块50 m×50 m 的均质样方,各样方间距20 m 以上,在每个样方内采用S 形5 点采样法采集表层土壤,将3 个样方共计15 个样点土样充分混匀,用自封袋装取5 kg 左右,迅速带回实验室。挑除植物残体、石块等杂物后过2 mm 筛,一部分土样自然风干后测定土壤基本理化性质,剩余部分4 ℃储存用于微生物指标测定和室内培养试验。采样点信息及土壤理化性质如表1 所示。
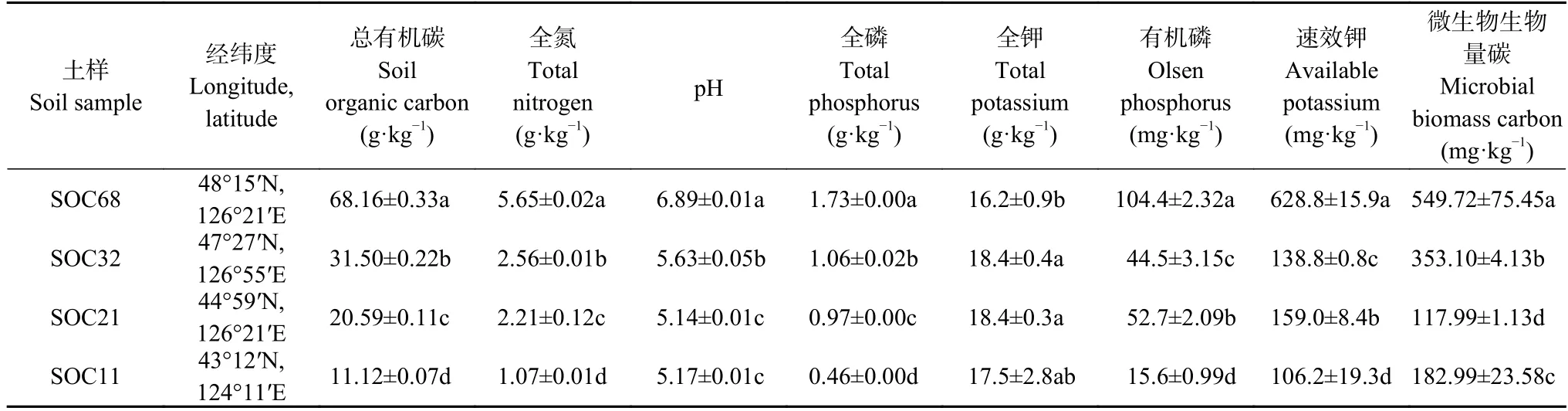
表1 试验前供试土壤基本理化性质和微生物生物量碳含量Table 1 Physical-chemical properties and microbial biomass carbon content before incubation of the tested soil
1.2 试验设计与取样
培养试验采用双因素随机区组设计,包含16 个试验处理(采自4 个地区的供试土壤×3 种外源有机物+4 组不添加外源有机物对照处理),3 种外源有机物为13C 标记的玉米秸秆、葡萄糖和丙氨酸,添加量统一参照玉米秸秆常规田间施用量(5 t·hm-2),换算为3 种外源有机物的添加量均为0.8 g(C)·kg-1土壤。培养试验的每个处理有6 次重复,在试验的第30 天和135 天破坏性取样,每次破坏性取样包含16 个处理,每个处理3 次重复,共48 个土样。试验共计96个样品。
具体培养试验如下: 称取相当于2.5 kg 风干土壤质量的鲜土装入大塑料袋内,调节土壤水分含量为田间持水量的40%,25 ℃恒温避光预培养2 周,使土壤中微生物活性和功能得到恢复。正式培养时,每个塑料杯中准确称取相当于50 g 干土重的鲜土样,根据试验设计将预先配好的葡萄糖和丙氨酸溶液分4 次均匀添加到相应处理的塑料杯中,玉米秸秆用球磨仪磨成粉末后按试验设计量与相应土壤混匀,所有试验处理用蒸馏水将含水量调到田间持水量的60%,最后将塑料杯置于750 mL 广口瓶中。每个大广口瓶中塑料杯外侧加入10 mL 蒸馏水以保持瓶内土壤湿度。此外,设置3 个无土壤培养的空白对照,除无土壤及添加物外,其他条件保持一致。随后将密封广口瓶置于25 ℃恒温培养箱内避光培养,培养期间分别于1 d、2 d、3 d、4 d、5 d、7 d、10 d、13 d、
18 d、23 d、30 d、37 d、44 d、51 d、58 d、65 d、72 d、79 d、86 d、93 d、100 d、114 d、128 d、135 d
用注射器采集广口瓶内气体。采样后将广口瓶密封盖打开置于通风橱内通风20 min,取出塑料杯称重补水保持土壤含水量后,迅速放回大广口瓶中密封好转移至恒温培养箱继续培养。所采气体样品利用Picarro G2131-i 进行二氧化碳(CO2)浓度和13C 丰度的测量。在培养试验的第30 天和135 天破坏性取样,并用于土壤总有机碳(SOC)、全氮(TN)、微生物生物量碳、磷脂脂肪酸以及土壤有机碳红外光谱结构的测定。
1.3 测定指标与方法
土壤微生物生物量采用氯仿熏蒸浸提法[24],未熏蒸和熏蒸后的浸提液过滤后用总有机碳分析仪(liquiTOC II,Elementar,Germany)测定。SOC 和TN 含量和δ13C 用元素分析仪(Elementar,Germany)——稳定同位素质谱(IRMS Isoprime 100,Elementar,Manchester,UK)联用仪测定。土壤红外光谱测定采用傅里叶红外光谱仪(Nicolet 6700,Thermo Fisher,USA)溴化钾压片法测定。土壤红外光谱测试范围为400~4000 cm-1,分辨率为4 cm-1,扫描次数为64,空气作为背景,扫描时自动扣除背景光谱,本文选取2920 cm-1和2850 cm-1处代表脂肪族碳官能团吸收峰,1630 cm-1处代表芳香族碳官能团吸收峰,1420 cm-1处代表甲基和亚甲基碳官能团吸收峰,计算其相对峰面积强度[25-26]。土壤微生物群落组成用磷脂脂肪酸(PLFA)法分析[27],利用i14:0、i15:0、a15:0、a16:0、i16:0、i17:0、a17:0 表示革兰氏阳性菌,16:1ω7c、17:1ω8c、cy17:0、18:1ω7c、19:1ω6c、cy19:0 表示革兰氏阴性菌,10Me16:0、10Me17:0、10Me18:0 表示放线 菌,16:1ω5c、18:1ω9c、18:2ω6c 表示真菌,14:0、15:0、16:0、18:0 表示普通细菌[28]。
1.4 激发效应计算
样品中13C 的丰度表示为δ13C (‰):
式中:Rsample和Rv-PDB分别为样品的13C/12C 比率和维也纳Pee Dee Belemnite (V-PDB)标准[29]。
源于标记外源添加物和土壤本身的CO2部分计算方法如下:
激发效应(PE)表示为:
式中: CO2SOM和CO2control分别是添加外源标记物处理中土壤来源CO2和未添加标记物处理土壤产生的CO2。
1.5 统计分析
试验数据通过Microsoft Excel 2003 整理,利用IBM SPSS 20.0 软件中的Duncan 法进行处理间显著性差异分析;土样有机碳含量、外源添加物种类及二者交互作用对SOC 矿化量及激发效应采用多因素方差分析。使用SPSS Amos 20 (IBM,Armonk,USA)软件通过结构方程模型对添加物的质量和数量以及SOC 对微生物群落和有机碳矿化量的直接和间接影响进行分析。模型合理性通过χ2检验(P>0.05)、拟合优度指数(GfI >0.9)、逼近均方误差(RMSEA)确定,用最大释然法得到最佳拟合模型。采用Origin 18.0和SigmaPlot 12.5 作图。
2 结果与分析
2.1 试验前供试土壤基本理化性质和有机碳官能团特征
4 个SOC 含量的供试土壤基本理化性质和微生物生物量碳(MBC)含量见表1。总体来说,4 个土壤的基本理化性质和微生物生物量碳(MBC)含量大体随供试土壤SOC 含量的降低而减少。其中: SOC、TN、全磷(TP)含量都表现为SOC68>SOC32>SOC21>SOC11,有机磷(OP)含量表现为SOC68>SOC21>SOC32>SOC11,且处理间差异均显著(P<0.05);土壤pH 表现为SOC68>SOC32>SOC21 和SOC11(P<0.05);全钾(TK)含量表现为SOC32 和SOC21>SOC68 和SOC11 (P<0.05);速效钾(AK)含量表现为SOC68>SOC21>SOC32>SOC11 (P<0.05)。4 个供试土壤MBC有显著差异,其中SOC68 最高,其次是SOC32、SOC11,SOC21最低,MBC 依次为549.72 mg·kg-1、353.10 mg·kg-1、182.99 mg·kg-1、117.99 mg·kg-1(P<0.05) (表1)。通过傅里叶近红外光谱测定了4 个SOC 含量农田黑土的有机碳官能团红外光谱特征(图1),发现3 种有机碳官能团的相对峰面积在不同SOC 含量的土壤中存在差异。总体来看,1420 cm-1处的甲基和亚甲基碳官能团及2850 和2920 cm-1处的脂肪族碳官能团相对峰面积随土壤SOC 含量降低而减少,1630 cm-1处的芳香族碳官能团相对峰面积随着土壤SOC 含量降低而显著增加,SOC68 与SOC21 和SOC11 土壤有机碳官能团相对峰面积的差异显著(P<0.05)。
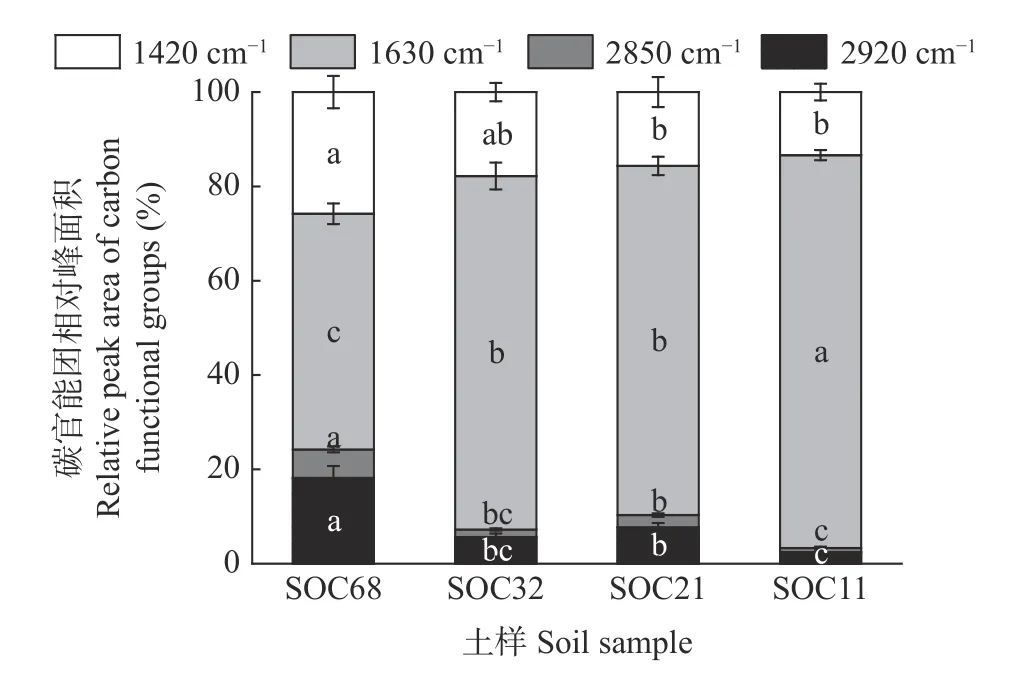
图1 4 个供试土壤主要有机碳官能团的相对峰面积Fig.1 Relative peak areas of main organic carbon functional groups of four bulk soils determined by Fourier Transform Infrared Spectroscopy
2.2 农田黑土有机碳矿化速率和累积矿化量特征
不同种类外源有机物添加后,4 个SOC 含量的农田黑土有机碳矿化速率和累积矿化量的响应不同(图2)。与CK 处理相比,添加丙氨酸、葡萄糖和秸秆均增加了4 个SOC 含量土壤有机碳矿化速率,且添加丙氨酸和葡萄糖后有机碳矿化速率要高于秸秆添加处理,SOC68 的土壤有机碳矿化速率高于SOC32 和SOC21,SOC 含量最低的SOC11 土壤有机碳矿化速率最低。在整个培养期,4 个供试土壤碳矿化速率呈先增加后降低的趋势,在培养30 d 后随培养时间趋于平稳,且在30 d 后各处理有机碳矿化速率无显著差异(P>0.05)。添加葡萄糖和秸秆处理下4 个土壤均在培养第1 天达到碳矿化峰值,SOC21和SOC11 这两个SOC 含量较低的土壤添加丙氨酸后在培养第3 天达到碳矿化峰值(图2A-D)。
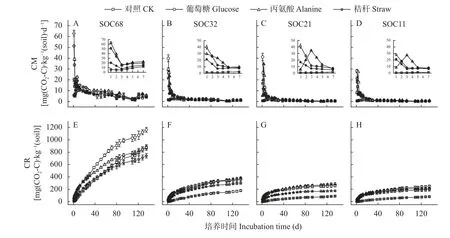
图2 不同种类外源有机物添加对不同土壤有机碳含量的农田黑土有机碳矿化速率(A-D)和累积矿化量(E-H)的影响Fig.2 Effects of addition of different types of exogenous organic materials on mineralization rate (A-D) and cumulative mineralization (E-H) of soil organic carbon of arable black soils with different soil organic carbon contents
与土壤碳矿化速率相似,相比对照,添加外源有机物后4 个土壤累积碳矿化量随时间显著增加,SOC 本底值越高的土壤,土壤累积碳矿化量越大,具体表现为SOC68>SOC32>SOC21 和SOC11(图2E-H)。SOC68 土壤添加葡萄糖后累积碳矿化量显著高于添加丙氨酸和秸秆处理。与CK 对照相比,添加葡萄糖、丙氨酸和秸秆后30 d 累积碳矿化量分别增加了69.54%、50.88%和13.14% (P<0.05);SOC32 和SOC21的土壤添加葡萄糖和丙氨酸后土壤累积碳矿化量变化趋势一致,显著高于秸秆添加处理(P<0.05)。与CK 对照相比,SOC32 的土壤添加葡萄糖、丙氨酸和秸秆30 d 的土壤累积碳矿化量分别增加了266.62%、227.93%和170.10%;SOC21 土壤添加丙氨酸、葡萄糖和秸秆30 d 的累积碳矿化量分别增加了381.20%、391.62%和209.48%;SOC11 土壤添加葡萄糖、丙氨酸和秸秆30 d 的累积碳矿化量增加了419.64%、409.48%和321.43%。土壤SOC 本底值越低,添加外源有机物后土壤相对累积碳矿化量增长率越高。双因素方差分析得出土壤SOC 含量和添加的外源有机物种类及其交互作用均显著影响135 d 土壤累积碳矿化量(P<0.05)(表2)。
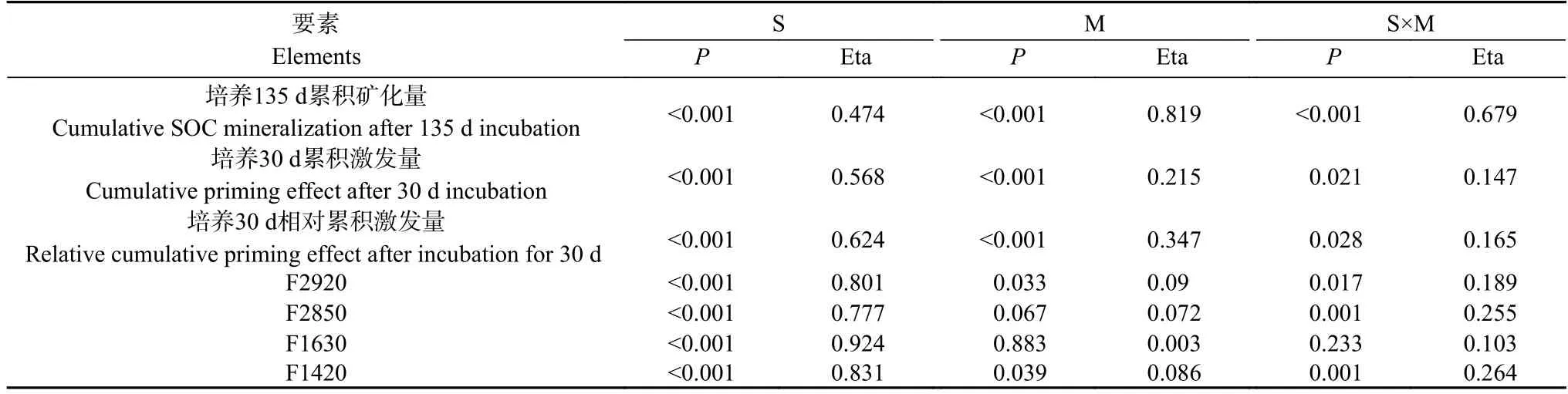
表2 土壤有机碳含量和外源有机物种类对土壤有机碳累积矿化量、累积激发量和有机碳官能团相对峰面积影响的双因素方差分析Table 2 Two-way ANOVA for the influences of soil organic carbon (SOC) content,addition of different types of exogenous organic materials and their interactions on cumulative SOC mineralization,cumulative priming effect and infrared relative peak area of SOC functional groups
2.3 不同有机碳含量农田黑土有机碳激发效应
土壤有机碳矿化量在培养试验的前30 d 变化剧烈,因此,本研究进一步分析了培养试验前30 d 的土壤碳激发效应特征。如图3 所示,不同外源有机物添加后4 个SOC 含量的农田土壤有机碳激发速率动态变化均表现出随着培养时间先达到峰值,后逐渐降低,最后趋于稳定的过程。葡萄糖和秸秆添加后4 个土壤有机碳的激发速率在第1天即达到峰值,丙氨酸添加后SOC 含量较高的SOC68 和SOC32 的土壤有机碳激发速率也在第1 天达到峰值,而低SOC含量的SOC21 和SOC11 的土壤有机碳激发速率于第3 天达到峰值,后随培养时间延长激发速率降低并趋于稳定。在培养试验30 d,SOC 含量较高的SOC68 和SOC32 的土壤有机碳激发效应仍未达到稳定状态,添加不同外源有机物的处理中土壤有机碳的激发效应存在显著差异(P<0.05),而SOC 含量较低的SOC21 和SOC11 土壤有机碳激发效应在不同添加物处理中趋于一致和稳定(图3A-D)。在4个SOC 含量的土壤中,添加葡萄糖和丙氨酸培养30 d有机碳累积激发量显著大于秸秆添加处理,且SOC含量越高的土壤,添加丙氨酸和葡萄糖培养30 d 的有机碳累积激发量越大(P<0.05)(图3E-H)。
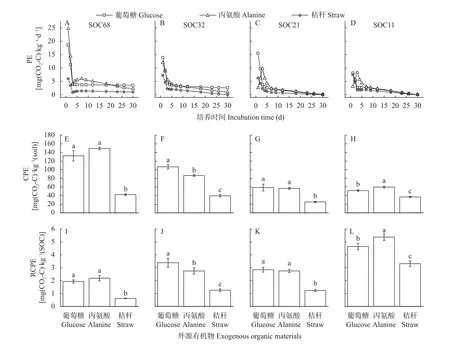
图3 不同种类外源有机物添加对农田黑土有机碳的激发效应(A-D)、培养30 d 的累积激发效应(E-H)和相对累积激发效应(I-L)的影响Fig.3 Effects of addition of different types of exogenous organic materials on priming effect (A-D),cumulative priming effect (EH) and relative cumulative priming effect (I-L) during the first 30 days of incubation of arable black soils with different soil organic carbon contents
SOC68 和SOC11 的土壤添加葡萄糖培养30 d土壤有机碳累积激发量低于添加丙氨酸处理,且在SOC11 土壤差异显著(P<0.05);而SOC32 和SOC21土壤添加丙氨酸培养30 d 土壤有机碳累积激发量低于添加葡萄糖处理,且在SOC32 土壤差异显著(P<0.05)。在相同外源有机物添加条件下,SOC 含量越低的土壤培养30 d 相对累积激发量越大。双因素方差分析发现SOC 含量和外源添加物种类及二者交互作用均显著影响培养30 d 累积激发量和相对累积激发量(P<0.05) (表2)。
2.4 不同有机碳含量农田黑土有机碳红外结构特征
培养135 d 结束后,各处理土壤的红外光谱结构如图4 所示。与对照相比,高SOC 含量的SOC68 土壤添加葡萄糖、丙氨酸和秸秆后,1420 cm-1处的甲基和亚甲基碳官能团、1630 cm-1处的芳香族碳官能团相对峰面积均降低,2850 cm-1和2920 cm-1处的脂肪族碳官能团相对峰面积不同程度增加,且添加秸秆处理变化显著(P<0.05)。SOC32 土壤添加3 种外源有机物后,1630 cm-1处的芳香族碳官能团相对峰面积显著降低,2850 cm-1和2920 cm-1处的脂肪族碳官能团相对峰面积显著增加(P<0.05)。SOC 含量较低的SOC21 土壤添加3 种外源有机物后,1420 cm-1处的甲基和亚甲基碳官能团及1630 cm-1处的芳香族碳官能团相对峰面积变化不显著(P>0.05),但添加葡萄糖处理1420 cm-1处的甲基和亚甲基碳官能团相对峰面积显著低于添加秸秆处理,1630 cm-1处的芳香族碳官能团相对峰面积的差异则相反(P<0.05);2850 cm-1和2920 cm-1处的脂肪族碳官能团相对峰面积仅在添加丙氨酸处理后显著增加(P<0.05)。SOC 含量最低的SOC11 土壤1420 cm-1处的甲基、亚甲基碳官能团相对峰面积在添加丙氨酸和葡萄糖后显著增加,添加秸秆后增加不显著;1630 cm-1处的芳香族碳官能团相对峰面积均降低,差异不显著(P>0.05);添加丙氨酸和葡萄糖处理2850 cm-1和2920 cm-1处的脂肪族碳官能团相对峰面积降低,添加秸秆处理有所增加,且添加秸秆后2850 cm-1处的脂肪族碳官能团增加显著(P<0.05)。
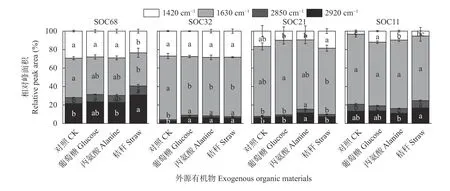
图4 培养结束(135 d)后不同外源有机物添加对农田黑土有机碳官能团相对吸收峰面积的影响Fig.4 Effects of addition of different types of exogenous organic materials on relative peak areas of organic carbon functional groups in arable black soils after 135 d incubation
以不同SOC 含量和添加有机物种类为双因素对土壤红外光谱相对峰面积进行双因素方差分析,结果发现SOC 含量显著影响各个碳官能团相对峰面积。添加物种类仅对2920 cm-1和1420 cm-1处的相对峰面积影响显著 (P<0.05)。不同SOC 含量土壤和外源添加的有机物种类对2850 cm-1、1630 cm-1、1420 cm-13 处的有机碳官能团的影响大小均表现为土壤SOC 含量>添加外源有机物种类(表2)。
2.5 不同有机碳含量农田黑土微生物群落组成
培养试验第30 天进行土壤破坏性取样,应用磷脂脂肪酸(PLFAs)方法测定了土壤微生物群落组成(图5)。4 个SOC 含量的土壤添加不同种类外源有机物后,土壤真菌和细菌群落数量的比值(F/B,023~0.53)与革兰氏阳性细菌和革兰氏阴性细菌的比值(G+/G-,0.65~1.61)变化不一致。与CK 相比,F/B 在SOC32 和SOC11 土壤中变化不显著(P>0.05),SOC68土壤添加丙氨酸和秸秆处理显著增加,SOC21 土壤添加葡萄糖处理显著降低(P<0.05)。与对照相比,G+/G-在SOC32 和SOC11 土壤中变化不显著(P>0.05),SOC68 土壤添加3 种外源有机物均显著降低,其中添加丙氨酸处理降低幅度最显著(P>0.05);SOC21 土壤添加外源有机物后,G+/G-增加,其中添加丙氨酸处理增加显著(P>0.05)(图5A)。
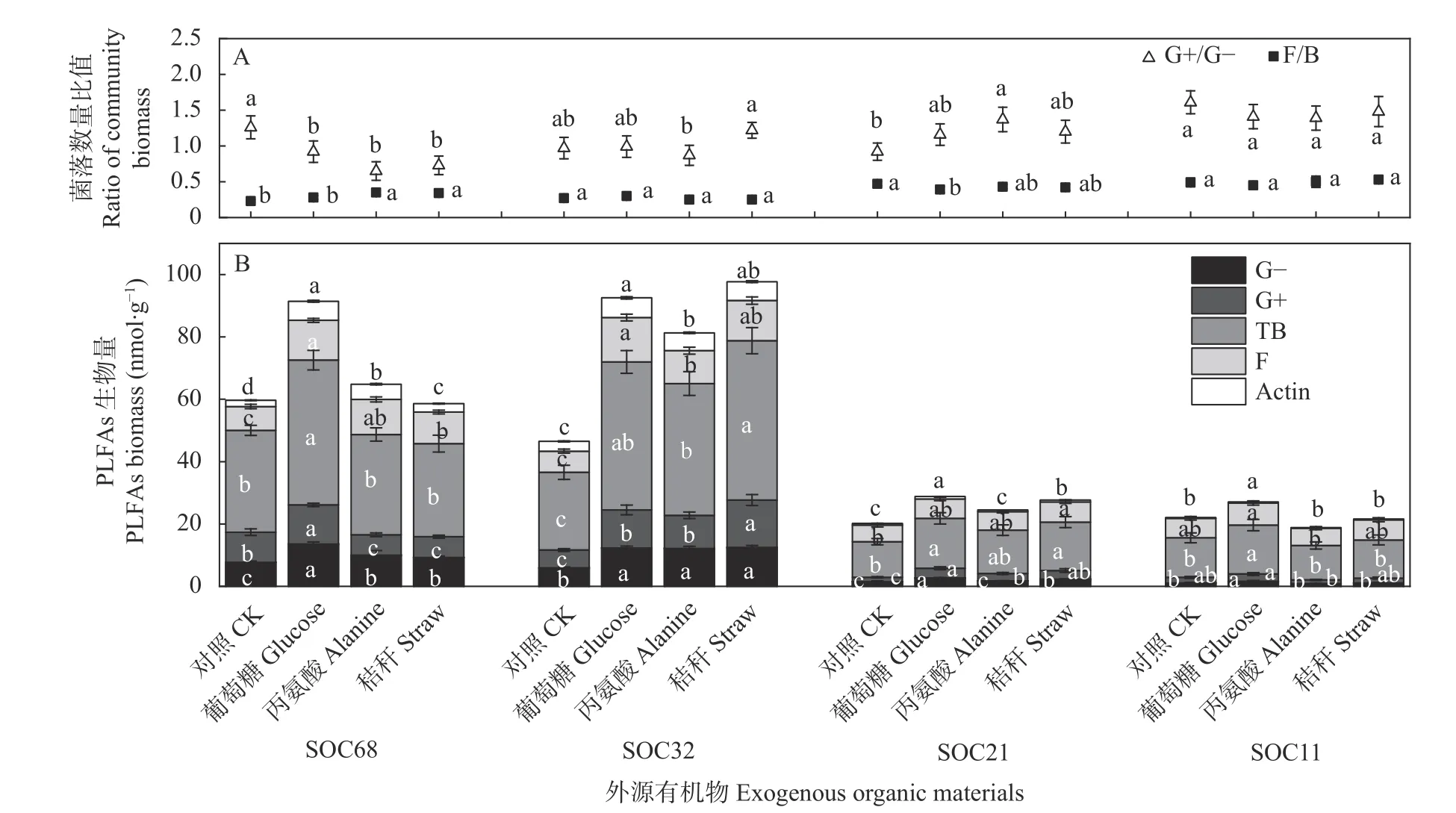
图5 培养30 d 不同外源有机物添加对不同有机碳含量农田黑土微生物群落组成的影响Fig.5 Impacts of addition of different types of exogenous organic materials on composition of microbial community in arable black soils with different exogenous organic carbon contents after 30 d incubation
SOC68 和SOC32 土壤不同外源有机物添加处理的革兰氏阳性、革兰氏阴性、总细菌、真菌和放线菌PLFAs 生物量以及总PLFAs 生物量均大于SOC21和SOC11 土壤各处理。与各自不添加外源有机物的对照相比,添加外源有机物处理的4 个供试土壤总PLFAs 和不同群落生物量响应特征不同。具体表现为: SOC68 土壤添加葡萄糖处理总PLFAs 和其他微生物种群PLFAs 生物量显著增加(P<0.05),而添加丙氨酸和秸秆处理增加幅度很小且不显著(P>0.05);SOC32 土壤添加3 种外源有机物后总PLFAs 和其他微生物种群PLFAs 生物量均显著增加(P<0.05),且增加幅度是添加秸秆处理>添加葡萄糖处理>添加丙氨酸处理;SOC21 和SOC11 土壤添加外源有机物后30 d的土壤总PLFAs、革兰氏阳性、总细菌群落PLFAs生物量增加显著,SOC11 处理添加丙氨酸和秸秆后土壤总PLFAs 和其他微生物种群PLFAs 生物量略有下降(P>0.05) (图5B)。
将土壤有机碳矿化激发效应指标与主要土壤有机碳官能团和磷脂脂肪酸指标进行相关性分析(图6),发现土壤有机碳的累积矿化量(CR)和累积激发效应(CPE)与总PLFAs、总细菌(Total PLFAs)、革兰氏阳性细菌(G+)、革兰氏阴性细菌(G-)、放线菌(Actin)生物量及有机碳官能团在1420 cm-1处吸收峰面积等显著正相关(P<0.05),与真菌(Fungi)、厌氧菌(Anaerobie)和有机碳官能团在1630 cm-1处吸收峰面积显著正相关(P<0.05)。相对累积激发效应(RCPE)仅与革兰氏阳性细菌(G+)、革兰氏阴性细菌(G-)和放线菌(Actin)生物量显著正相关,与真菌(Fungi)和厌氧菌(Anaerobie)显著负相关(P<0.05)。

图6 土壤有机碳矿化激发效应与土壤碳官能团和微生物群落组成相关性分析Fig.6 Correlation analysis of soil organic carbon mineralization and priming effect,soil carbon functional groups,and microbial community composition
结合不同外源有机物添加下4 个SOC 含量的土壤培养30 d 的微生物群落组成、有机碳官能团特征的变化构建结构方程模型(SEM),确定影响土壤有机碳激发效应的主要驱动因子。从图7 可以看出: 外源有机物添加、土壤自身有机碳含量通过影响土壤微生物群落中的细菌和放线菌的生物量以及F/B 和G+/G-的比值影响土壤有机碳的累积矿化量和激发效应,其中外源有机物添加对有机碳的矿化量和激发量及细菌和放线菌群落的生物量有显著正影响,对F/B 和G+/G-有显著负影响。土壤有机碳含量对微生物生物量和碳累积矿化量均为正影响,对累积激发量为负影响,细菌对碳累积矿化和激发量均为负影响,且对累计激发量影响显著,放线菌对有机碳的累积矿化量和激发效应均为显著正影响(图7)。
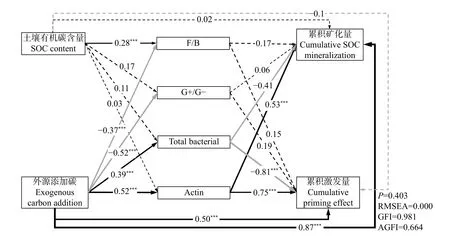
图7 不同外源有机物添加对不同有机碳(SOC)含量农田黑土激发效应影响的结构方程模型(SEM)Fig.7 Structural equation model (SEM) for the effect of different exogenous organic materials addition on soil priming effect in arable black soils with different soil organic carbon (SOC) contents
3 讨论
3.1 外源有机物的种类和土壤自身碳含量对土壤碳矿化激发的影响
以往研究发现添加外源有机物的种类和数量影响土壤有机碳的矿化和激发效应[20,30]。相比作物秸秆这类富含纤维素等较难分解的有机组分物质,葡萄糖和丙氨酸属于结构简单的化合物,进入土壤后主要以可溶性有机碳的形式存在于土壤溶液中,更易于被微生物分解利用[13-14]。在本研究中的整个培养过程中,添加3 种不同类型的外源有机物均使4个SOC 含量农田黑土的有机碳矿化速率和累积矿化量增加,且添加丙氨酸和葡萄糖后有机碳矿化速率要高于秸秆添加处理,进一步证实外源有机物种类影响土壤有机碳的矿化。SOC68 和SOC11 土壤添加葡萄糖处理后土壤有机碳的矿化增加量均大于丙氨酸添加处理。SOC21 和SOC11 土壤添加丙氨酸处理的有机碳矿化速率在第3 天达到峰值,其他处理均在第1 天达到峰值,这说明添加的外源有机物的化学组成和碳氮比在一定程度上影响土壤有机碳的矿化。You 等[30]发现向土壤中添加0.4 g(C)·kg-1葡萄糖和丙氨酸后,土壤有机碳的矿化速率均在第3天达到峰值,与本研究结果不一致,可能与添加外源有机物浓度[本试验中为0.8 g(C)·kg-1]或土壤自身SOC含量差异有关。Bimüller 等[31]发现,向含碳量为5%的土壤中添加0.0487 g(C)·kg-1和4.87 g(C)·kg-1的葡萄糖显著增加了土壤总碳矿化量。Bernal 等[32]研究发现向含碳量为2.2%~3.4%的土壤中添加0.4 g(C)·kg-1的葡萄糖或丙氨酸均可促进土壤有机碳的矿化量。也有研究发现向含碳量为1.2%的土壤中添加0.0204 g(C)·kg-1的葡萄糖对总有机碳矿化量没有影响[33]。
与此同时,土壤微生物在外源有机物或植物残体进入土壤转化为SOC 的过程中,也具有非常重要的作用[34]。土壤微生物自身对外源有机物具有不同的偏好利用能力,一般优先利用低分子量化合物,将一部分易分解利用的有机物矿化,以CO2的形式进入大气;另一部分转化为自身的微生物生物量碳,再通过自身代谢将这部分碳以微生物来源碳的形式固存在土壤中[35],即微生物“碳泵”理论[18]。在本研究中,丙氨酸和葡萄糖添加30 d 土壤碳累积矿化量及累积激发量均大于秸秆添加处理,且土壤自身SOC含量越高的处理,土壤碳的累积激发量越大,出现这一现象的主要原因是葡萄糖和丙氨酸的结构较秸秆简单,易被微生物快速利用。其他研究比较了葡萄糖和丙氨酸添加对土壤碳矿化激发特征的影响,发现相较于葡萄糖,添加丙氨酸的激发效应更强[36]。有研究表明,外源有机物添加引起的激发效应大小顺序为添加葡萄糖处理>添加丙氨酸处理,在培养第3天最强[30]。本研究SOC 含量较低的SOC21 和SOC11土壤添加丙氨酸后激发速率于第3 天达到峰值,但葡萄糖和丙氨酸添加后30 d 的累积激发量在不同SOC 含量土壤中不同。SOC32 和SOC21 土壤添加丙氨酸后土壤30 d 累积激发量小于葡萄糖添加处理,SOC68 和SOC11 土壤添加葡萄糖后30 d 的累积激发量小于丙氨酸添加处理,秸秆添加对土壤累积激发量的影响显著低于葡萄糖和丙氨酸添加处理。这说明不同SOC 含量的土壤,对外源有机物添加引起的激发效应的大小也会有差异[37]。以往研究也发现添加外源有机物的C∶N、木质素∶N 较低,其分解速率比C∶N、木质素∶N 较高的有机物质分解快[19]。本研究中,葡萄糖和丙氨酸的C∶N 和木质素∶N 的比值都低于秸秆,可部分解释添加葡萄糖和丙氨酸处理碳激发量高于秸秆添加处理。
本研究中,通过计算相对累积激发量发现,在相同外源有机物添加条件下,有机碳含量越低的土壤培养30 d 的相对累积激发量越大。而红外相对峰面积表明低有机碳含量的土壤相对于高有机碳含量土壤而言有机碳化学结构更稳定,即较高稳定性的碳会产生更大的激发效应,这与廖畅[38]对不同纬度梯度土壤碳激发效应特征的研究结果相似。刘本娟等[39]研究发现相同添加物处理下有机碳含量越高的土壤其累积碳矿化量越大,但激发效应量大小顺序与有机碳含量顺序不同。这与本试验的研究结果不同,本试验中相对累积激发量与土壤SOC 含量相反,原因可能是试验选择的土壤采于不同地点,土壤类型、理化性质和微生物群落结构特征相差较大,导致激发效应差异。本研究中,土壤SOC 含量越低,相同外源有机物添加处理下土壤碳累积排放量增加幅度越大,同时低SOC 含量土壤的相对激发效应大于高SOC 含量土壤,即SOC 含量越低的土壤对添加的外源有机物越敏感。
3.2 不同种类外源有机物添加对土壤有机碳化学结构特征的影响
一般而言,添加的外源有机物或植物残体中的低分子化合物会被优先利用分解,而化学结构相对复杂、难分解的碳组分会在土壤中不断富集,形成腐殖质在土壤中长期固存[40],与此同时,土壤自身有机碳的化学结构也相应改变[25]。本研究中,添加3 种有机物,4 个土壤在1630 cm-1处的芳香碳官能团峰面积呈减少趋势,而在2850 cm-1、2920 cm-1和1420 cm-1处的总脂肪族碳官能团峰面积呈增加趋势,这说明外源碳不断进入土壤有机质中,促进了土壤原有有机碳化学结构的变化和碳周转。前人研究也得出了类似结果。Baldock 等[41]利用13C-NMR 技术发现添加到土壤中的外源葡萄糖主要转化为烷氧基碳(66%)、烷基碳(26%)、羧基碳(8%)及很少的芳香碳。Lundberg 等[42]通过28 d 的培养试验发现添加的葡萄糖在分解初期主要转化为微生物生物量碳(如:非极性烷基碳),随培养时间增加,逐渐转化到微生物残体(如脂质碳),外源碳不断在土壤中固存。张月玲[43]通过添加13C 标记葡萄糖于黑土深层土壤中诱导产生了正激发效应,促进了原有SOC 的分解,48%的葡萄糖完全矿化,52%的葡萄糖转化为SOC,增加了土壤SOC 含量;进一步利用13C CP/TOSS NMR 技术,发现土壤有机质中易分解和难分解的有机化合物在培养过程中均发生了改变。添加葡萄糖后,土壤中烷基氮和带质子的烷氧基碳相对比例增加,氮芳香碳和酮/醛碳的相对比例降低,表明添加葡萄糖很可能激发了芳香碳的分解并抑制酮/醛的形成,也可能是由于培养过程中微生物群落组成和结构发生改变,葡萄糖被转化成了不同复杂程度的微生物残留物[41-42,44]。新形成的烷氧碳也可能来源于被矿物保护的葡萄糖残留物[45]。亚甲基与微生物细胞膜密切相关[46],其在土壤中的积累受微生物活性的影响[42]。本研究中,添加外源有机物处理中甲基和亚甲基相对峰面积发生了变化,进一步说明添加外源有机物会通过引起微生物群落结构变化导致土壤有机碳的化学结构变化。需要特别指出的是,本研究未发现土壤有机碳的官能团结构差异对土壤激发效应的影响,下一步研究中将考虑从13C-固体核磁共振和可溶性有机碳的紫外荧光光谱角度来研究对其黑土激发效应的影响。
芳香碳官能团的稳定性较强,可以用来指示土壤有机碳化学结构的稳定性,反映土壤有机碳的稳定性[47]。添加外源有机物会使土壤有机碳官能团特征发生改变,影响土壤有机碳的稳定性。石含之等[48]研究发现不同类型土壤有机碳化学结构对相同秸秆添加处理的响应变化不同,在黑土中,添加秸秆使土壤产生负激发效应,土壤芳香碳官能团比例增加,有机碳稳定性更高;在褐土和红壤中,加入秸秆后土壤产生正激发效应,土壤芳香碳官能团比例降低,土壤有机碳稳定性减弱。本研究发现添加外源有机物后,芳香碳官能团的比例不同程度降低,与前人研究结果一致。彭义等[49]基于黑土连续秸秆还田试验,分析土壤有机碳的红外光谱变化特征,并发现与秸秆不还田相比,秸秆覆盖后土壤氨基化合物、脂肪族碳和芳香族碳的相对比例下降。朱雪峰等[50]研究发现,秸秆覆盖使土壤有机碳组分中碳水化合物、芳香族碳和脂肪族碳相对增加。主要是由于大量添加的秸秆在腐解过程中,不断向土壤中输入大量的碳水化合物、芳香族碳、脂肪族碳,从而使添加秸秆的土壤中相应组分增加,但其秸秆的添加量大于本试验研究,这也是与本文培养试验结果不一致的主要原因。
3.3 外源有机物添加对土壤激发效应影响的微生物作用机理
土壤微生物对外源有机物的响应是土壤激发效应的驱动力[13]。外源有机物输入对土壤激发效应作用机理主要包括“共代谢”理论、“氮矿化”理论、“化学计量分解”理论和“底物优先利用”假说,这些机理主要从微生物群落响应、土壤酶活性或土壤碳氮养分转变等方面揭示土壤激发效应的作用机理[11]。这些机理的作用涉及到外源有机物的种类和数量、土壤微生物群落组成和活性、土壤自身养分状况等因素。从本研究来看,无论是简单易分解的葡萄糖和丙氨酸,还是较难分解的玉米秸秆添加所引起的土壤正激发效应都受到土壤总细菌、放线菌、F/B 和G+/G-比值的影响(图6,图7)。外源有机物性质、土壤自身有机碳的有效性通过土壤微生物群落组成和结构影响土壤有机碳的累积矿化和激发效应,其中外源有机物的添加量对碳矿化激发量和细菌真菌量有显著正影响,对F/B 和G+/G-有显著负影响。这说明外源有机物的添加显著促进了土壤中k 型微生物的生长代谢,使土壤有机碳中难分解的组分降解,加速土壤自身SOC 中难分解组分的分解,产生正激发效应[8,51]。相对激发效应不受土壤不同SOC 含量的影响,在4 个SOC 含量土壤中均产生正激发效应,这与图6 中不同SOC 含量对土壤碳累积矿化量和激发量影响不显著这一结果相一致。从上述影响农田黑土碳激发效应的因素来看,外源有机物的添加为土壤微生物带来了充足的碳源和氮源,在这种情况下土壤中k 型微生物增加显著,如革兰氏阴性细菌和放线菌的生长代谢加快,分解的胞外酶促进了SOC 中难分解组分的降解,加速了土壤自身SOC 的分解,导致较大的正激发效应。“共代谢”理论是本研究外源有机物添加引起4 个SOC 含量农田黑土正激发效应的主要作用机理。
4 结论
1)外源有机物的添加促进了4 个不同SOC 含量的农田黑土有机碳的矿化,引起土壤正激发效应,激发效应的强度因添加的外源有机物的种类和土壤自身SOC 含量差异而异。
2)农田黑土添加葡萄糖和丙氨酸处理后土壤累积碳矿化量和激发量显著大于秸秆添加处理,土壤本底SOC 含量越高,累积碳激发量越大,但相对累积激发量越小。
3)外源有机物添加后,土壤中脂肪族碳官能团相对峰面积略增,芳香族碳官能团略减,土壤SOC 含量对二者的影响均大于添加有机物的种类。
4)相关性分析和结构方程模型结果发现,外源有机物添加引起的土壤正激发效应主要受土壤中细菌和放线菌的影响,外源添加有机物的种类、土壤自身有机碳的有效性通过改变土壤微生物群落组成和结构影响土壤碳激发,且相对激发效应不受自身SOC 含量的影响。
5)外源有机物的添加显著增加土壤中k 型微生物的生长,如革兰氏阴性细菌和放线菌的生长代谢加快,促进了SOC 中难分解组分的降解。外源有机物和土壤自身有机碳的“共代谢”机制是本研究黑土产生正激发效应的主要作用机理。
