微反应器策略实现γ-CuI的形貌调控
2023-10-25占思进王诗瀚胡国涛杨晓健王先炜
占思进,游 立,刘 飞,王诗瀚,胡国涛,杨晓健,张 丹,王先炜
(1.贵州大学化学与化工学院,贵阳 550025;2.中低品位磷矿及共伴生资源高效利用国家重点实验室,贵阳 550025;3.瓮福(集团)有限责任公司,贵阳 550025;4.贵阳开磷化肥有限公司,贵阳 550025)
0 引 言
γ-CuI具有较宽的禁带宽度、良好的光吸收能力等,在薄膜太阳能电池、可见光催化降解水污染及光闪烁探测器等领域得到广泛应用[1-7]。除此之外,γ-CuI还可以应用在飞秒激光系统、量子点荧光材料等前沿领域,并取得了一定的进展[8-9]。
目前,合成γ-CuI的方法主要有机械搅拌法、微乳液法、共沉淀法、溶剂热合成法及液相沉淀法等[10-12],但都无法兼顾生产效率及材料性能的平衡。溶剂热法虽然过程可控,但是生产效率低下、热能消耗高导致其无法大规模生产;共沉淀法虽然能够实现连续生产,但是生产过程中会产生大量有机废料,回收成本较大,使其难以实现工业化;液相沉淀法无法制备得到规则形貌及均匀粒径的γ-CuI,且随着生产时间的延长γ-CuI将会出现团聚等问题;而机械搅拌法产生的副产物较多,其中分子碘的析出将导致严重的碘资源浪费。在之前的研究中,本课题组以硫酸铜与粗碘为原料,水合肼(N2H4·H2O)作为还原剂,通过微乳液法制备得到粒径均一的六边形γ-CuI薄片[13]。研究结果表明,微乳液法在γ-CuI的制备过程中能够形成合适的界面膜强度,从而能有效控制γ-CuI的粒径与形貌。但是由于微乳液法中有机溶剂的大量使用导致废弃物难以回收,这将极大地限制γ-CuI微乳液法的工业化。
微反应法近年来在材料制备中得到了广泛应用[14],这主要是由于反应通道狭小(10~500 μm),原料能够在微结构反应器中以毫秒的速率快速混合,因而可以调控得到性能稳定的产物。此外,微反应法还能够实现连续的生产,从而提高生产效率。骆广生等通过使用微反应技术设计并制备了一系列氧化锆(ZrO2)、氧化锌(ZnO)、氧化铈(CeO2)等纳米级材料,结果表明所制备的材料还具有高的荧光稳定性和生物相容性[15-17]。陈光文团队利用微反应技术制备了用于光催化的Ag/AgCl/ZnO复合催化剂,该方法相较于传统方法简单易行、可控度高,对甲基橙的分解速率提高了4倍,除此之外,制备所得到的催化剂具有更高的稳定性,在分解多种有机物和抗生素废水中展示出较高的活性[18]。微反应器具有较好的传质传热能力及产物成核速度快等特点,其在控制产物形貌方面具有一定优势。例如,张春玲等[19]通过对制备过程中的关键参数进行优化,制备出了具有高比表面积与较稳定孔径分布的ZnO微球。Klochko等[20]通过微流控制技术,制备了具有玫瑰花瓣形貌,且具备良好疏水性的CuI,并通过调整反应参数,对样品形貌和晶体生长方式进行了精确的调控。
纳米棒状γ-CuI在光学上表现出相较于其他形貌更强的吸收和发射特性[21-22]。因此,本工作通过优化pH调节剂、合成温度、管内反应停留时间、铜源和NH3·H2O使用量等条件,在微筛微孔反应器中连续制备出均一棒状γ-CuI。并通过扫描电子显微镜(scanning electron microscope, SEM)、X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)、傅里叶红外光谱(Fourier transform infrared spectrometer, FT-IR)和X射线衍射(X-ray diffraction, XRD)等表征,讨论了制备条件对γ-CuI晶相与形貌的影响,并推测了微筛微孔反应器和传统釜式反应器合成γ-CuI的机理。
1 实 验
1.1 原 料
CuSO4·5H2O(五水硫酸铜,纯度99%,国药试剂)、CuCl2·2H2O(二水氯化铜,纯度99%,国药试剂)、Cu(NO3)2·3H2O(三水硝酸铜,纯度99%,国药试剂)、Cu(CH3COO)2·H2O(一水醋酸铜,纯度98%,国药试剂)、CTAB(十六烷基三甲基溴化铵,纯度98%,阿拉丁试剂)、KI(碘化钾,纯度99%,国药试剂)、N2H4·H2O(水合肼,纯度98%,阿拉丁试剂)、NH3·H2O(氨水,浓度28%,国药试剂)、C2H5OH(乙醇,纯度99.9%,富宇试剂)。
1.2 微反应法制备γ-CuI
将N2H4·H2O与KI混合,并加入适量NH3·H2O来调节pH值(文中NH3·H2O使用量皆为CNH3·H2O/CN2H4),最后再加入总摩尔量1%的CTAB作为表面活性剂,得到的溶液作为分散相。分散相经过直径为200 μm不锈钢微筛孔板后进入微反应器内,与作为连续相的铜源溶液进行混合。通过改变反应管出口的长度来调整管内反应停留时间,在微反应器出口处收集沉淀产物。随后将所收集的产物用无水乙醇和去离子水洗涤3次,将过滤得到的产物放入105 ℃鼓风干燥箱中干燥2 h,即可得到所需的产物。微反应器在反应过程始终置于恒温水浴中,通过调节水浴温度来控制反应的温度。
1.3 传统液相沉淀法制备γ-CuI
将一定量NH3·H2O、CTAB、N2H4·H2O和KI在反应釜中混合,随后向其中以3 mL/min的速率缓慢滴加适量浓度的Cu(CH3COO)2·H2O溶剂,连续搅拌1 h后,过滤并收集沉淀,随后将所收集的产物用无水乙醇和去离子水洗涤3次,将过滤得到的产物放入105 ℃鼓风干燥箱中干燥2 h,即可得到所需的产物。
1.4 分析测试
利用荷兰PANalytical X′Pert PRO X射线衍射(XRD)仪对样品的结构进行表征,其条件为:扫描速率10 (°)/min,管流40 mA,管压40 kV,扫描区域2θ=10°~90°,并使用Cu Kα辐照源,以确保分析结果的准确性和可靠性。样品的形貌采用日立SU8010型扫描电子显微镜(SEM)进行表征,并结合美国Thermo Fisher公司的K-Alpha+XPS对样品的物理化学结构和材料结构进行深入研究。(使用标准C 1s结合能对样品数据进行校准)。通过美国Thermo Fisher公司的IS50 FT-IR型红外光谱仪对样品定性测试。
2 结果与讨论
2.1 NH3·H2O用量对γ-CuI晶相和形貌的影响
使用Cu(CH3COO)2·H2O作为Cu源,分散相与连续相流速均为20 mL/min,管内时间为10 s,在水热温度为20 ℃的条件下进行反应,改变NH3·H2O的使用量,研究NH3·H2O使用量对γ-CuI晶相的影响。不同NH3·H2O使用量所合成样品的XRD图谱如图1所示。
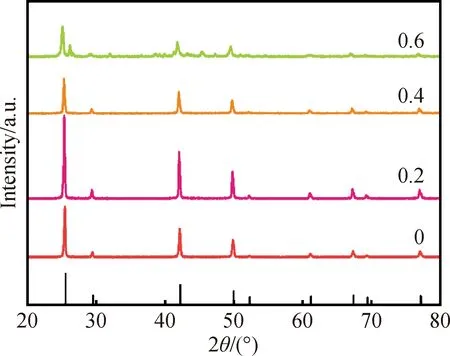
图1 不同NH3·H2O使用量的γ-CuI样品XRD图谱Fig.1 XRD patterns of γ-CuI with different amounts of NH3·H2O
当NH3·H2O使用量小于0.4时,产物所测得的衍射峰基本与γ-CuI标准卡片(JCPDS:06-0246)一致,依次在25.44°、42.14°、52.25°处出现了γ-CuI的特征衍射峰,分别对应(111)、(220)和(222)三个晶面。但是当NH3·H2O使用量逐渐提升时,产物的衍射峰强度减弱,衍射峰半峰全宽增加,根据谢乐公式,这可能是样品结晶尺寸减小导致的。但是随着NH3·H2O使用量提升到0.6,图中γ-CuI特征峰出现明显的减弱趋势,同时出现杂峰,这说明样品结晶度下降的同时,可能形成了杂质。从FT-IR图谱(图2)发现,当NH3·H2O使用量在0.6时,样品在1 140.70、1 578.47和3 271.69 cm-1处出现了分别对应N—H的伸缩振动和N—H的弯曲振动的衍射峰,说明样品中出现了含氮杂质,这个结果与XRD的推测相一致。
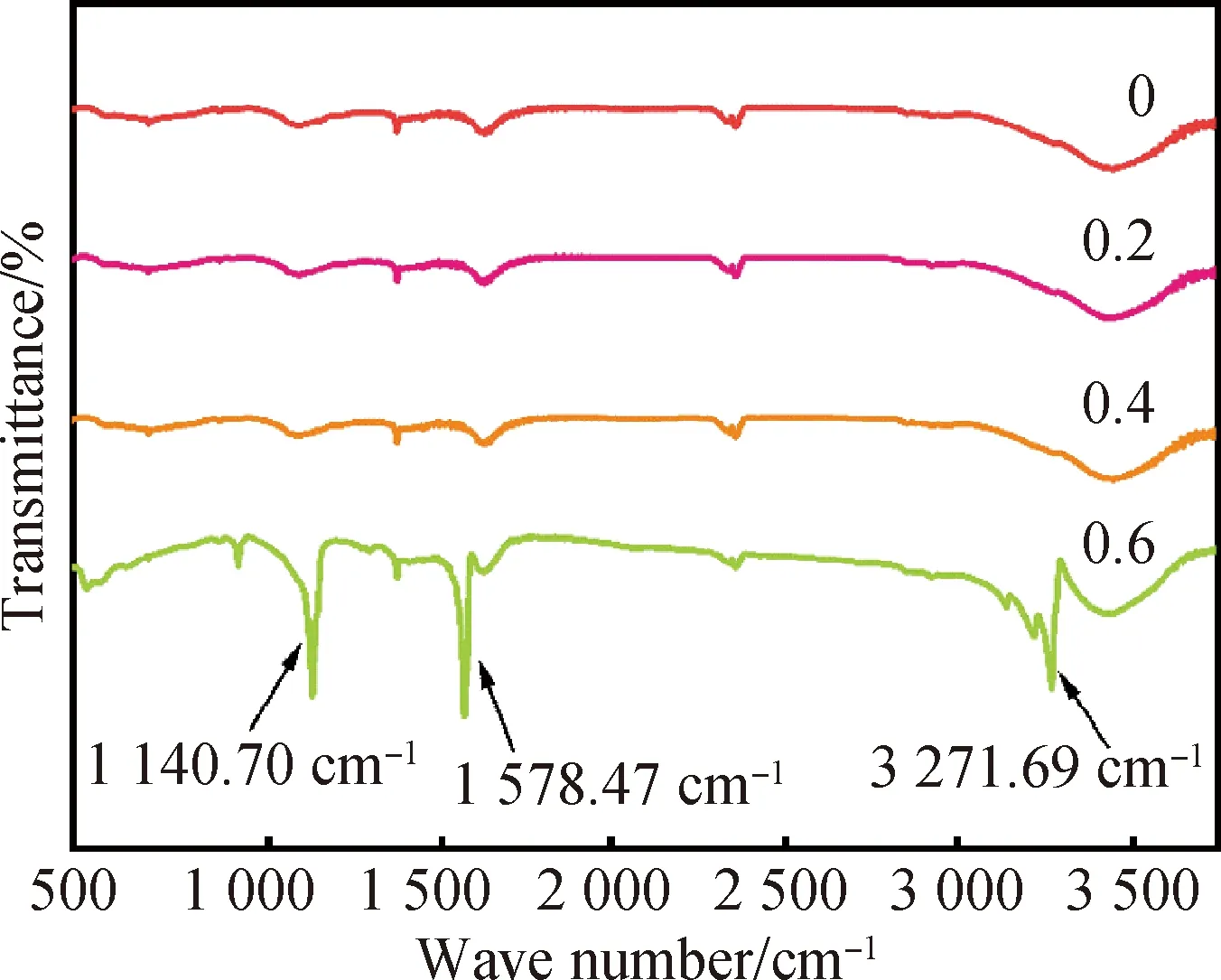
图2 不同的NH3·H2O使用量的γ-CuI的FT-IR光谱Fig.2 FT-IR spectra of γ-CuI with different amounts of NH3·H2O
通过观察XPS全谱图,如图3(a)所示,发现NH3·H2O使用量低于0.4时,样品以纯γ-CuI相存在。但是当NH3·H2O使用量达到0.6时,图谱中出现了N—H基团的N 1s峰(结合能为400.47 eV)。这进一步证实了前文所分析的FT-IR结果。根据图3(b)的数据可以发现,所有NH3·H2O使用量下制备的样品的Cu 2p轨道结合能均与Cu+结合能相同,这说明所有样品中Cu均为+1价[23]。
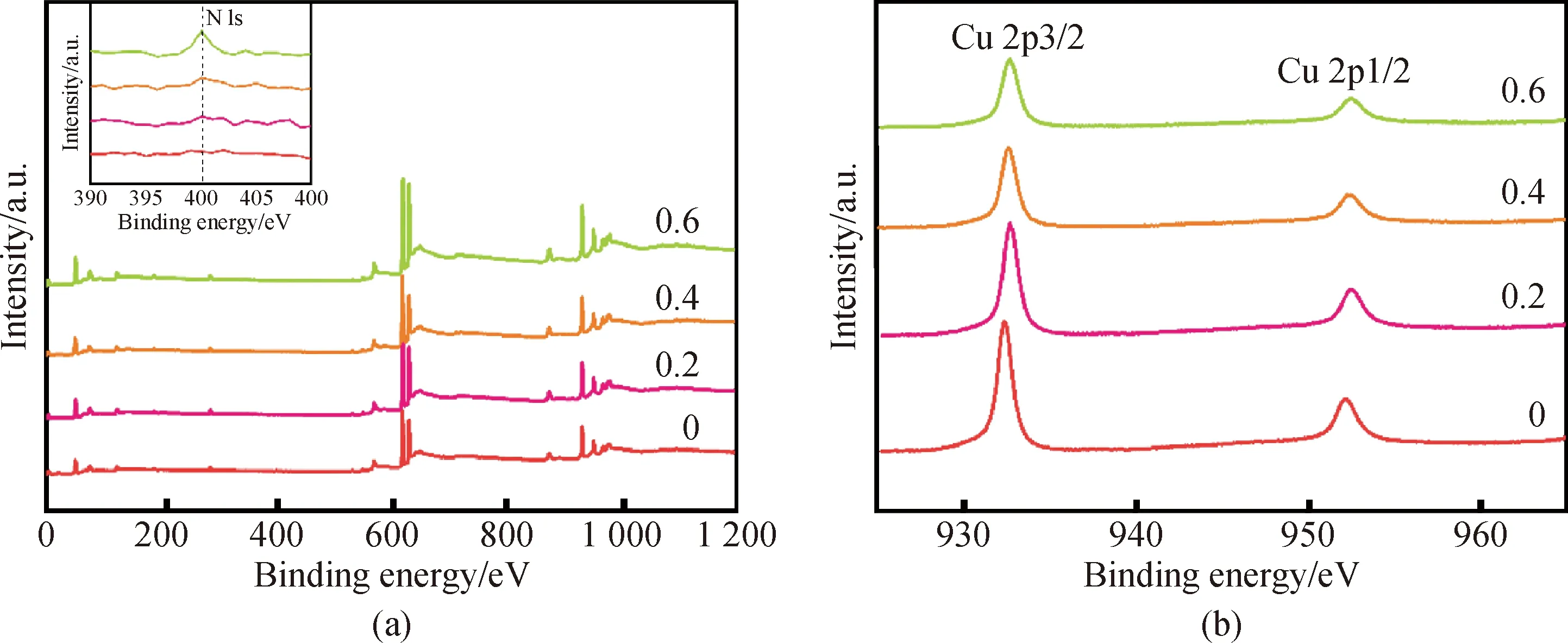
图3 不同NH3·H2O使用量的XPS全谱图(嵌入图为全谱图局部放大图)(a)及XPS的Cu 2p图(b)Fig.3 XPS (the embedded figure is a partial enlargement of the full spectrum) (a) and Cu 2p map of XPS (b) with different amounts of NH3·H2O
图4为3种NH3·H2O使用量下所合成γ-CuI的产率图。其中,NH3·H2O使用量为0.2时γ-CuI产率较低,这可能是因为N2H4·H2O在还原过程中产生了H+,产生的H+与未反应的N2H4·H2O结合形成N2H5+络合物(如式(1)所示),反应过程中N2H4·H2O被大量消耗而导致Cu2+还原效率下降,进而降低了合成效率。而当NH3·H2O使用量提升后,NH3·H2O水解产生大量的OH-(如式(2)所示),OH-在反应过程中中和掉了过量的H+,这使得产率提升至90.5%。进一步增加NH3·H2O使用量,虽然产率仍有提升,但是过量的NH3·H2O将会使产物中出现杂质,因此将0.4作为最佳NH3·H2O使用量。
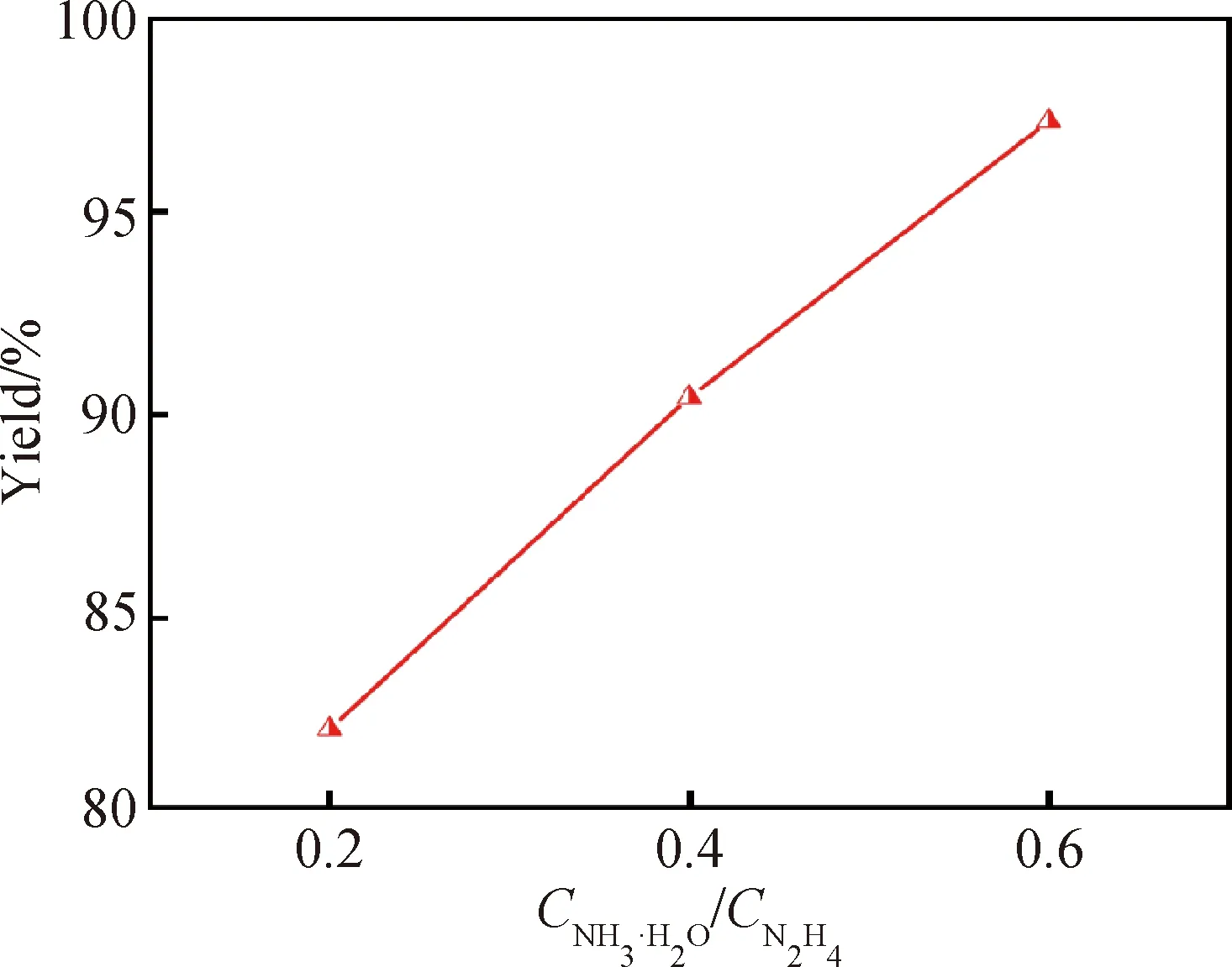
图4 不同NH3·H2O使用量的γ-CuI的产率Fig.4 Yield of γ-CuI with different amounts of NH3·H2O
(1)
(2)
如图5(a)所示,当未使用NH3·H2O时,样品为纳米颗粒状形貌,且较为分散。当NH3·H2O使用量达到0.2时,CuI纳米颗粒增大,如图5(b)所示。NH3·H2O使用量为0.4时,样品的形貌则主要为棒状,如图5(c)所示。当NH3·H2O使用量进一步增加至0.6时,形貌则重新转化为颗粒状结构,如图5(d)所示。根据以上数据,发现样品的形貌对NH3·H2O的使用量异常敏感。当NH3·H2O的使用量从0增加到0.4时,γ-CuI的形貌由颗粒状转变为棒状,而从0.4增长到0.6时,颗粒状CuI重新聚集,并重新形成颗粒状结构。

图5 不同NH3·H2O使用量下γ-CuI的SEM照片Fig.5 SEM images of γ-CuI with different amounts of NH3·H2O
2.2 制备工艺条件对γ-CuI形貌的影响
2.2.1 不同铜源对样品晶相和形貌的影响
在20 ℃的合成温度,管内时间为10 s,NH3·H2O的使用量为0.4的条件下,使用不同Cu源以探究不同的Cu源对γ-CuI的晶型晶相及微观形貌的影响。由图6样品的XRD图谱可以发现,铜源的不同对γ-CuI的晶型没有影响。
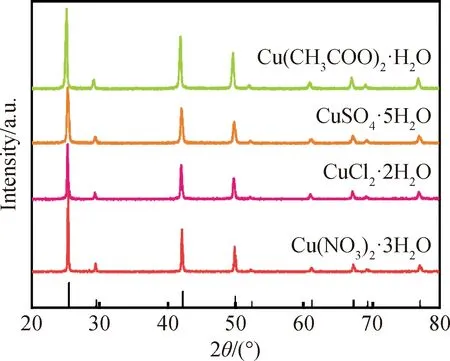
图6 不同种类铜源合成样品的XRD图谱Fig.6 XRD patterns of synthetic samples from different types of Cu sources
使用不同的Cu源种类在样品的合成中对形貌有明显影响,如图7所示。在相同的合成条件下,以五水硫酸铜(CuSO4·5H2O)、二水氯化铜(CuCl2·2H2O)和三水硝酸铜[Cu(NO3)2·3H2O]这三种无机盐作为Cu源所合成的Cu均为颗粒状,而使用Cu(CH3COO)2·H2O有机Cu源合成的CuI形貌为棒状结构,如图5(c)所示。推测CH3COO-根离子是影响CuI形貌变化的原因,CH3COO-为有机弱酸根离子,弱酸根会因为水解而释放OH-,在碱性条件下,Cu离子会与CH3COO-、NH3·H2O和N2H4·H2O生成新的络合物醋酸二氨合铜[Cu(NH3)2]Ac[24]。其与I-形成沉淀,最后得到棒状γ-CuI。

图7 不同种类Cu源合成样品的SEM照片Fig.7 SEM images of synthetic samples from different Cu sources
2.2.2 管内时间对样品晶相和形貌的影响
在合成温度为20 ℃,NH3·H2O的使用量为0.4的条件下,以Cu(CH3COO)2·H2O作为铜源进行合成。通过调节微反应器出口的管路长短,控制管内时间,研究不同时长的管内时间对γ-CuI晶型与形貌的影响。如图8所示,不论时间长短,CuI样品均呈立方晶型γ-CuI,这表明管内时间的长短不会对CuI的晶相产生显著影响。
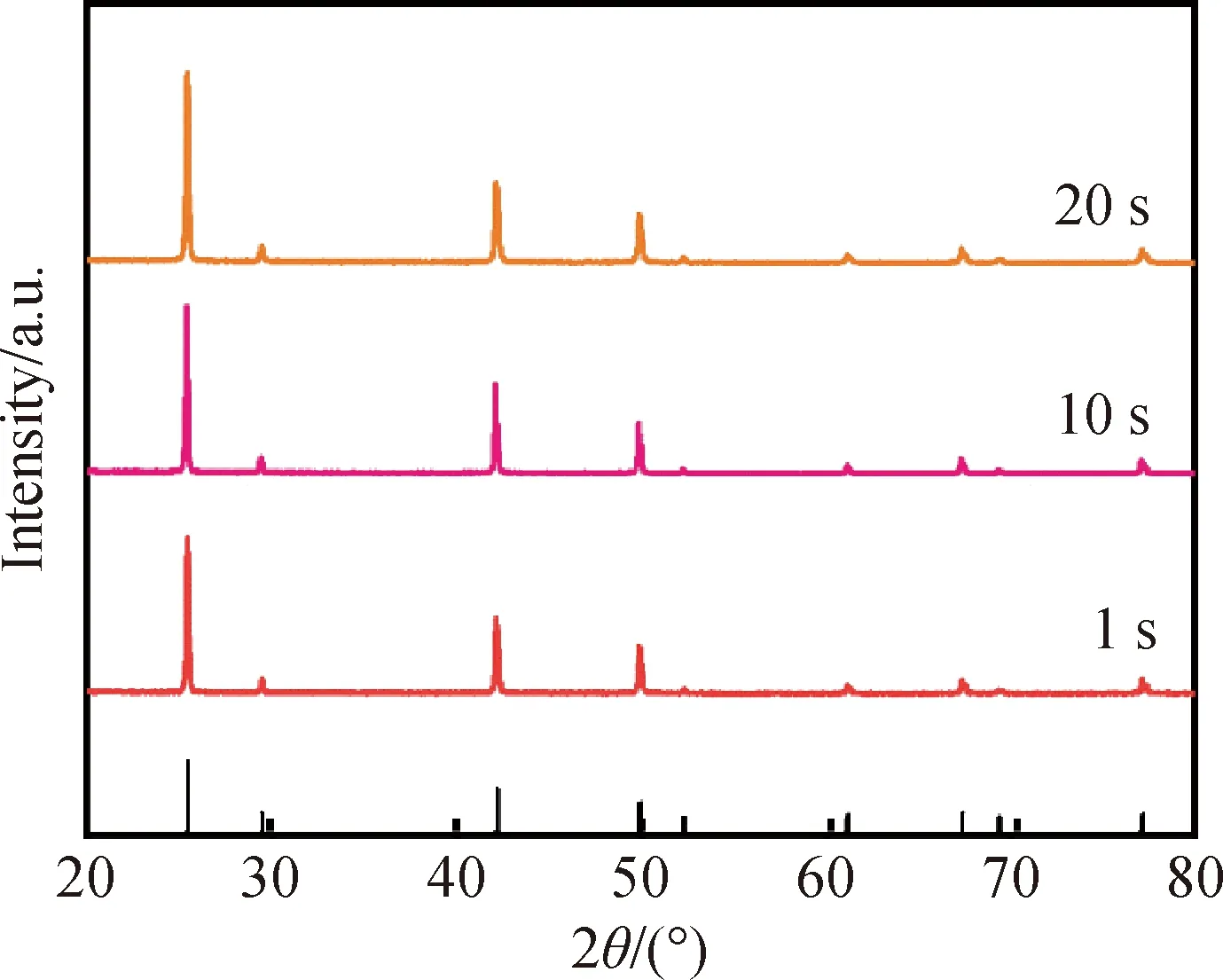
图8 不同管内时间制备的样品XRD图谱Fig.8 XRD patterns of synthetic samples for different in-tube reaction residence time
不同的管内时间所制备的样品的SEM照片如图9所示。图9(a)颗粒状样品为停留时间为0 s时所制备得到;图5(c)与图9(b)棒状样品分别为停留时间为10与20 s时所制备得到,形貌相比0 s时的更为均匀。这是因为管内时间过短,反应物将无法完全混合,部分反应物未能完全沉淀,从而使得产物在管中继续生长,最终形成不规则的颗粒状样品。随着管内时间的增加,反应物的形貌发生了显著变化,得到了更加均匀的纳米棒状γ-CuI。但是,管内时间为20 s时将会引起反应物在管内附着,导致损失。因此,10 s的管内时间更有利于合成棒状γ-CuI,如图5(c)所示。

图9 不同管内时间制备的样品SEM照片Fig.9 SEM images of synthetic samples for different in-tube reaction residence time
2.2.3 合成温度对样品晶相和形貌的影响
在NH3·H2O使用量为0.4,管内时间为10 s的条件下,以Cu(CH3COO)2·H2O作为Cu源,通过改变水热温度以控制合成温度,探究不同合成温度对γ-CuI形貌的影响。由图10中不同样品的XRD图谱可知,合成温度的改变对γ-CuI晶型没有影响,合成的γ-CuI均为立方晶型γ-CuI。

图10 不同温度下合成样品的XRD图谱Fig.10 XRD patterns of synthetic samples at different temperatures
当合成温度为20 ℃时,样品形貌主要为棒状,如图5(c)所示。图11为不同温度下的样品SEM照片,经过观察可以发现,随着温度的提高,样品形貌开始向颗粒状转变。至80 ℃时,样品的形貌则以颗粒状为主,如图11(c)所示。这是由于合成温度的提升,成核速率过快,棒状晶体生长条件被破坏,样品更趋向于形成不定型的颗粒状,如图10所示,可以观察到80 ℃时样品特征峰强度明显降低,这说明样品的结晶度下降,样品形貌更趋向不定形颗粒,这与我们的推测相符。

图11 不同温度下合成样品的SEM照片Fig.11 SEM images of the synthetic samples at different temperatures
2.3 微反应法与液相沉淀法对样品形貌的影响及其形成机理
2.3.1 不同制备方法对样品形貌的影响
使用微反应法与液相沉淀法合成制备γ-CuI并进行对比,两种方法分别在微反应器和反应釜中进行反应。其中,微反应法的反应条件为:合成温度为20 ℃,Cu(CH3COO)2·H2O作为Cu源,管内时间为10 s。液相沉淀法的反应条件与方法如1.3小节中所述,其他反应条件均与微反应法相同。如图12所示,所有γ-CuI均为立方晶型,这表明不同制备方法对样品的晶相无明显影响。图13为使用传统液相沉淀法所制备的样品的SEM照片,与图5(c)相比可以看出,传统液相沉淀法制取的样品大多呈块状,而微反应法制取的样品则主要为棒状。
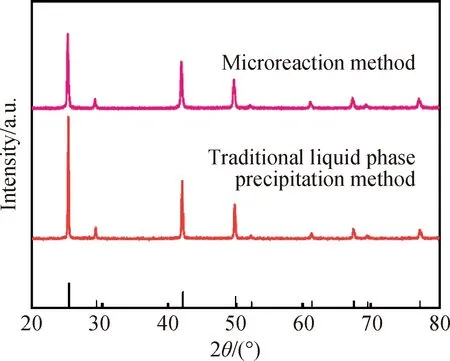
图12 不同方法合成样品的XRD图谱Fig.12 XRD patterns of samples synthesized by different methods

图13 使用传统液相沉淀法所制备的γ-CuI的SEM照片Fig.13 SEM image of γ-CuI prepared by traditional liquid phase precipitaion method
2.3.2 不同方法所制备样品的形成机制分析
经过实验发现,在相同的反应条件下,微反应器可以制造出纳米棒状的γ-CuI,但釜式反应器制造出的则为块状与不定形颗粒的γ-CuI。实验发现,不同制备方法对形貌的形成有明显影响。本文进一步探索不同的γ-CuI形貌的产生机理。
微反应器拥有极高的传质速度,而且为连续合成,其成核-生长过程能够在微通道内连续且稳定进行,图14为棒状纳米γ-CuI在微反应器中的形成过程。在微反应器中,原料会以毫秒级速率迅速混合均匀,同时Cu2+被原为Cu+,并形成络合物[Cu(NH3)2]Ac,然后,在I-的作用下,Cu被沉淀,最终形成γ-CuI纳米棒。由于微通道具备平流化学反应器的特性,γ-CuI可以在微通道内进行稳定的成核-生长过程,并获得形貌粒径均匀的γ-CuI纳米棒。
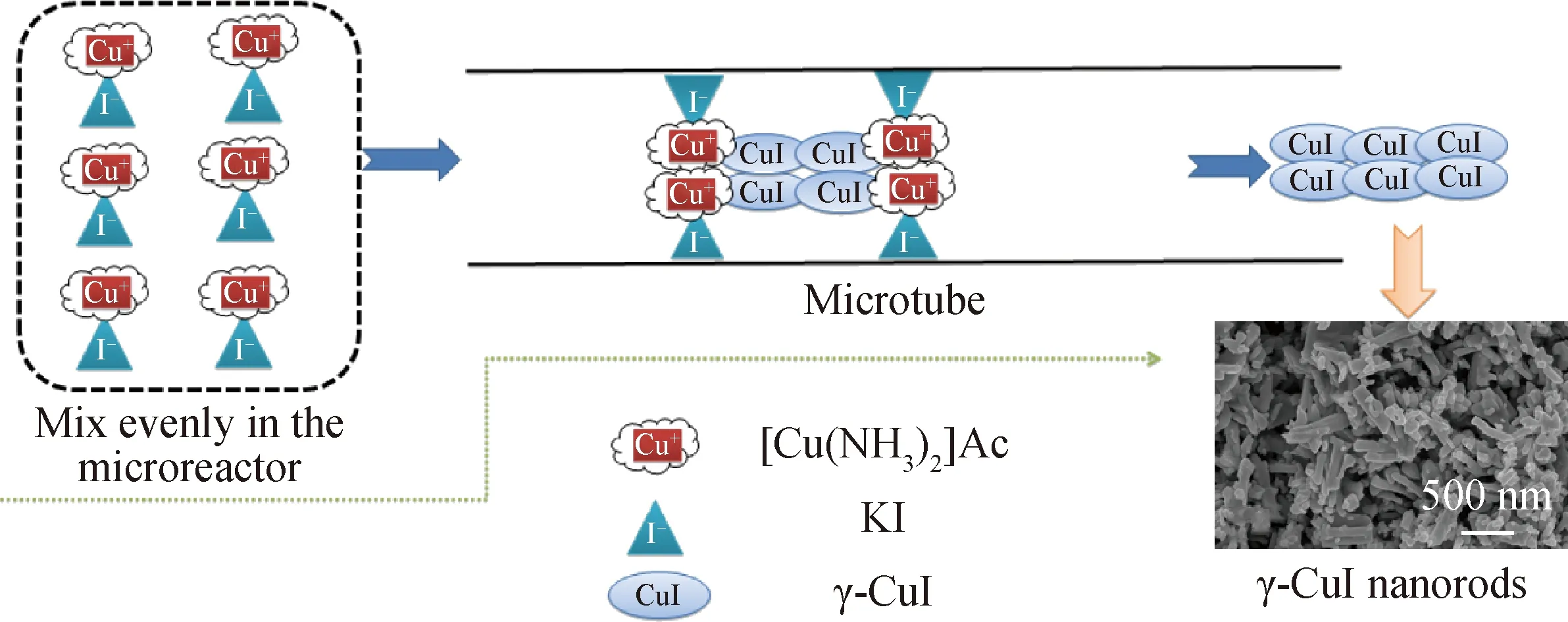
图14 使用微反应器制备棒状γ-CuI的过程示意图Fig.14 Schematic diagram of the process for preparing γ-CuI nanorods using microreactor
使用釜式反应器制备γ-CuI是传统液相沉淀法的一种,反应器内块状γ-CuI的形成过程如图15所示。由于釜式反应器的搅拌方式混乱,传质间距大,混合效率较低,系统内物质无法在短时间内混合均匀,造成Cu2+还原化学反应无法彻底完成,Cu+与I-含量分布不均匀,系统中结晶处在无序生长状况,从而影响了γ-CuI的制取效果。并且,在反应釜中,反应物与结晶的混杂会引起晶核的二次生长和重聚,致使γ-CuI的结构变得更加复杂,形成了尺寸较大、分布不均匀的块状结构。而这种不均匀的结构限制了γ-CuI产品的工业化应用。
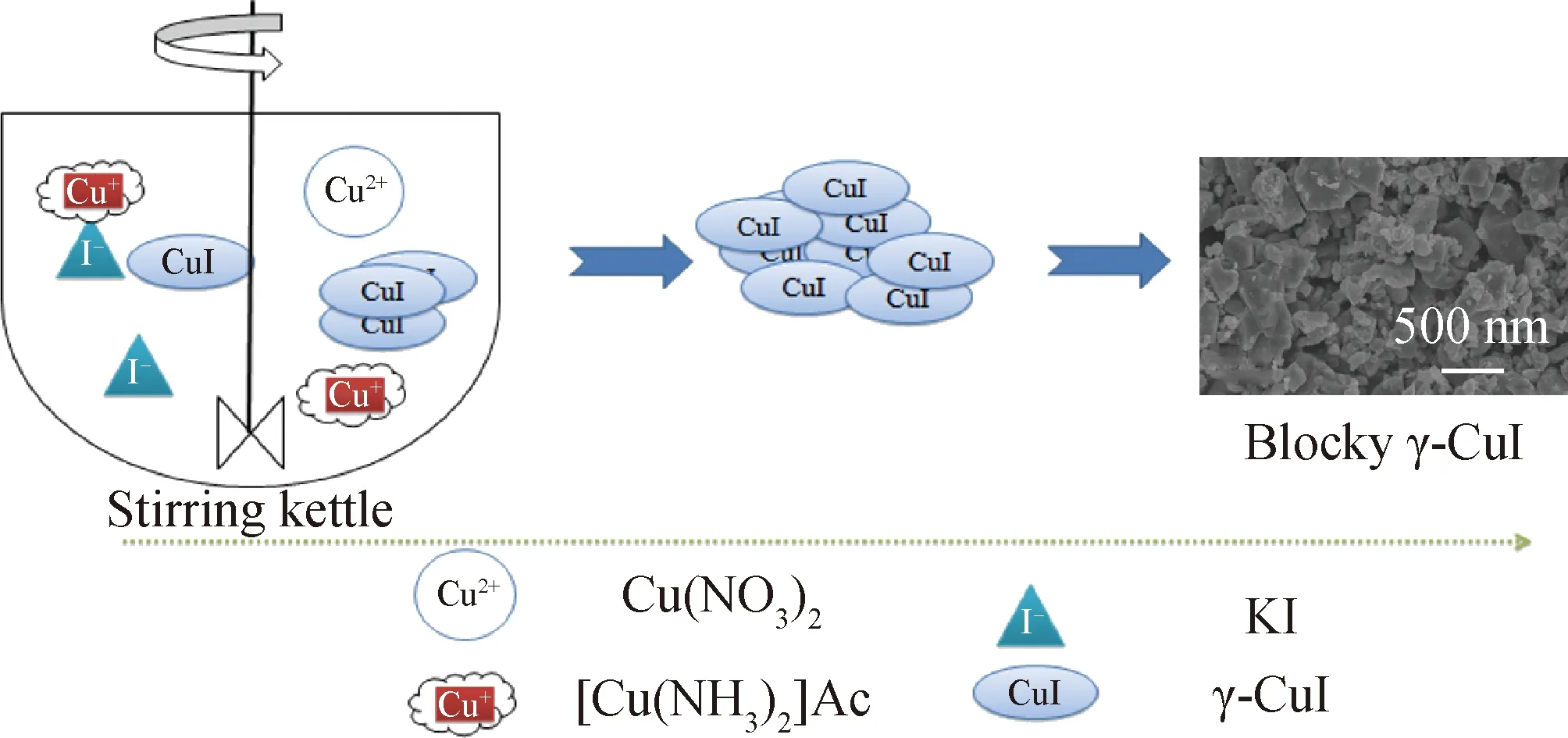
图15 使用釜式反应器制备γ-CuI的过程示意图Fig.15 Schematic diagram of the process for preparing γ-CuI using kettle reactor
3 结 论
本文通过微反应器连续制备了棒状γ-CuI,并考察了不同Cu源、NH3·H2O使用量、管内时间及合成温度等因素对γ-CuI晶相和形貌的影响。此外,本文还比较了传统液相沉淀法与微反应法在同样条件制取γ-CuI的结果。得出以下结论:
1)NH3·H2O的使用量在CuI的合成过程中对结晶度、产率和形貌有显著影响。当NH3·H2O加入量达到0.4时,样品形貌发生改变,主要为棒状结构,并且显著提升了γ-CuI产率,达到90.5%。随着NH3·H2O过量,样品结晶度显著降低,且出现了含氮杂质,形貌也从纳米棒状转变为颗粒状。对不同铜源作为原料合成的γ-CuI进行SEM表征发现,以有机铜源Cu(CH3COO)2·H2O作为原料制备得到的γ-CuI为纳米棒状。
2)原料在微反应器的管内时间对结晶过程有着重要的影响。实验结果表明,当停留时间为0 s时,CuI大部分为颗粒状形貌,而当管内时间延长至10和20 s时,合成样品形貌则会逐渐趋向于棒状。而合成温度的提高会影响样品的结晶过程,较高的温度下,样品的结晶度显著下降,并会使样品形态从棒状逐渐变为颗粒状。
3)不同的制备方法对样品的晶体结构和形貌有至关重要的影响。在相同条件下传统液相沉淀法以块状形貌为主,而通过微反应法合成的γ-CuI具有纳米棒状结构,微反应法在棒状γ-CuI的连续制备上具有明显优势。
