细胞焦亡在胎盘早剥患者外周血和胎盘组织中的表达及临床意义*
2023-10-25唐雨帆宋鹏书龙俊青
唐雨帆,宋鹏书,李 英,龙俊青
(广西壮族自治区妇幼保健院新阳院区产二科,南宁 530005)
胎盘早剥是指孕妇妊娠20周后正常位置的胎盘在胎儿娩出前,部分或全部从子宫剥离,发生率约为2%[1-2]。胎盘早剥的主要病理变化是底蜕膜螺旋小动脉痉挛或硬化,引起远端毛细血管变性坏死甚至破裂出血,血液在底蜕膜与胎盘之间形成血肿使该处胎盘从子宫壁剥落,造成这种血管破损的原因尚不明确,目前国内外对其机制的研究热点为免疫炎症反应[3-4]。细胞焦亡是一种促炎的程序性死亡方式,其主要依赖于炎性半胱天冬氨酸蛋白酶的活化,进而介导白细胞介素(IL)-1β活化、IL-18分泌,并诱发炎症反应,最终诱导细胞炎性死亡[5]。细胞焦亡可促进内皮细胞功能障碍,在心血管疾病的发生、发展中发挥重要作用[6-7]。血管内皮损伤是众多心血管疾病发生的始动因素,而血管内皮细胞死亡是导致内皮损伤的重要原因[8]。本研究推测胎盘组织中发生细胞焦亡,进而引起血管破损,最终导致胎盘早剥。通过研究细胞焦亡及其相关因子,探讨胎盘早剥机制,为胎盘早剥症状提供早期的预警标志物。
1 资料与方法
1.1 一般资料
选取2021年7月至2023年3月在本院定期产检,并在产检中通过磁共振成像和彩色多普勒超声最终确诊为胎盘早剥的产妇40例(胎盘早剥组),以及同时间段妊娠期健康孕妇40例(对照组)。为了防止分娩时阴道污染胎盘,选择剖宫产分娩孕妇,所有同意参加本研究的孕妇都签署《科研知情同意书》。本研究已获广西壮族自治区妇幼保健院伦理委员会批准[桂妇保院医伦快审(2022-2)1号]。
1.2 方法
1.2.1外周血采集和炎症因子检测
两组孕妇分娩前抽取3 mL外周血,采血管在4 ℃,3 000 r/min离心10 min。收集上层血清转移到冻存管保存于-80 ℃。等所有标本收集完毕之后,通过ELISA检测细胞焦亡因子如肿瘤坏死因子-α(TNF-α)、IL-1β和IL-18的表达水平。检测仪器为美国赛默飞世尔科技公司Multiskan Sky紫外可见光分光光度计Cary 100,TNF-α(JM-5141H2)、IL-1β(JL13662)和IL-18(JM-1152H1)ELISA试剂盒均购自深圳市优里生物科技有限公司。
1.2.2胎盘病理学形态分析
剪取娩出胎盘母体面组织块,置于4%甲醛溶液。组织经过脱水和石蜡包埋,切片机切成2 μm膜片。高温烘片之后依次浸泡二甲苯和梯度乙醇,流水冲洗,苏木素液染色5 min,流水清洗膜片,1%盐酸乙醇浸泡1 s,流水冲洗返蓝,0.5%伊红液染色5 min,80%乙醇、95%乙醇、无水乙醇Ⅰ、无水乙醇Ⅱ,各浸泡1 s,晾干膜片用中性树胶封片。
1.2.3电子显微镜观察胎盘早剥患者胎盘组织中细胞焦亡情况
胎盘组织娩出后快速剪取1 mm×1 mm大小组织块若干放在3%戊二醛中固定12 h,磷酸盐缓冲液(PBS)清洗3次,每次15 min,之后浸泡在1%锇酸固定2 h,PBS清洗3次,每次15 min。然后乙醇-丙酮逐级脱水,丙酮和包埋剂(体积比2∶1)渗透2 h,丙酮和包埋剂(体积比1∶3)渗透过夜。环氧树脂包埋组织块,聚合过程需要的温度和时间依次为40 ℃ 15 h,48 ℃ 12 h,60 ℃ 48 h,修整组织块,徕卡UC7超薄切片机切片,醋酸铀-柠檬酸铅双重染色,透射电镜(日本日立公司,型号:H-7650)观察细胞内部形态结构。
1.2.4Western blot检测胎盘早剥孕妇胎盘组织细胞焦亡标志蛋白表达
剪取小块胎盘组织(避免钙化区域),用冷PBS冲洗组织表面的血迹,使用组织研磨机将胎盘组织在冰上制成匀浆,加入1 mL RIPA裂解缓冲液(含1%蛋白酶抑制剂)。二喹啉甲酸(BCA)法测定提取蛋白水平。蛋白质样品在高温变性之后通过十二烷基硫酸钠-聚丙烯酸胺凝胶电泳(SDS-PAGE)分离,100 mA电流持续120 min将凝胶上的蛋白转移到聚偏氟乙烯(PVDF)膜上。5%脱脂奶粉室温封闭孵育30 min,TBST漂洗3次,每次10 min。加入单克隆一抗caspase-1(稀释比1∶1 000,货号:ab207802)、Gasdermin D(GSDMD,稀释比1∶1 000,货号:ab219800)和NOD样受体蛋白3(NLRP3,稀释比1∶1 000,货号:ab263899),置入4 ℃摇晃孵育12 h,再次TBST漂洗3次,每次10 min,加入二抗(稀释比1∶8 000,货号:ab205718)室温孵育1 h,PVDF膜添加显色剂孵育5 min,上机检测。结果用凝胶分析软件处理,Image-Lab软件计算标志蛋白相对表达水平。
1.2.5实时荧光定量逆转录PCR(RT-qPCR)检测胎盘早剥孕妇胎盘组织中焦亡因子mRNA的表达水平
收集胎盘标本,100 μg胎盘组织碎块加入800 μL TRIzol提取RNA,采用美国赛默飞世尔科技公司Nandrop NOE仪器测定RNA水平;按照cDNA逆转录试剂盒将RNA逆转录成cDNA;参照美国赛默飞公司设计的反应程序加入cDNA、上下游引物、反应酶和水进行RT-qPCR。反应程序设置:85 ℃预变性3 min;95 ℃变性20 s;65 ℃退火40 s;75 ℃延伸35 s;40个循环,甘油醛-3-磷酸脱氢酶(GAPDH)基因作为管家基因进行PCR反应。根据PCR扩增曲线,得到两组标本的循环阈值(Ct值),使用 2-ΔΔCt法计算两组胎盘组织中caspase-1、GSDMD和NLRP3 mRNA表达水平。
1.3 统计学处理

2 结 果
2.1 两组妊娠期临床特征比较
两组身高、体重、BMI、年龄均无明显差异(P>0.05)。胎盘早剥组孕周属于孕中期,较对照组明显缩短(P<0.05);且有疤痕子宫史者占比明显高于对照组(P<0.05)。统计两组妊娠期并发症发生情况,胎盘早剥组腹痛、出血、胎膜早破、子痫前期发生率均明显高于对照组(P<0.05),见表1。
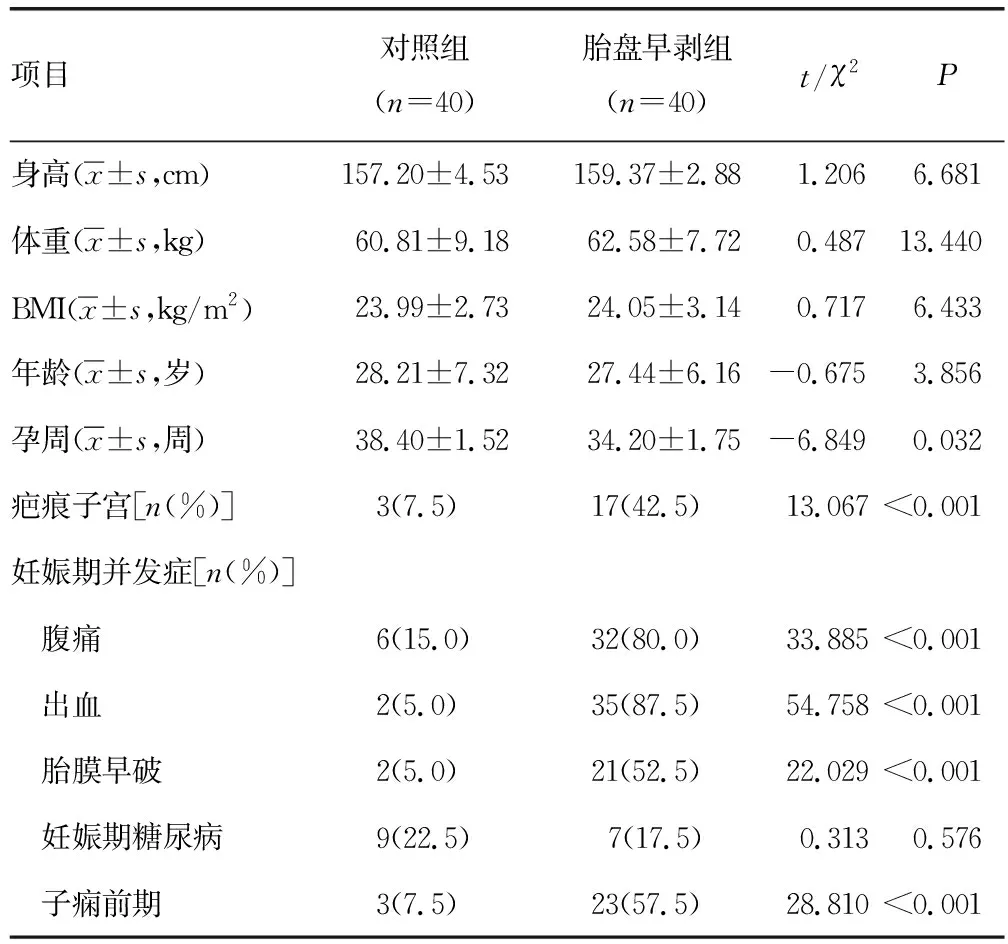
表1 两组妊娠期临床资料比较
2.2 两组外周血炎症因子表达水平比较
胎盘早剥组外周血TNF-α、IL-1β、IL-18水平均高于对照组,差异有统计学意义(P<0.05),见表2。
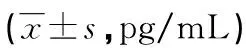
表2 两组外周血炎症因子水平比较
2.3 两组胎盘组织的大体及苏木素-伊红(HE)染色病理学特征
对比妊娠期健康孕妇分娩的胎盘组织,可以发现胎盘早剥孕妇胎盘组织的母体面有黑褐色血液肿块,胎儿面血管出现血栓;病理学染色结果显示,胎盘早剥孕妇的胎盘组织内部血管破裂和血管溶解,见图1。

A:对照组胎盘组织母体面;B:对照组胎盘组织胎儿面;C:对照组胎盘组织HE染色; D:胎盘早剥组胎盘组织母体面;E:胎盘早剥组胎盘组织胎儿面;F:胎盘早剥组胎盘组织HE染色。图1 两组胎盘组织大体及HE染色病理学检测结果
2.4 电子显微镜观察胎盘早剥孕妇胎盘组织细胞焦亡情况
在透射电子显微镜下,可以观察到细胞形态不完整,细胞出现溶解,同时观察到焦亡小体的出现,见图2。
2.5 两组胎盘组织细胞焦亡蛋白表达水平比较
与对照组比较,胎盘早剥组的胎盘组织中caspase-1和NLRP3表达水平升高,GSDMD表达水平降低,差异均有统计学意义(P<0.001),见图3、4。

图3 两组胎盘组织细胞焦亡蛋白灰度图

a:P<0.001。图4 两组胎盘组织细胞焦亡蛋白相对表达水平差异柱状图
2.6 两组胎盘组织焦亡基因表达水平比较
与对照组比较,胎盘早剥组的胎盘组织中caspase-1、NLRP3 mRNA表达水平升高,GSDMD mRNA表达水平降低,差异均有统计学意义(P<0.05),见表3。

表3 两组胎盘组织细胞焦亡基因相对表达水平比较
3 讨 论
胎盘早剥是指在分娩第2阶段完成之前胎盘从子宫内膜分离,连接子宫内膜和胎盘母体侧的血管网络被撕裂[9-10]。目前,胎盘早剥的确切原因尚不清楚,一种普遍的假说认为,胎盘早剥继发于血管畸形和脆弱的血管系统,形成胎盘血管血肿,最终导致胎盘分离[11]。子宫是一种含有肌肉的弹性组织,而胎盘的弹性不如子宫。当子宫组织突然拉伸时,胎盘保持稳定,连接子宫壁和胎盘的血管结构被撕裂[12-13]。本研究收集胎盘早剥孕妇的胎盘组织发现,胎盘娩出后,胎盘表面出现几处血凝块。
最新版《妇产科学》教材上对于胎盘早剥的病因学没有明确定义,不过有文献阐述胎盘滋养层细胞通过释放炎症因子,诱导免疫细胞聚集,炎症反应被过度激活,血管内皮细胞损伤,产生血管破裂出血,进而导致胎盘与子宫壁发生剥离[11,14]。本研究检测胎盘早剥孕妇外周血清炎症因子TNF-α、IL-1β和IL-18表达水平均高于妊娠期健康孕妇,同时胎盘早剥孕妇的胎盘组织病理学结果显示胎盘组织内部出现血栓和血管破裂现象,说明炎症因子可能与血管内皮细胞相互干预导致蜕膜血管收缩,以及血栓形成伴蜕膜坏死和静脉出血。血管内皮细胞是覆盖在血管腔内的单层细胞,为血液和血管壁间的重要物理屏障,其通过产生大量强效血管活性物质调节血管张力[15-16]。
临床证实,炎症或感染与胎盘早剥风险增加有关,在许多胎盘早剥病例中都发现了无菌炎性改变的特征[17]。ABINAHED等[18]发现,NOD样受体蛋白7(NLRP7)由滋养细胞表达,受缺氧调节,NLRP7的失调被认为可能与胎盘早剥有关。炎症变化可能在妊娠前几周甚至妊娠前就已经发生,潜伏数周或数月。细胞焦亡是由某些炎性小体引发的细胞死亡的炎症形式,导致GSDMD的分裂和非活性细胞因子如IL-18和IL-1β的激活[19]。细胞焦亡是血管内皮细胞死亡的一种形式,参与包括动脉粥样硬化、心力衰竭及心肌梗死等血管损伤性疾病[20-21]。胎盘早剥属于螺旋动脉重构不完全和由此引起的胎盘功能障碍导致的妊娠期并发症[22]。QIU等[23]发现,高血糖诱导的NLRP3炎症小体激活可能是一个活性氧(ROS)依赖的细胞焦亡过程,NLRP3炎症小体诱导的焦亡加重了糖尿病大鼠心肌缺血/再灌注损伤。然而,目前尚不清楚胎盘早剥孕妇静脉内皮细胞损伤是否与细胞焦亡有关。本研究收集胎盘早剥孕妇的胎盘组织,经过电镜观察到胎盘组织内部细胞含有少量的焦亡小体。同时检测细胞焦亡的标志性分子caspase-1、NLRP3、GSDMD及其mRNA表达水平,结果显示:与妊娠期健康孕妇的胎盘组织相比,胎盘早剥孕妇的胎盘组织中caspase-1、NLRP3及其mRNA表达水平升高,GSDMD及其mRNA表达水平降低。结合外周血清炎症因子检测结果和胎盘组织病理学染色结果,表明胎盘早剥孕妇的胎盘组织中发生细胞焦亡程序反应。发生在胎盘早剥的免疫学改变尚不明确,蜕膜组织中NK细胞和T淋巴细胞都有促进子宫胎盘螺旋动脉重构的作用,目前学界认为免疫细胞(NK细胞和T淋巴细胞)平衡破坏可能导致胎盘早剥[24]。根据现有资料,观察到胎盘早剥发生的同时,子宫内膜免疫细胞的浸润增加,介导血管成熟、稳定过程,启动血管重塑[25]。根据本研究结果,作者推测血清TNF-α、IL-1β和IL-18等炎症因子水平升高抑制血管重塑,造成子宫螺旋动脉滋养细胞无法重铸,同时胎盘滋养层细胞的分化和增殖被抑制,侵袭能力降低,促使胎盘血管发育不良,引发血管内皮细胞焦亡,导致胎盘早剥发生。
综上所述,胎盘早剥孕妇外周血炎症因子表达水平升高,胎盘组织中存在细胞焦亡小体,细胞焦亡标志性分子的表达水平也高于健康孕妇。妊娠期胎盘疾病与血管和免疫系统的异常有关,这种异常使得胎盘内部血管损伤和坏死等问题发生,并最终导致胎盘早剥。
