蜡样芽孢杆菌BWL-001代谢产物及抗弧菌活性研究*
2023-10-24何佳利甘雨满高程海张文飞王锐萍
何佳利,甘雨满,白 猛,高程海,张文飞,王锐萍
(1.海南师范大学生命科学学院,海南海口 571158;2.海南师范大学,热带岛屿生态学教育部重点实验室,海南海口 571158;3.广西中医药大学海洋药物研究院,广西南宁 530200;4.广西中医药大学,广西海洋药物重点实验室,广西南宁 530200)
弧菌(Vibrio)是一类革兰氏阴性细菌,是海洋环境中最常见的细菌类群。迄今为止,全球范围内已有100多种弧菌,广泛分布于海湾、近海岸海域河口和海底沉积物中[1,2]。部分弧菌是常见的水产养殖致病菌,如副溶血弧菌(Vibrioparahemolyticus)、溶藻弧菌(V.alginolyticus)、哈维氏弧菌(V.harveyi)、鳗弧菌(V.anguillarum)和欧文氏弧菌(V.owensii)等[3-6]。其中,鳗弧菌是最早发现的鱼类细菌病原,可感染海水鱼、虾等多种水产动物,对海洋水产养殖业造成重大经济损失[7,8]。目前,抗生素是治疗水产动物疾病的主要手段,如果大量使用抗生素使耐药性菌株不断涌现,水产病害就愈加难以控制。因此,亟需寻找绿色环保的生物杀菌剂来防治水产养殖中的弧菌疾病。
蜡样芽孢杆菌(Bacilluscereus)是一种普遍存在的革兰氏阳性细菌[9],属于芽孢杆菌属(Bacillus),与苏云金芽孢杆菌(B.thuringiensis)、炭疽芽孢杆菌(B.anthracis)等物种具有许多共同的表型和基因型特性,具有对环境无污染、生物靶向性强、效果显著和持久的生物防治优点,有开发成绿色环保的生物杀菌剂的潜力[10-12]。此外,研究表明蜡样芽孢杆菌能产生高活性的激素、细菌素、多肽抗生素、杀虫外毒素以及挥发性抗菌物质等[13,14]。蜡样芽孢杆菌的代谢产物结构类型及生物活性多样,关于其代谢产物的研究备受关注。本课题组前期研究发现,热带雨林土壤来源的芽孢杆菌代谢产物具有多种生物活性[15]。经过前期活性筛选发现,蜡样芽孢杆菌BWL-001的代谢提取物对副溶血弧菌有微弱活性。为深入研究蜡样芽孢杆菌BWL-001代谢产物中抗海洋弧菌活性的化学成分,运用多种色谱分离方法,从菌株提取物中分离具有抗海洋弧菌活性的先导化合物,为研发防治水产养殖中弧菌疾病的绿色环保的生物杀菌剂提供研究基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源
土壤样品于2016年7月采自中国海南岛霸王岭热带雨林(19°4′11″N,109°10′37″E),从中分离出蜡样芽孢杆菌BWL-001,菌种一直存放于海南师范大学热带岛屿生态学教育部重点实验室。
1.1.2 主要仪器与试剂
ZYJ-S型超净工作台(苏州净化设备有限公司),高效液相色谱仪(日本岛津公司),中压制备色谱仪(瑞士布奇公司),EYELAN-1100V-W型旋转蒸发仪(日本东京理化器械株式会社),YOKO-ZK暗箱式紫外分析仪(武汉药科新技术开发有限公司),Sephadex LH-20凝胶(上海科拉曼试剂有限公司),YMC-Pack ODS-A色谱柱(10 mm×250 mm,5 μm,日本YMC公司),Bruker AV-500 MHz 超导核磁共振仪(瑞士Bruker公司),色谱柱硅胶(青岛海洋化工有限公司),核磁所用的氘代试剂购自艾览(上海)化工科技有限公司。
1.2 方法
1.2.1 菌种发酵培养
在灭菌后的超净工作台内用LB培养基(胰蛋白10 g/L,酵母提取粉5 g/L,氯化钠10 g/L,pH值为7.2-7.4)大规模发酵,共发酵100瓶。每1 000 mL的三角锥形瓶中加入300 mL的培养液,在121 ℃的高温灭菌锅中灭菌20 min,待培养基冷却后接种,室温120 r/min摇床发酵培养3 d,共发酵30 L。
1.2.2 提取与分离
大规模发酵后,加入等体积的乙酸乙酯萃取发酵液(30 L),反复萃取多次至萃取液颜色变浅。萃取液通过减压浓缩得到总浸膏(17.8 g),将总浸膏用200-300目的正相硅胶拌样,进行中压正相硅胶柱色谱分离,采用石油醚-乙酸乙酯(100∶0-0∶100,V/V)和乙酸乙酯-甲醇(100∶0-0∶100,V/V)体系进行梯度洗脱,收集得到6个小组分(Fr.1-Fr.6)。
Fr.5 (1.7 g)经过Sephadex LH-20凝胶柱色谱(纯甲醇)等梯度洗脱分离,再通过高效液相色谱(水-甲醇15∶5,V/V)梯度洗脱制备得到化合物1(4.3 mg)、2(3.7 mg)、3(4.0 mg)和4(3.5 mg)。Fr.6 (3.4 g)首先经过反相硅胶柱色谱(水-甲醇7∶3-2∶8,V/V)梯度洗脱分离,然后经过Sephadex LH-20(纯甲醇)凝胶柱色谱等梯度洗脱分离,最后经过高效液相色谱(水-甲醇9∶11,V/V)等梯度洗脱制备得到化合物5(3.9 mg)。Fr.4 (4.0 g)经过Sephadex LH-20 (氯仿-甲醇1∶1,V/V)凝胶柱色谱等梯度洗脱,然后通过高效液相色谱(水-甲醇1∶4,V/V)等梯度分离制备得到化合物6(3.1 mg)、7(4.2 mg)和8(4.5 mg)。Fr.3 (2.6 g)经过正相硅胶柱色谱梯度洗脱分离,以乙酸乙酯-甲醇(5∶1-1∶1,V/V)体系梯度洗脱,再经高效液相色谱(水-甲醇7∶13,V/V)制备得到化合物9(3.2 mg)和10(5.3 mg)。
1.2.3 抗菌活性测定
采用96孔板微量稀释法测定所有化合物对欧文氏弧菌(ATCC 25919)、哈维氏弧菌(ATCC 14126)、副溶血弧菌(ATCC 17802)和溶藻弧菌(ATCC 17749)的抗菌活性,测定化合物的最小抑菌浓度(Minimal Inhibit Concentration,MIC)值。上述4种菌为海洋致病弧菌,目前所有弧菌菌株均保存于广西中医药大学海洋药物研究院。抗菌活性测定以氯霉素(Chloramphenicol)为阳性对照,二甲基亚砜(DMSO)为阴性对照,具体实验方法参考文献[16]。
2 结果与分析
2.1 化合物结构鉴定
从霸王岭热带雨林土壤来源的蜡状芽孢杆菌B.cereusBWL-001中分离鉴定出10个化合物,结构如图1所示。
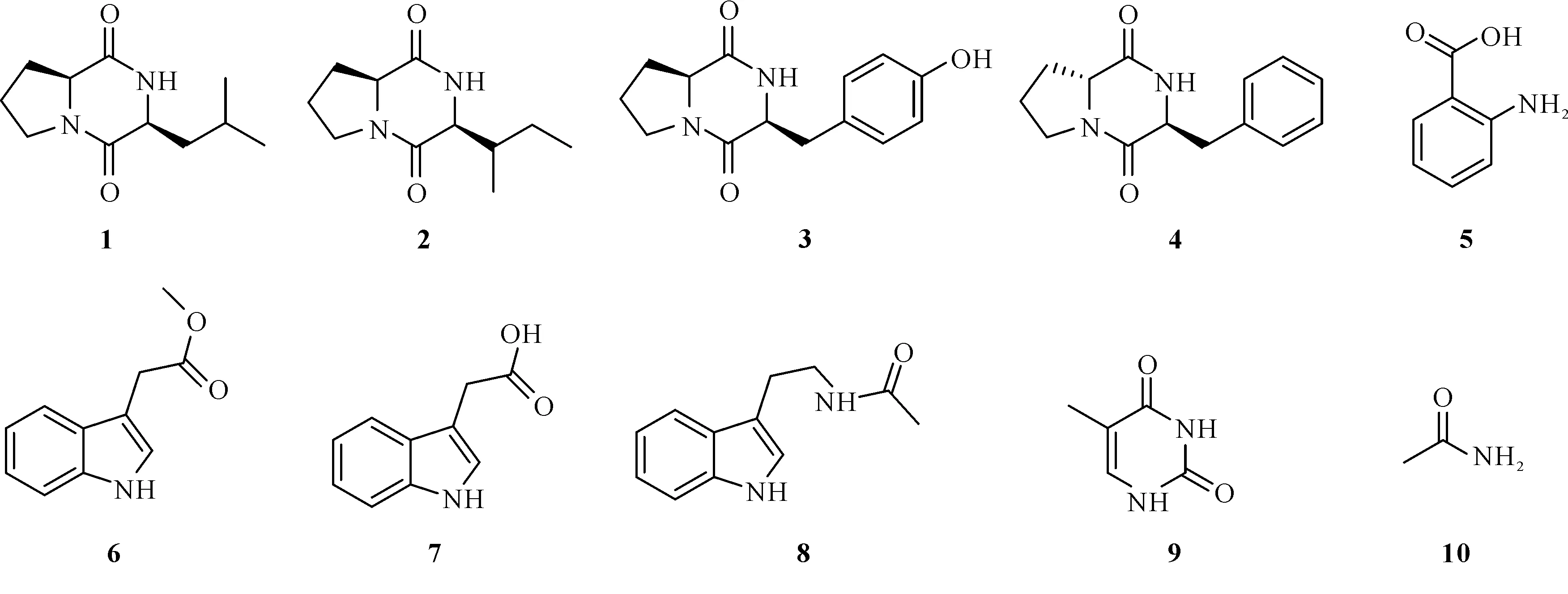
图1 化合物1-10的结构
2.2 化合物波谱数据
化合物1。浅黄色油状,ESI-MSm/z:211.1 [M+H]+;1H-NMR (600 MHz,CDCl3)δH:4.11 (1H,m,H-6),4.00 (1H,m,H-3),3.56 (2H,m,H-9),2.33 (1H,m,H-7a),1.74-2.11 (5H,m,H-7b,H-8,H-10),1.52 (1H,m,H-11),0.95 (3H,d,J=4.4 Hz,H-12 or H-13),0.85 (3H,d,J=4.4 Hz,H-12 or H-13);13C-NMR (125 MHz,CDCl3)δC:170.4 (C-2),166.4 (C-5),59.2 (C-6),53.6 (C-3),45.7 (C-9),38.9 (C-10),28.4 (C-7),24.9 (C-11),23.5 (C-8),22.9 (C-12 or C-13),21.4 (C-12 or C-13)。上述核磁波谱数据与文献[17]报道一致,因此鉴定该化合物为3-异丁基吡咯并哌嗪-2,5-二酮。
化合物2。浅黄色油状,ESI-MSm/z:211.1 [M+H]+;1H-NMR (600 MHz,DMSO-d6)δH:8.00 (1H,s,NH),4.19 (1H,m,H-6),3.99 (1H,m,H-3),3.37 (2H,m,H-9),2.11 (1H,m,H-7a),1.76-1.91 (5H,m,H-7b,H-8,H-10),1.35 (1H,m,H-11),0.86 (3H,t,J=4.4 Hz,H-12),0.85 (3H,d,J=4.4 Hz,H-13);13C-NMR (125 MHz,DMSO-d6)δC:170.3 (C-2),166.5 (C-5),58.5 (C-6),52.6 (C-3),44.8 (C-9),37.8 (C-10),27.5 (C-7),24.1 (C-11),22.8 (C-8),22.5 (C-13),21.9 (C-12)。上述核磁波谱数据与文献[18]报道一致,故鉴定该化合物为cyclo-(Pro-lle)。
化合物3。浅黄色油状,ESI-MSm/z:261.1 [M+H]+;1H-NMR (600 MHz,DMSO-d6)δH:7.06 (2H,d,J=8.0 Hz,H-2′,6′),6.66 (2H,d,J=8.0 Hz,H-3′,5′),4.25 (1H,m,H-9),4.02 (1H,t,J=7.4 Hz,H-6),3.62 (1H,m,H-5a),3.40 (1H,m,H-5b),324 (1H,m,H-10a),2.94 (1H,dd,J=14.4,9.2 Hz,H-10b),1.99 (1H,m,H-3a),1.69 (2H,m,H-4),1.38 (1H,m,H-3b);13C-NMR (125 MHz,DMSO-d6)δC:169.9 (C-1),164.7 (C-7),155.9 (C-4′),130.7 (C-2′,6′),126.9 (C-1′),115.1 (C-3′,5′),58.3 (C-6),55.9 (C-9),44.5 (C-3),34.7 (C-10),27.8 (C-5),21.7 (C-4)。上述核磁波谱数据与文献[19]报道一致,因此鉴定该化合物为maculosin。
化合物4。浅黄色油状,ESI-MSm/z:245.1 [M+H]+;1H-NMR (600 MHz,DMSO-d6)δH:7.30 (2H,br t,J=7.2 Hz,H-2′,6′),7.22 (1H,br t,J=7.2 Hz,H-4′),7.19 (2H,d,J=7.2 Hz,H-3′,5′),4.22 (1H,dt,J=6.7,4.3 Hz,H-9),3.62 (1H,ddd,J=12.0,9.4,8.4 Hz,H-3a),3.39 (1H,ddd,J=12.0,8.4,3.0 Hz,H-3b),3.15 (2H,m,H-10),3.06 (1H,dd,J=10.4,6.6 Hz,H-6),2.18 (1H,m,H-5a),1.94 (1H,m,H-4a),1.79 (1H,m,H-5b),1.69 (1H,m,H-4b);13C-NMR (125 MHz,DMSO-d6)δC:169.4 (C-1),164.9 (C-7),135.4 (C-1′),130.1 (C-2′,6′),128.9 (C-3′,5′),127.7 (C-4′),59.2 (C-6),57.9 (C-9),45.3 (C-3),40.6 (C-10),29.1 (C-5),21.8 (C-4)。上述核磁波谱数据与文献[20]报道一致,故鉴定该化合物为trans-cyclo-(Pro-Phe)。
化合物5。黄色油状物,ESI-MSm/z:138.0 [M+H]+;1H-NMR (600 MHz,DMSO-d6)δH:7.75 (1H,dd,J=4.0,8.0 Hz,H-7),7.21 (1H,t,J=8.0 Hz,H-5),6.76 (1H,d,J=4.0 Hz,H-4),6.50 (1H,t,J=8.0 Hz,H-6);13C-NMR (125 MHz,DMSO-d6)δC:169.9 (C-1),151.7 (C-3),133.9 (C-5),131.5 (C-7),116.6 (C-6),114.9 (C-4),109.7 (C-2)。上述核磁波谱数据与文献[21]报道一致,因此鉴定该化合物为anthranilic acid。
化合物6。淡黄色固体,ESI-MSm/z:212.1 [M+Na]+;1H-NMR (600 MHz,DMSO-d6)δH:7.48 (1H,d,J=5.2 Hz,H-4),7.35 (1H,d,J=4.6 Hz,H-7),7.24 (1H,s,H-2),7.08 (1H,td,J=4.6,0.8 Hz,H-6),6.98 (1H,td,J=5.2,0.8 Hz,H-5),3.74 (2H,s,H-1′),3.60 (3H,s,H-3′);13C-NMR (125 MHz,DMSO-d6)δC:172.0 (C-2′),136.1 (C-7a),127.1 (C-3a),124.1 (C-2),121.0 (C-6),118.5 (C-5),118.4 (C-4),111.4 (C-7),106.9 (C-3),51.5 (C-3′),30.6 (C-1′)。上述核磁波谱数据与文献[22]报道一致,故鉴定该化合物为indole-3-meth-ylethanoate。
化合物7。棕色晶体(甲醇),mp.168-172 ℃;ESI-MSm/z:174.1 [M-H]-;1H-NMR (600 MHz,DMSO-d6)δH:7.51 (1H,d,J=7.8 Hz,H-4),7.35 (1H,d,J=8.4 Hz,H-7),7.23 (1H,d,J=2.4 Hz,H-2),7.08 (1H,td,J=7.8,0.6 Hz,H-6),6.98 (1H,td,J=7.2,1.2 Hz,H-5),3.64 (2H,s,H-1′);13C-NMR (125 MHz,DMSO-d6)δC:173.3 (C-2′),136.1 (C-7a),127.2 (C-3a),123.9 (C-2),121.0 (C-6),118.5 (C-5),118.4 (C-4),111.4 (C-7),107.7 (C-3),31.1 (C-1′)。上述核磁波谱数据与文献[23]报道一致,故鉴定该化合物为indole-3-acetic acid。
化合物8。黄色油状,ESI-MSm/z:201.1 [M-H]-;1H-NMR (600 MHz,CDCl3)δH:9.02 (1H,brs,1-NH),7.59 (1H,d,J=8.0 Hz,H-4),7.35 (1H,d,J=8.0 Hz,H-7),7.20 (1H,dd,J=8.0,8.0 Hz,H-6),7.11 (1H,dd,J=8.0,8.0 Hz,H-5),6.93 (1H,d,J=2.2 Hz,H-2),6.08 (1H,brs,12-NH),3.55 (2H,dt,J=6.5 Hz,H-11),2.94 (2H,t,J=6.5 Hz,H-10),1.88 (3H,s,H-14);13C-NMR (125 MHz,CDCl3)δC:170.9 (C-13),136.6 (C-8),127.4 (C-9),122.4 (C-6),121.9 (C-2),119.3 (C-5),118.6 (C-4),112.5 (C-3),111.5 (C-7),40.1 (C-11),25.2 (C-10),23.2 (C-14)。上述核磁波谱数据与文献[24]报道一致,因此鉴定该化合物为nb-acetyltryptamine。
化合物9。白色固体,ESI-MSm/z:125.1 [M-H]-;1H-NMR (600 MHz,DMSO-d6)δH:11.00 (1H,s,2-NH),10.58 (1H,s,4-NH),7.25 (1H,s,H-5),1.72 (3H,s,H-7);13C-NMR (125 MHz,DMSO-d6)δC:165.1 (C-1),151.3 (C-3),137.6 (C-5),107.5 (C-6),11.8 (C-7)。上述核磁波谱数据与文献[25]报道一致,故鉴定该化合物为thymine。
化合物10。白色固体,ESI-MSm/z:82.1 [M+Na]+;1H-NMR (600 MHz,DMSO-d6)δH:6.86 (2H,brs,1-NH),1.77 (3H,s,H-2);13C-NMR (125 MHz,DMSO-d6)δC:173.5 (C-1),22.6 (C-2)。上述核磁波谱数据与文献[26]报道一致,故鉴定该化合物为acetamide。
2.3 抗菌活性测定结果
抗海洋弧菌活性测试结果表明,化合物6-8对副溶血弧菌有弱的抑制活性,其MIC值均为12.5 μg/mL,其他化合物的MIC值均大于25 μg/mL,阳性对照氯霉素的MIC值为0.78 μg/mL。
3 结论
本研究对海南霸王岭热带雨林土壤来源的蜡样芽孢杆菌BWL-001代谢产物进行系统研究,从该菌株LB培养基发酵产物中共分离鉴定出10个化合物,包括4个二酮哌嗪类化合物(1-4)、3个吲哚生物碱衍生物(6-8)以及3个其他类化合物(5、9和10),所有化合物均首次从该菌株中分离得到,化合物6-8对副溶血弧菌有弱的抑制活性。此外,据文献报道,化合物1和4对鳗弧菌有微弱抑制活性[18];化合物2和3未见相关抗弧菌活性数据的报道;化合物6具有生长促进活性,对小麦胚芽生长有促进作用[22];化合物8对革兰氏阳性细菌,如金黄色葡萄球菌(Staphylococcusaureus)、藤黄微球菌(Micrococcusluteus)等有弱的抑制活性[27],推测该化合物结构中乙酰基为主要活性基团。本研究仅从蜡样芽孢杆菌BWL-001代谢产物中分离出10个单体化合物,仍有很多微量成分未被分离鉴定出来,后续可以对该菌株代谢产物中的微量成分进行分离,以期获得更多结构新颖的化合物。本研究丰富了海南霸王岭热带雨林土壤来源的蜡样芽孢杆菌中活性代谢产物的研究,为充分挖掘蜡样芽孢杆菌中抗海洋弧菌的活性物质提供了科学依据。
