亚硫酸盐预处理强化高含固污泥的自热式高温好氧消化处理工艺
2023-10-24秦天,袁哲
秦 天,袁 哲
(1.武汉市城市排水发展有限公司,湖北武汉 430062;2.武汉科技大学城市建设学院,湖北武汉 430070;3.武汉三镇实业控股股份有限公司,湖北武汉 430062)
污泥是废水生物处理过程中不可避免的副产物,随着废水排放量的增加,污泥的产量逐渐增加[1]。污泥中有机物含量丰富,易腐烂发臭,并含有大量致病菌和寄生虫卵,对人体健康和自然环境产生不利影响[2]。截至2020年,我国建成城镇污水处理厂1万多座,污泥产量突破6 000万t[3]。稳定化被认为是污泥生物处理的重要步骤,对环境安全至关重要[4]。目前,我国大多污水处理厂主要采取填埋和焚烧两种污泥处置方式。这两种处置方式会造成环境的二次污染,处理过程缓慢且处理成本高。因此,发展一种稳定、节能和绿色的污泥处置方式迫在眉睫。
自热式高温好氧消化(ATAD)作为一种先进的好氧稳定工艺,已成功应用于污泥处理,特别是在中小城市和地区[5]。快速的有机降解率、短的污泥保留时间(SRT)、高效的病原体灭活和低能耗阐明了ATAD的关键优势。ATAD通常应用于总固体(TS)质量分数为4%~6%的低固体污泥处置,很少用于处理TS质量分数高于6%的污泥。高固体污泥因其固体含量增加,其表观黏度随之增加,其流动变化规律发生变化,限制了混合和氧气转移[6]。但高固体污泥意味着体积和含水量显著降低,有助于提高有机负荷率(OLR),同时减小消化器尺寸和降低能源消耗[7]。基于当前污泥处理现状,快速稳定高固相污泥具有重要的应用价值和意义。然而,与低固体污泥相比,高固体污泥传质效果差、水解效率低,阻碍了ATAD的应用和发展。
为了提高效率,加速污泥稳定,需要采用预处理技术,如机械、超声、碱和热[8],来加速污泥降解。在各种预处理中,亚硫酸盐预处理崭露头角,在提高污泥的溶解和生物降解性方面发挥了重要作用。文献研究[9]表明,对高固体污泥进行亚硫酸盐预处理厌氧消化,改善了有机物降解,缩短了稳定时间。例如亚硫酸盐预处理后,污泥裂解程度提高39%,底物释放增加87%,沼气产量提升25%。然而,与ATAD相比,厌氧消化通常表现出较慢的消化速度和挥发性固体(VS)去除率以及较长的SRT,且厌氧消化过程中挥发性脂肪酸(VFA)和氨的积累不利于有机物降解和污泥稳定[10]。因此,ATAD在实现亚硫酸盐预处理高固体污泥的快速稳定方面更有前景。本研究主要探究亚硫酸盐预处理对ATAD过程中高固体污泥稳定性的影响,揭示亚硫酸盐预处理后高固体污泥ATAD过程中微生物群落的演化,为我国污泥处置工艺发展奠定基础。
1 材料与方法
1.1 材料
本试验所用的污泥取自湖北武汉某污水处理厂二沉池。新鲜污泥通过40目筛去除大颗粒,然后离心并储存在4 ℃冰箱中。通过离心将原污泥的TS质量分数调整为10.1%,以满足高固相污泥(TS质量分数>10%)的要求,作为初始污泥[11]。种子污泥取自好氧池的好氧污泥,而初始污泥是二沉池取得的废活性污泥,初始污泥是污泥消化的主体,种子污泥用以在ATAD反应器提供好氧微生物。污泥的基本性质如表1所示。
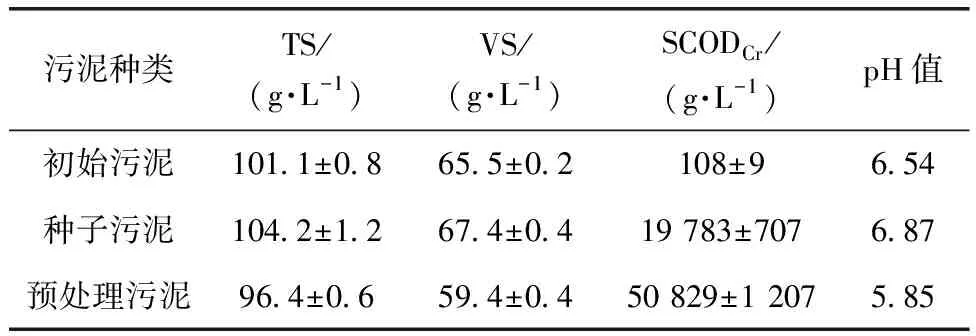
表1 污泥样品性质
1.2 试验方法
1.2.1 亚硫酸盐预处理
采用亚硫酸盐对初始污泥进行预处理,根据含亚硫酸盐工业废水的典型特征,选取亚硫酸盐质量浓度(以S计)为100、300、500 mg/L,对污泥进行预处理试验(表2)。将400 mL初始污泥加入到烧杯中,加入对应亚硫酸盐。使用0.1 mol/L HCl和NaOH溶液调节pH值至6.0±0.1,放置于120 r/min的摇床中处理24 h。试验以未添加亚硫酸盐作为对照。
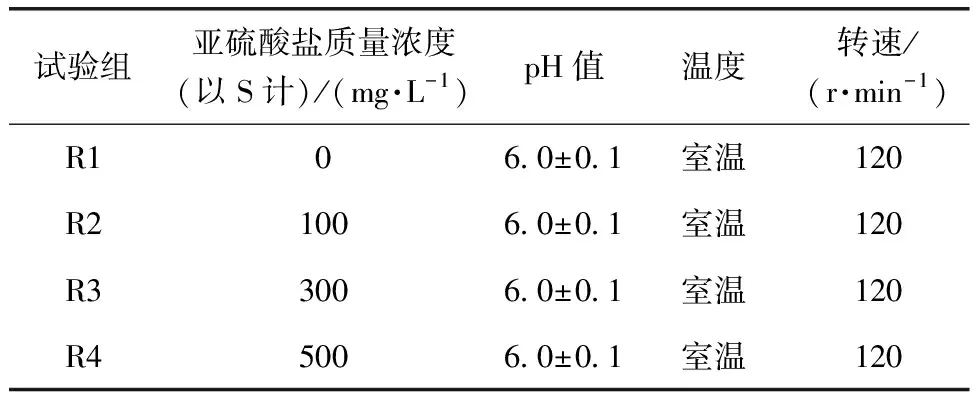
表2 预处理试验控制条件
1.2.2 污泥接种和ATAD反应器
种子污泥是经过长期驯化(4个月以上)后,从实验室稳定运行的反应器中获得的高固体含量污泥。对于每个反应器,将0.1 L种子污泥与1.0 L预处理污泥混合。预处理后污泥pH值由6.54降至5.85。为了减少低pH对接种微生物的不利影响,在接种前加入NaOH (3 mol/L),将污泥的pH值调至6.85。
反应器主要由玻璃槽、加热、曝气和搅拌设备组成,用于模拟ATAD工艺。启动前加入接种后的混合污泥1.0 L。对照组(R1)和预处理组(R2、R3、R4)的操作参数保持一致,温度、搅拌速率和曝气速率控制在55 ℃、60 r/min和1.8 L/min。整个ATAD过程持续21 d,直到污泥稳定。
1.3 测试方法
CODCr、TS、VS等按照《水和废水监测分析方法》中的步骤测定。测定毛细抽吸时间(CST)以评价污泥脱水性能,使用CST测试设备(Model 304 M CST,Triton,UK)测定。蛋白质和多糖分别使用二喹啉甲酸(BCA)法和苯酚-硫酸法测定。大肠杆菌使用大肠杆菌/大肠菌群显色培养基(Hopebio,中国),在37 ℃下孵育24 h,蓝紫色菌落计为大肠杆菌。微生物高通量测序选取反应结束当天的样品,并送样至上海美吉生物公司进行,使用引物 338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTCATAT)对16S rRNA基因V3~V5扩增。
2 试验结果讨论
2.1 高固相污泥在ATAD过程中的稳定性能
还原和稳定被认为是污泥处理的关键目标,而VS去除率可反映消化系统的污泥减量效果,通常污泥消化工艺稳定运行时VS的去除率为40.0%~70.0%。如图1所示,VS去除效率在ATAD过程中呈逐渐增加的趋势。VS在运行初期的去除率较低,尤其是R1,因为接种污泥需要适应新的消化系统。而R2、R3和R4中,VS去除率在3 d后达到了12.8%、17.5%和22.8%,这取决于预处理阶段大量有机物的释放和消化阶段混合的改善。随着消化过程的进行,污泥黏度和TS含量逐渐降低,流动性和气液固传质逐渐改善,有利于污泥的稳定。R1、R2、R3和R4的VS去除率在反应结束前均达到了40.0%以上,R1、R2、R3分别在21、21、13 d达到,尤其是R4,在运行9 d后达到40.9%,标志着实现了污泥稳定。在ATAD处理前应用亚硫酸盐预处理,加快了污泥的稳定化和无害化处理,以应对当前严峻的污泥处理形势。污泥的快速稳定和无害化处理有利于环境保护和人体健康[12]。通过对ATAD过程的深入研究和广泛应用,有助于构建可持续发展的社会。因此,亚硫酸盐预处理是高固体污泥ATAD过程中实现污泥快速稳定的有效而实用的策略。

图1 VS去除率的变化
2.2 ATAD过程中污泥理化性质
2.2.1 SCODCr的变化
有机质降解情况可以直接反映ATAD系统的整体性能和运行稳定性。深入了解预处理和有机质降解之间的相互作用对于稳定运行是必要的。ATAD过程中SCODCr的变化如图2所示。最初由于预处理,R2、R3、R4的SCODCr浓度处于较高的水平,在亚硫酸盐的作用下细胞裂解,大量有机物释放到上清液中,SCODCr浓度显著增加,相对于对照组R1,R4提升约12.5倍。而由于有机质耗竭,尤其是在R4中,SCODCr浓度显著降低,这也反映了VS去除率的快速增加。R1的SCODCr质量浓度在0~6 d从3 028 mg/L显著升高至36 892 mg/L,表明细胞破裂,细胞内有机物释放。然而,与高效的预处理相比,这个过程是缓慢的。考虑到污泥的黏度和混合度,高固体污泥的增溶和水解更加困难。随后,R1的SCODCr浓度逐渐降低,但直到消化结束仍高于其他反应器。对于R1来说,增溶和水解速率成为限制污泥稳定和消化性能的重要因素。此外,相同条件下R1的有机降解缓慢也与较差的混合和传质有关,特别是在运行之初,其污泥胞外聚合物的阻碍导致传质和混合慢。
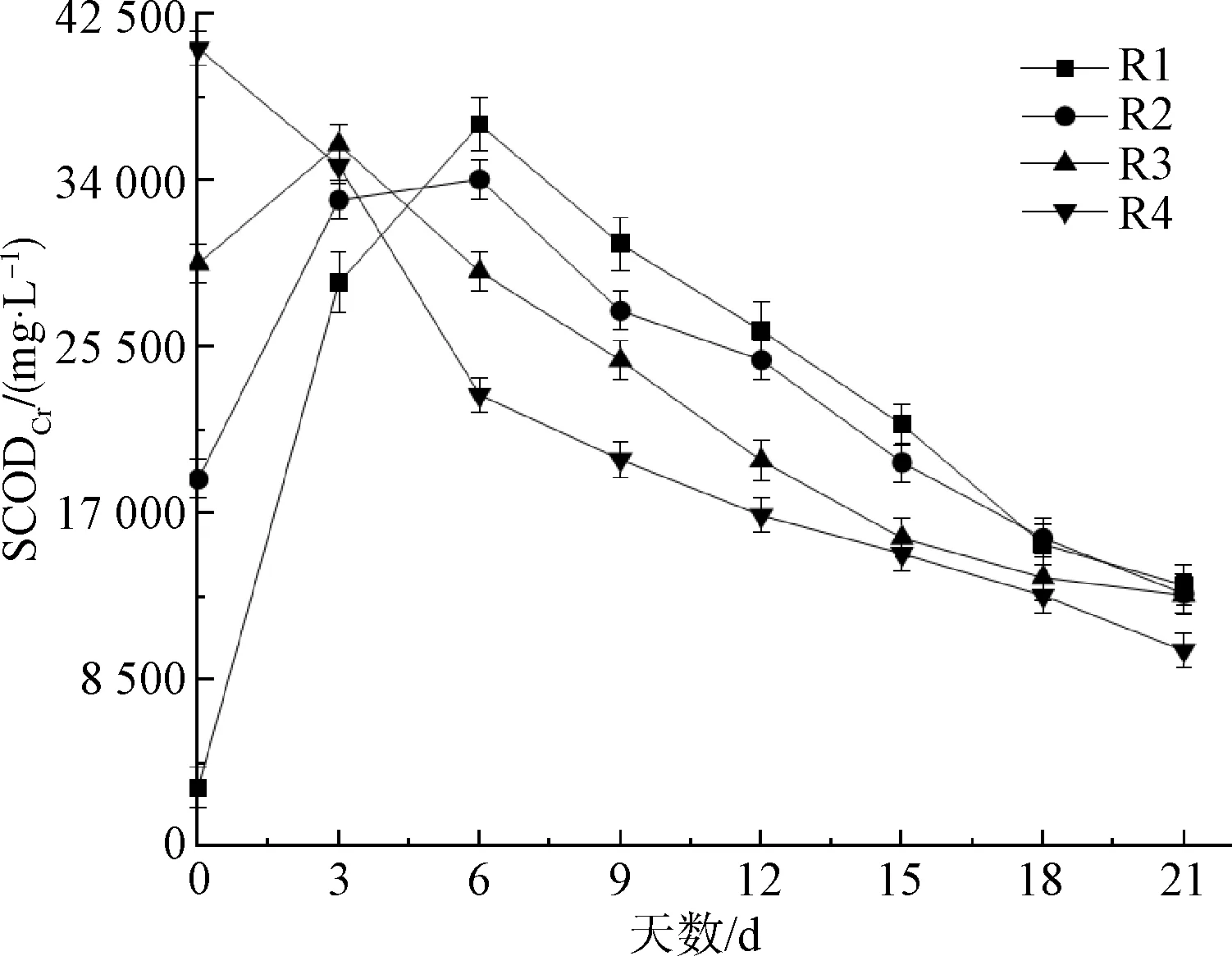
图2 SCODCr浓度变化
R1、R2、R3的SCODCr都经历了先升后降的趋势,与R4的趋势不同。可能是因为R4中亚硫酸盐浓度高,使其中的污泥水解程度高,开始反应后有机物消耗速率大于生产速率,所以SCODCr呈下降趋势。而其他几组中,污泥的水解程度没有R4高,反应开始后,有机物产生速率还是高于消耗速率,所以SCODCr有升高的趋势。
2.2.2 蛋白质和多糖变化
蛋白质和多糖是污泥的两种主要有机组分,对污泥的性质和结构有很大影响。污泥增溶能促进溶解性蛋白和溶解性多糖的释放,通过分析溶解性蛋白质和溶解性多糖的浓度,可以进一步明确亚硫酸盐预处理在污泥增溶中的作用。如表3和表4所示,在R1中,未加入亚硫酸盐预处理,仅依靠生物水解酶进行水解,水解速率缓慢,所以在ATAD过程中仍在进行水解,最终导致蛋白质及多糖的降解率为负值;预处理后加速了水解过程,污泥快速解体,使反应器中溶解性蛋白、溶解性多糖质量浓度分别由65、309 mg/L最高提高到987、2 865 mg/L。显然,亚硫酸盐的应用增强了溶解性蛋白和溶解性多糖的释放,R4中蛋白质和多糖分别增加约14.2和8.3倍,促进了有机物的释放和水解,从而提高了后续ATAD过程中的消化效率。消化结束后,预处理后的反应器,尤其是R4中的溶解性蛋白和溶解性多糖快速减少,蛋白质、多糖降解率最高分别为60.7%、61.7%,这证明了有机物的高效降解。

表3 预处理后污泥中蛋白质变化

表4 预处理后污泥中多糖变化
2.2.3 pH和ORP的变化
通过跟踪pH和ORP的波动来监测ATAD系统的运行性能和稳定性(图3)。pH在反应初期都呈上升的趋势,随着消化过程的继续,R2、R3和R4在连续曝气剥离条件下,pH逐渐降低。而R1整体呈上升趋势,在18 d后pH值达到8.5,随后,R1的pH略有下降,直至消化结束。与R2相比,R1的pH上升速度较慢,原因可能是增溶和有机质降解速度较慢。事实上,污泥的pH受多种因素的影响,包括VFA、氮化合物、消化温度和有机物水解[6]。
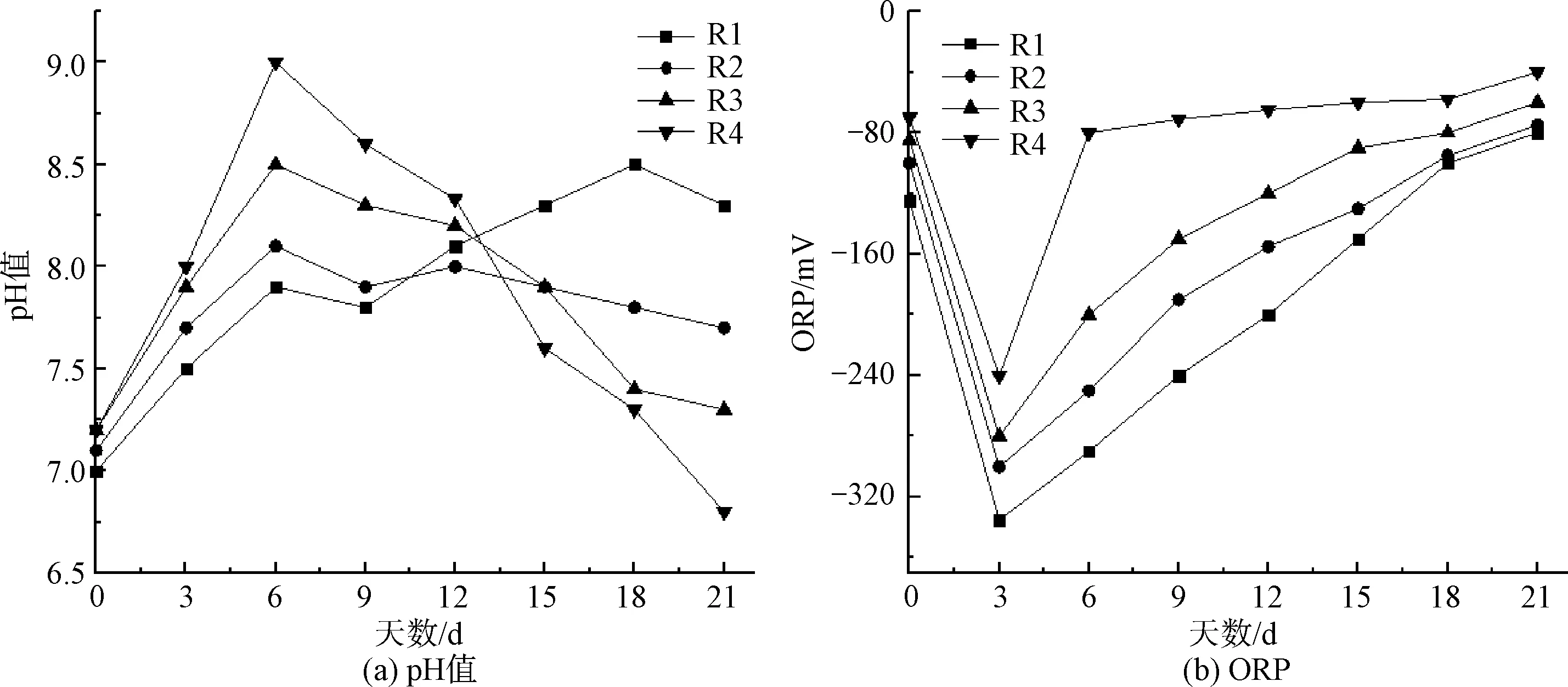
图3 pH值和ORP的变化
R1、R2、R3、R4的ORP在消化3 d后分别下降到-335、-300、-280、-240 mV。ORP明显下降是由于快速生长的嗜热微生物对溶解氧的需求较高[13]。在高温和高固相浓度下氧溶解度的降低也会对ATAD过程中的溶解氧产生负面影响。随后,ORP随着传质和有机质消耗的改善而逐渐增大。在ATAD过程中,ORP的增加意味着溶解氧的增加,这有利于微生物的增殖和有机质的降解。即便如此,在随后的消化阶段仍然观察到显著的差异。R1的ORP在ATAD结束时增加到-80 mV,其他3组分别增加到-75、-60 mV和-40 mV。较高的ORP反映了有机质的快速降解和较高的溶解氧。嗜热好氧菌消化后期需氧量下降,ORP逐渐升高。连续曝气条件下消化结束时ORP小于0,说明微生物耗氧量高于供氧量。
2.3 大肠杆菌的变化
污泥中含有丰富的微生物,若处理不当,对环境和人类都会造成伤害。表5中阐述了ATAD前后大肠杆菌的变化情况。在ATAD前,大肠杆菌数量为(8.84lg±5.89lg)CFU/(g TS),而经过ATAD后,反应器中的大肠杆菌数量分别下降了约33.9%(R1)、43.0%(R2)、48.2%(R3)和63.3%(R4)。与R1相比,R4中大肠杆菌数量显著下降,说明亚硫酸盐预处理能提高ATAD中致病菌的灭活。
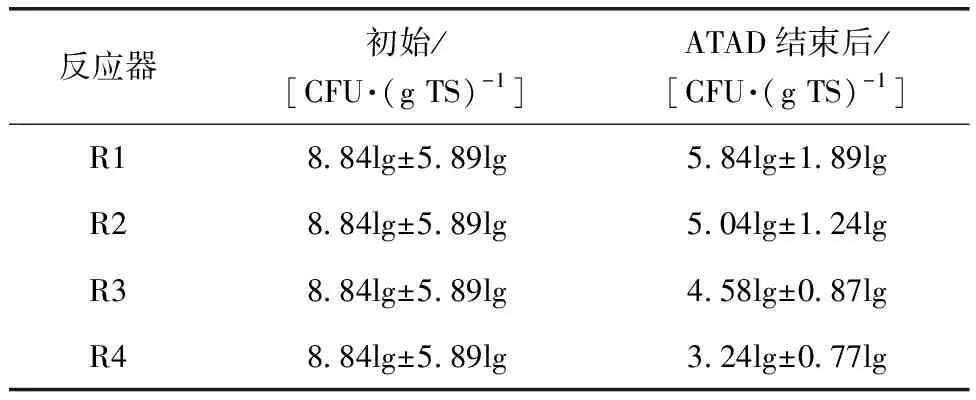
表5 大肠杆菌变化
2.4 微生物群落结构分析
利用Alpha多样性对细菌微生物群落的丰度和多样性进行鉴定,其中Chao1代表了群落丰富度,Shannon和Simpson指数代表了群落多样性。如表6所示,R1、R2、R3和R4样品的可操作分类单元(operational taxonomic units,OTUs)数量分别为133、163、165和187。值得注意的是,与R1相比,其他反应器中污泥的微生物群落多样性均显著降低。微生物的减少表明ATAD对微生物具有强大的筛选作用,而R2、R3和R4由于预处理作用而得到强化。虽然从Shannon指数来看,R4的物种丰富度略高于R1,但存在明显差异。
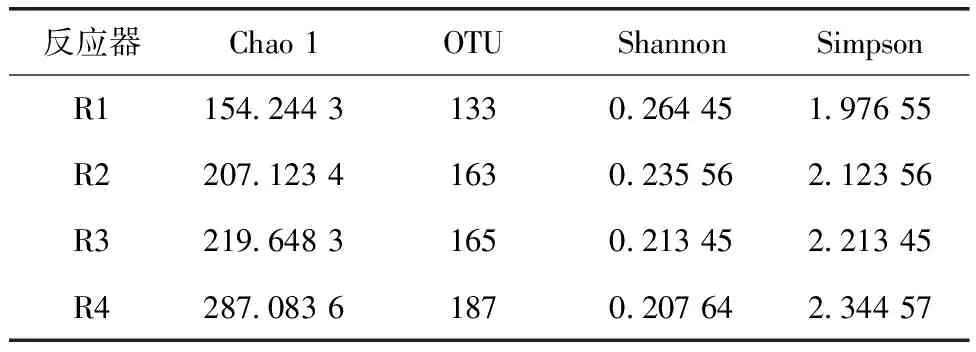
表6 微生物群落的丰度和多样性
批次试验结束之后,污泥中占比最高的前10种功能性微生物群落分布如图4所示,分别是黄单胞菌科(Xanthomonadaceae)、出芽菌科(Gemmata-ceae)、暖绳菌科(Caldilineaceae)、丛毛单胞菌科(Comamonadaceae)和腐败螺旋菌科(Saprospira-ceae)等。
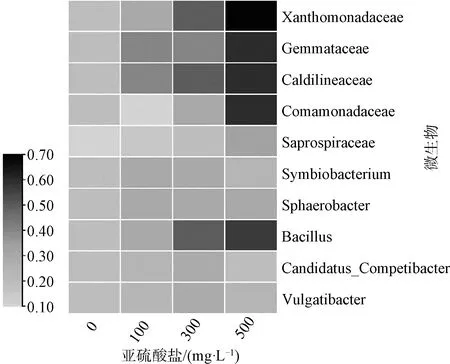
注:对相对丰度进行归一化处理后作图。
黄单胞菌科含量最高。黄单胞菌科是所有消化反应共有的优势科,与污泥的降解程度有关[14]。它们的相对丰度由R1的2.1%增加到R4的6.3%。其次是出芽菌科和暖绳菌科。在有氧条件下,它们具有降解有机化合物的能力[15],其丰度从1.9%(R1)增加到5.6%(R4)。腐败螺旋菌科具有降解复杂有机物的能力[16]。
3 结论
(1)亚硫酸盐预处理可加速高含固污泥的稳定化,添加500 mg/L亚硫酸盐(以S计)在ATAD反应第9 d时VS去除率达到40.9%,比未经任何预处理的污泥ATAD稳定化反应时间大大缩减,有助于后续工艺应用减少停留时间、减小反应器容积。
(2)亚硫酸盐预处理显著提高了污泥的增溶程度,在R4中,相对于对照组,SCODCr提升约12.5倍,蛋白质和多糖分别增加约14.2倍和8.3倍,促进了有机物的释放和水解,从而提高了后续ATAD过程中的消化效率。且由于污泥中的有机物得到了有效降解,易于后续处理与处置。
(3)亚硫酸盐预处理后,ATAD中SCODCr的降解速率显著增加,有助于减少处理时间,降低运行成本。
(4)通过高通量测序分析,发现亚硫酸盐预处理有利于好氧消化相关的功能性微生物的富集,其中黄单胞菌科和出芽菌科为优势菌种,该发现能为后续工艺投入实际工程时提供理论指导。
