基于CT 影像组学和深度学习的硅肺病影像分期预测研究
2023-10-24杨柳琼李颖郑建军
杨柳琼,李颖,郑建军
尘肺病是劳动者在职业活动中长期吸入不同致病性的生产性粉尘,并在肺内潴留而引起的以肺组织弥漫性纤维化为主的一种全身性疾病[1],其中硅肺病是我国发病率最高、危害性最强的病种[2]。硅肺病的影像分期是目前主要的病情评估指标[3],而分期诊断过程耗时费力、可重复性差,且由于胸片固有缺陷及诊断医师主观性的限制导致最后判别结果一致性差、误诊率高[4-5]。影像组学及深度学习方法作为医学影像分析的新手段可以挖掘到肉眼观察不到的深层次信息来进行分类和预测,进而无创、全面地评估疾病[6-7]。本研究探讨和比较基于CT 影像组学及深度学习方法构建的多分类模型对于硅肺病影像分期的预测能力,现报道如下。
1 资料与方法
1.1 一般资料 回顾性收集2016 年1 月至2020 年12 月宁波市第二医院经职业病诊断且具有明确硅尘接触史的245 例患者的基本临床资料、分期结果及CT 影像资料。纳入标准:(1)有明确的硅尘接触史;(2)在X 线检查前/后1 个月内接受CT 检查;(3)有明确的依据GBZ70-2015《职业性尘肺病的诊断》[3]的专家小组鉴定的分期结果。排除标准:(1)除硅肺病外其他类型的尘肺病;(2)CT 图像质量不能满足诊断要求;(3)合并其他病变,如肺感染性疾病、肺结核等。最终共纳入0 期(无矽肺)104 例,Ⅰ期矽肺病77 例,Ⅱ期矽肺病30 例,Ⅲ期矽肺病24 例。本研究经宁波市第二医院医学伦理委员会批准。
1.2 CT 扫描方法 采用Siemens Somatom Definition Flash 及AS 64 排螺旋CT 机行胸部CT 扫描。扫描参数:管电压120 kV,自适应电流,视野342 mm×267 mm,采集矩阵512×512,轴向图像层厚5 mm,层间距5 mm,以2 mm层厚重建成像,用此薄层图像重构MIP图像,投影厚度为10 mm,无间隔成像。
1.3 影像组学分析方法
1.3.1 图像分割与特征提取 将MIP 重建图像重采样至1 mm×1 mm×1 mm 的体素大小,导入3Dslicer 软件(version 4.11.0),先由1 名有丰富经验的放射科医师在对分期结果不知情的情况下进行半自动图像分割,具体分割步骤:基于分水岭方法自动勾勒肺区域的边缘并选中,将叶以上支气管及血管排除在外以减少干扰,然后根据正常肺实质的CT 值阈值(-∞~-750 HU)减去正常肺组织区域,最后得到病灶加肺纹理区域,见图1。逐层进行勾画得到VOI,之后由另1 名医师对其分割结果进行审核以提高准确性。使用Artificial Intelligence Kit(V3.3.0.R,GE Healtheare)软件对VOI 进行特征提取,计算后得到一阶特征、形态学特征及纹理特征共107 个影像组学特征。
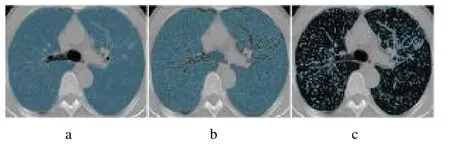
图1 ROI 勾画示意图
1.3.2 特征筛选与影像组学建模 对影像组学特征进行归一化和标准化处理,按照7∶3 的比例随机分为训练组和验证组。依次采用相关性分析及梯度提升迭代决策树(GBDT)算法筛选出最有效的特征组合。基于这些特征采用支持向量机(SVM)进行机器学习,采用5 折交叉验证法训练模型,并计算它们在验证集中的分类准确性。
1.4 深度学习分析方法(1)数据预处理:为了减少人工勾画主观性带来的差异,本研究使用全肺区域CT图像来训练深度学习模型,将三维的掩膜数据以切片的形式保存为分辨率512×512 大小的JPG 格式,从而将三维数据转换成二维图像,通过缩放、随机剪裁等数据增强方法来增加模型对于不同数据分布条件下的适应能力。(2)深度学习模型建立:在Ubuntu 系统下采用pytorch 1.04 深度学习库建模。按照4∶1 的比例随机分为训练组和验证组。选择Hao 等[8]发表的不确定性导向的图注意网络(UGGAT)方法,这种方法不仅绕过对大规模标注数据集的要求,避免三维网络由于高维体输入而导致的过拟合缺陷,而且利用不同切片之间的空间关系。整个方法由特征提取器和CT 图像分类器组成,分为两个阶段分别进行训练,见图2。所有试验均在单卡GTX 2080 Ti 下进行。
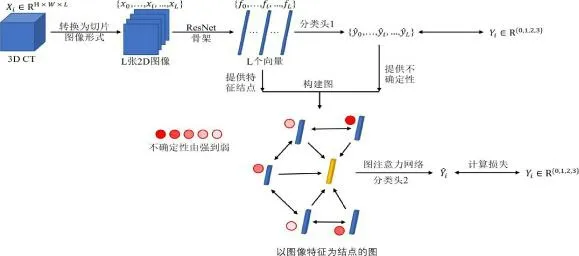
图2 UG-GAT 方法流程图
1.5 统计方法 采用R3.5.1 软件和Python3.5.6 软件进行分析,计数资料采用Fisher's 精确检验,符合正态分布的计量资料以均数±标准差表示,采用单因素方差分析。在训练组和验证组分别绘制受试者工作特征曲线(ROC),计算曲线下面积(AUC),同时使用准确度、敏感度、特异度等指标来检验模型的预测效能。P <0.05 表示差异有统计学意义。
2 结果
2.1 一般资料 本研究共纳入245 例患者,不同期别硅肺病患者性别、年龄和工龄差异均无统计学意义(P >0.05),见表1。

表1 一般资料情况
2.2 影像组学分析 筛选出7 个影像组学特征分别为偏度、伸长率、球度、为依赖熵、集群趋势、联合能量和强度,基于上述7 个特征建立的影像组学模型效能见表2。

表2 影像组学模型在训练组和验证组中鉴别各期硅肺病的诊断效能
2.3 深度学习模型的效能 基于UG-GAT 网络训练的硅肺病分期预测模型对0 ~Ⅲ期硅肺病分类的AUC、准确率、敏感度、特异度均高于影像组学模型,见表3。
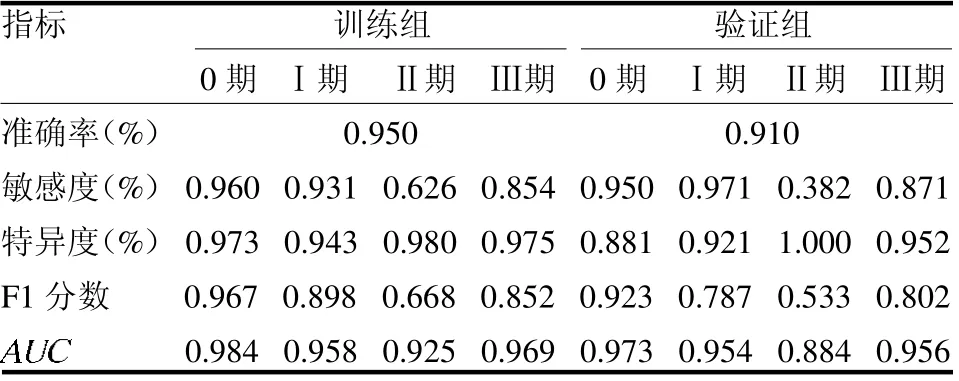
表3 深度学习模型在训练组和验证组中鉴别各期硅肺病的诊断效能
3 讨论
按照目前的诊断标准[3],高千伏胸片仍是硅肺病分期的主要依据,但其由于密度分辨率低、组织重叠等原因不能清楚显示病灶,而CT 图像克服了这些局限[9],在临床实际工作中参考CT 图像已经成为医师对硅肺病进行影像分期诊断时不可或缺的重要环节[10]。我国有学者尝试参照诊断标准探讨CT 图像的小阴影密集度判定方法并进行诊断分期[11],结果显示CT 和高千伏胸片对硅肺病分期诊断结果无明显差异,但两者对小阴影总体密集度的判断符合率低(59.05%),同样,该方法存在过程繁琐且严重依赖于诊断医师的主观视觉及诊断经验等问题。
人工智能在医学影像领域的蓬勃发展为临床提供了一种新的分析思路,目前也已经有一些研究基于X 线胸片训练深度学习模型用于硅肺病筛查与分期[12-14],这表明了计算机系统辅助诊断硅肺病有助于提高诊断效率和准确性,具有重要的应用价值。但既往的研究重点都集中于分析胸片和筛查硅肺病方面,为了克服现有方法的不足,笔者对人工智能技术应用于基于CT 图像的硅肺病影像分期诊断进行探索性研究,使用影像组学和深度学习方法分析学习硅肺病CT 图像特征。本文结果显示两种模型在训练集和验证集均表现良好,能够较准确地鉴别0 期及各期硅肺病,可以为诊断提供一些基于图像衍生的用于硅肺病分期的放射学标志物。
本研究利用同一批数据,分别建立了基于CT图像的传统影像组学模型和深度学习模型,评估其对于不同期别矽肺病的分类预测能力。本研究结果表明CT影像组学分析可以较准确地预测硅肺病分期,且深度学习技术可以进一步提高诊断的准确性,这可能与深度学习避免了人工提取特征这一过程有关,深度学习方法利用图像块进行特征提取,避免了分割病灶这一过程,在一定程度上降低了人为因素导致的误差[15]。另外深度学习技术可以获得更高层次及更丰富的特征,并能保留图像的全局信息,也可能进一步提高预测性能。
本研究的局限性:(1)为单中心研究,缺乏外部验证;(2)由人工手动分割图像,存在一定的主观影响;(3)缺乏更多的临床信息。
利益冲突所有作者声明无利益冲突
