妊娠期糖尿病子代脐血外泌体piRNA 表达谱分析
2023-10-24徐磊张涛潘海滔孙想妹倪蕴勤单嘉伟金欣
徐磊,张涛,潘海滔,孙想妹,倪蕴勤,单嘉伟,金欣
妊娠期糖尿病(GDM)是一种常见妊娠并发症,在妊娠期间发现糖耐量异常,并在分娩后恢复[1]。GDM 对孕妇有长期影响,有研究发现具有GDM 史的妇女患2 型糖尿病的风险是正常妊娠妇女的10倍[2]。GDM 孕妇子代也受到长期的影响,有研究表明GDM孕妇子代出现糖代谢紊乱的风险显著上升[3]。健康和疾病的发育起源(DOHaD)学说认为,在生命发育早期,胎儿暴露于不良的宫内环境可能增加胎儿在成年后患糖代谢紊乱和心血管疾病等慢性疾病的风险[4]。外泌体是一种细胞外囊泡(EVs),含有许多来源于细胞的成分,包括蛋白质、脂质、DNA、mRNA 和piRNA 等,通过细胞分泌与摄入参与细胞间物质和信息传递,调节细胞功能[5-6]。外泌体存在于多种体液中,如血液、尿液、羊水、唾液、肺表面活性物质和母乳[6]。在妊娠期间,外泌体可以在母体和胎儿之间运输,来自母体的外泌体可以对胎儿组织产生作用[7]。PIWI 蛋白相互作用RNA(piRNA)是一类非编码小RNA,其长度在25 ~31 nt,具有调节基因表达的作用[8]。piRNA 由piRNA 簇经RNA 聚合酶II 转录为长链非编码转录本,转录本从细胞核转运到细胞质后,定位到靠近细胞核的RNP 颗粒并被加工为成熟piRNA[9]。目前研究认为piRNA 的失调与多种人类疾病有关,包括糖尿病、不孕不育症、心血管异常、癌症和神经退行性疾病等[10-11]。胎盘中的piRNA可能调控绒毛侵袭,并与胎盘特异基因的表达有关。此外,其还与miRNA 样基因表达沉默有关[12]。本研究拟构建正常妊娠和GDM 孕妇子代脐血外泌体piRNA 表达谱,探索piRNA 在GDM 孕妇子代糖代谢紊乱中的作用和临床意义,现报道如下。
1 资料与方法
1.1 一般资料 GDM孕妇及正常妊娠孕妇的新生儿脐带血标本各5 例,取自2020 年1 月至2021 年1 月绍兴市妇幼保健院妇产科手术标本。GDM 诊断标准:在妊娠24 ~28 周进行糖耐量试验(OGTT),OGTT前禁食8 ~12 h,其空腹血糖≥5.1 mmol/L、OGTT 1 h 血糖≥10.0 mmol/L 或OGTT 2 h 血糖≥8.5 mmol/L 即诊断为GDM。排除标准:(1)双胎妊娠、早产和资料不完整;(2)孕前糖尿病合并妊娠(PGDM);(3)慢性高血压,甲状腺功能异常,肝、肾功能疾病,系统性红斑狼疮,多囊卵巢综合征(PCOS)等;(4)长期使用影响糖代谢的药物(如类固醇激素)。本研究经绍兴市妇幼保健院医学伦理委员会审批同意,研究对象均已签署知情同意书。
1.2 外泌体piRNA 测序和序列分析 对从脐血血浆中分离的外泌体小RNA 使用Illumina TruSeq R NA Sample Preparation Kit 试剂盒构建测序文库,使用Illumina HiSeq X Ten 平台进行测序,获得150 bp的双端数据(测序深度为30X)。使用CASAVA 工具(v1.8 Illumina,San Diego,CA,USA)获取“Fastq.File”。在数据分析的过程中,在没有比对到miRBase,且没有比对到GtRNAdb的序列中挑选长度范围在24 ~33 bp 的序列,比对到piRNA 簇(来源于piRNA群集数据库)中,得到潜在的piRNA。从NCBI中获取已知的piRNA 数据,包括ID 号以及序列信息,对分析得到的潜在的piRNA 进行注释,得到已知piRNA 簇来源的piRNA。随后进行数据归一化处理并筛选高置信度的piRNA,最终得到GDM 组和对照组差异表达的piRNA,并对差异表达的piRNA 进行整体层次聚类分析。利用RNAhybrid 和miRanda 工具预测潜在的piRNA 靶标。使用DAVID 6.8 工具(https://david.ncifcrf.gov) 进行KEGG 通路和GO 分析。
2 结果
2.1 GDM组和对照组脐血外泌体中piRNA的差异表达分析 基于序列相似性,共鉴定到114 个已知piRNA。原始测序数据可在NCBI 的SRA 数据库中获得:PRJNA820443。以∣log2FC∣>1 且P <0.05为筛选条件,在GDM 组和对照组之间存在显著差异表达的piRNA 有7 个,见图1;其中pir-30625 和pir-36249 表达显著上调,pir-32512、pir-33437、pir-34789、pir-35549 和pir-61648 表达显著下调。两组样本差异表达piRNA 整体层次聚类图见图2。

图1 GDM 组和对照组间差异表达的piRNA 火山图
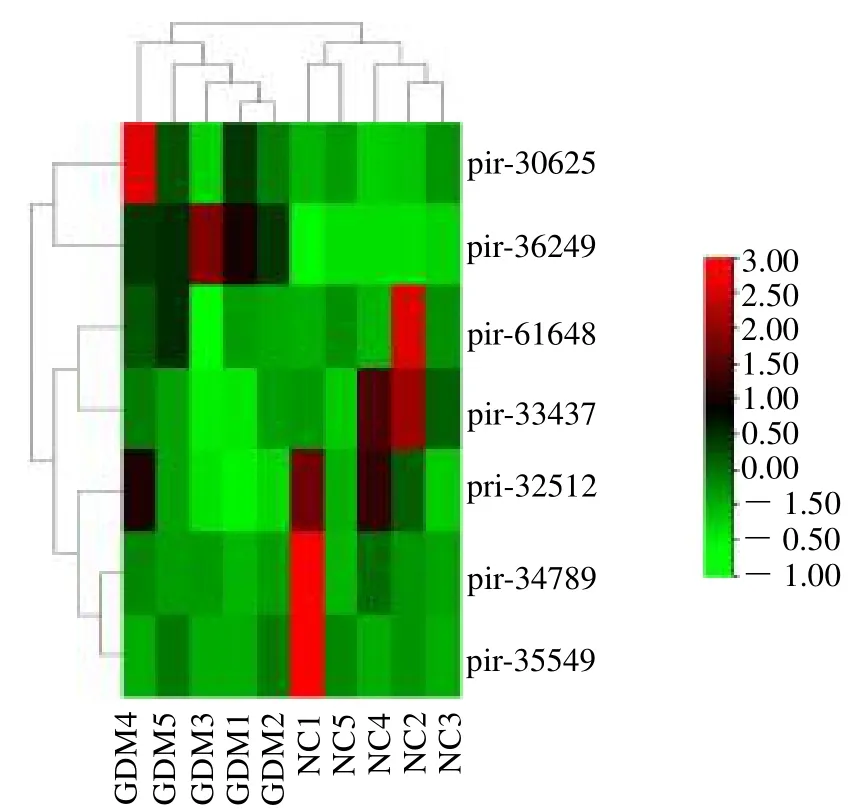
图2 GDM 组和对照组脐血外泌体差异表达的piRNA 热图
2.2 piRNA 的靶基因预测、GO 分析和KEGG 富集分析 预测的靶基因涉及到多个生物学过程,其中大部分富集在转录调控、神经系统发育和子宫内的胚胎发育,见图3a;在分子功能领域,靶基因多数与特定序列DNA 结合有关,见图3b;另外,靶基因与许多细胞成分有关,见图3c ~d。

图3 GDM 组差异表达piRNA 的靶基因进行GO 分析
后续的通路富集分析提示几个主要涉及的信号通路,如胰岛素信号通路、Hippo信号通路、mTOR信号通路、FoxO 信号通路和Wnt 信号通路,见图4。
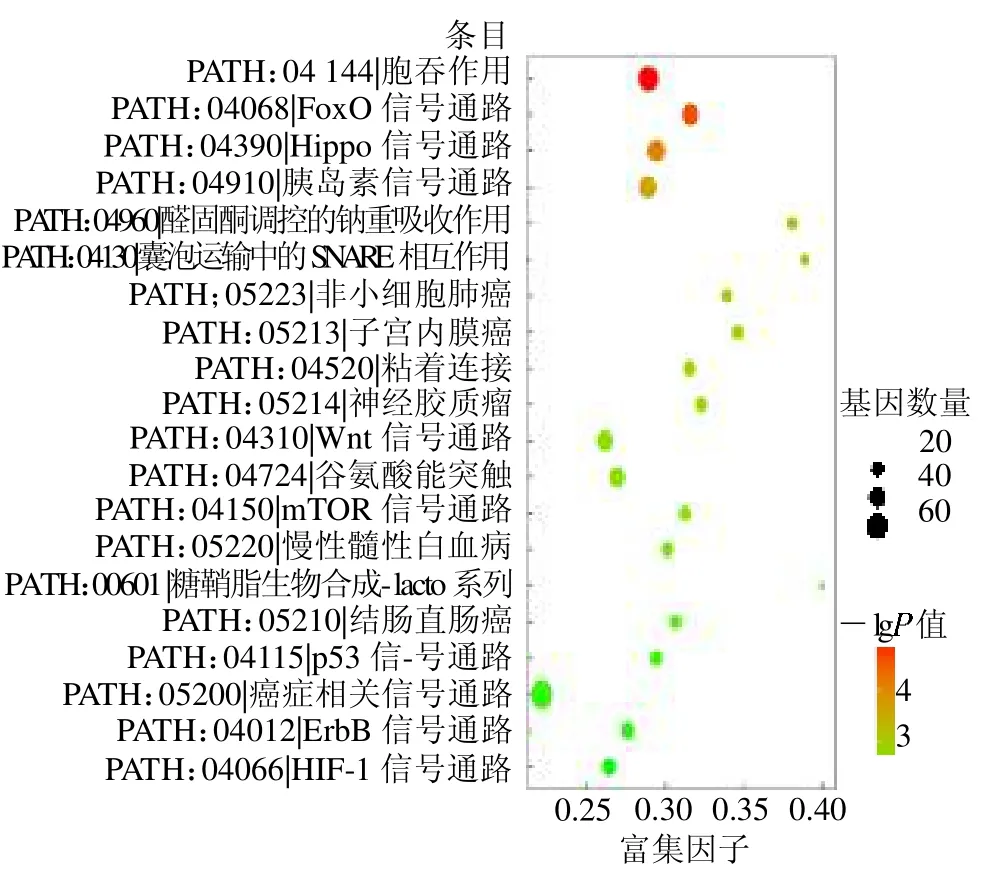
图4 GDM 组差异表达piRNA 的靶基因进行KEGG 分析
3 讨论
GDM 是一种常见的妊娠相关疾病,患GDM 的孕妇及其子代出现糖代谢相关疾病的风险相对较高[13]。有研究表明GDM 孕妇子代在青少年时期和成年时
期患2 型糖尿病的风险显著升高[3]。GDM 孕妇高糖环境引发子代发生代谢紊乱的机制尚未完全阐明。
本研究发现脐血外泌体中存在114 个已知的piRNA。对外泌体piRNA 序列的分析表明,与对照组相比,有7 个piRNA 在GDM 妇女子代脐血外泌体中的表达存在差异,其中pir-30625 和pir-36249 表达显著上调,pir-32512、pir-33437、pir-34789、pir-35549 和pir-61648 表达显著下调。进一步分析发现,这7 个差异表达的piRNA靶向4693 个DEG。通过GO分析和KEGG通路分析发现其在胰岛素信号通路、Hippo 信号通路、TGF- 信号通路、mTOR 信号通路、FoxO 信号通路和Wnt 信号通路富集。这些信号通路的失调,可能对子代胰腺发育、细胞数量和功能产生不利影响,导致子代糖代谢紊乱。
Hippo 信号通路在产前早期发育阶段调控人和小鼠胰腺发育和细胞类型特化[14]。Hippo 信号通路相关蛋白包括TAZ、MST 等。在高糖条件下TAZ 被激活,其通过与PDX1 的协同作用促进胰岛素的生成,从而调节葡萄糖稳态。然而,当TAZ缺乏时PDX1的DNA结合能力和转录活性降低,从而减少胰岛素的生成,破坏了葡萄糖稳态。此外,体外实验表明TAZ缺失损害了间充质干细胞向胰岛素分泌细胞的分化能力;TAZ 敲除小鼠其体质量随着年龄的增长而异常增加,并加剧其受高脂饮食诱导的葡萄糖不耐受和胰岛素抵抗[15]。MST1 是胰腺细胞凋亡的调节因子,在糖尿病患者中MST1 被强激活,与细胞凋亡相关;MST1 在Thr1 处直接磷酸化PDX1,导致其泛素化、降解和胰岛素分泌受损[16]。Smad3 是TGF-信号通路相关蛋白,在糖尿病小鼠模型和Min6 细胞系中,Smad3 的缺失保留了胰岛中细胞发育介质Pax6的表达,从而提高了细胞的增殖能力和功能[17]。mTORC1 是mTOR 信号通路相关蛋白,在空腹血糖受损患者中胰岛mTORC1 活性显著升高,在糖尿病前期小鼠模型中mTORC1 活性较非糖尿病小鼠显著增加[18]。在动物实验中发现细胞特异性mTORC1缺失引起了其增殖、自噬、凋亡和胰岛素分泌缺陷,从而导致糖尿病和细胞衰竭。进一步的研究表明mTORC1 通过2 个通路对细胞产生调控作用,其一,通过mTORC1/S6K 通路调控细胞凋亡和自噬;其二,通过mTORC1/4E-BP2-eIF4E 通路调控细胞增殖的机制[19]。MAPK 的不恰当激活被认为在后天的胰岛素抵抗发生中发挥重要作用[20],Map3k12 是MAPK 信号通路相关蛋白,其与Jnk3 结合并激活Jnk3,刺激控制出生后细胞复制的两个重要细胞周期蛋白Ccnd1 和Ccnd2 的表达,Map3k12 激活Jnk3信号可能是出生后发育和体质量增加过程中调节胰岛细胞质量的关键机制[21]。去分化是导致细胞衰竭和转化为非内分泌细胞的主要原因之一,FoxO是维持细胞分化的必要条件;FoxO1 在胰岛素抵抗和发育中的胎儿胰腺分化过程中影响胰岛细胞[22]。胎儿胰腺细胞的生长和分化,以及成年人胰腺细胞的增殖依赖于-catenin 的功能[23]。这些相关信号通路的变化可能对子代糖代谢产生影响。
综上所述,本研究首次分析了正常妊娠和GDM孕妇子代脐血外泌体中的差异表达piRNA,并通过生物信息学对差异表达的piRNA 及其靶基因的潜在功能进行预测分析。研究表明,piRNA 可能是潜在的子代糖代谢紊乱生物学标志物,并将进一步扩大样本量进行验证。同时,脐血外泌体piRNA 的差异表达可能影响GDM 孕妇子代糖代谢,但差异表达piRNA在GDM孕妇子代糖代谢紊乱中的具体作用和机制仍需深入研究。
利益冲突所有作者声明无利益冲突
作者贡献声明徐磊:论文撰写、数据整理、统计学分析;倪蕴勤:实验操作;单嘉伟:实验操作;潘海滔、孙想妹:研究指导、论文修改;张涛:研究指导、论文修改、经费支持;金欣:研究指导、论文修改
