肿瘤浸润淋巴细胞、CD8、PD-L1 和CTLA-4在乳腺癌新辅助治疗效果中的预测价值
2023-10-24蔡仕彬江姜乐刘鹏鹏周毅郑琎陈述政
蔡仕彬,江姜乐,刘鹏鹏,周毅,郑琎,陈述政
肿瘤微环境(TME)和邻近免疫系统的相互作用决定了乳腺癌的发展转移,其可以起到促进或抑制肿瘤生长、侵袭的作用。既往报道肿瘤浸润淋巴细胞(TILs)水平可以预测三阴性乳腺癌新辅助化疗的反应性[1]。然而TILs 可能仅提供有关免疫激活状态的粗略信息,探索能够进一步改善风险预测的其他潜在生物标志物具有重要意义。CD8+T淋巴细胞是TILs的主要组成部分,程序性细胞死亡配体1(PD-L1)和细胞毒T 淋巴细胞相关抗原4(CTLA-4)是关键性的免疫抑制分子,促进肿瘤细胞免疫逃逸。本研究旨在评估CD8、PD-L1、CTLA-4 联合TILs 在人类表皮生长因子受体2(HER2)阳性或三阴性乳腺癌(TNBC)新辅助治疗疗效反应的预测价值,现报道如下。
1 资料与方法
1.1 一般资料 纳入2015 年1 月至2020 年12 月在丽水市中心医院行新辅助治疗和手术治疗的HER2 阳性或TNBC 乳腺癌患者43 例,均为女性,穿刺病理确诊为浸润性导管癌。排除Ⅳ期乳腺癌、炎性乳腺癌和妊娠相关性乳腺癌。所有患者均接受表柔比星联合环磷酰胺4 周期序贯多西他赛4 周期(EC-T)或多西他赛联合卡铂6 周期(TCb)方案新辅助化疗,HER2 阳性患者接受曲妥珠单抗(H)或曲妥珠单抗联合帕妥珠单抗(H+P)新辅助靶向治疗。根据Miller&Payne(MP)分级评估系统评估乳房原发灶的新辅助治疗疗效,乳房病理完全缓解(bpCR)的定义是乳房肿瘤未见浸润性癌成分,即MP 分级为5 级。NAC 治疗后,所有患者均接受外科手术。收集患者治疗记录,包括临床病理信息、治疗和随访结果。本研究经丽水市中心医院医学伦理委员会批准。所有参与者均签署知情同意书。
1.2 方法
1.2.1 CD8、PD-L1 及CTLA-4 表达检测应用免疫组织化学法(IHC)检测CD8、PD-L1、CTLA-4在肿瘤组织内的表达。常规石蜡包埋组织,4m 切片,经脱蜡、水合、抗原修复、连续封闭后,将切片与一抗单克隆抗体一起4 ℃孵育过夜。抗CD8 单克隆抗体购自安必平(MRQ-39,IHC-RO24),抗PD-L1 单克隆购自Abcam(ab205921,28-8),抗CTLA-4 单克隆抗体购自Santa Cruz Bio(sc-376016,F-8)。第2 天经常规冲洗后与二抗抗体(Dako,K5007)37 ℃孵育30 min,DAB 显色。最后,用苏木精复染,脱水并封片保存。
1.2.2 TILs、CD8、PD-L1 及CTLA-4 表达的结果判读 根据国际肿瘤浸润淋巴细胞(TILs)工作组推荐评估方法[2],以半定量连续变量评分的方式在苏木精-伊红染色玻片上报告TILs 占据基质区域面积的百分比。在200 倍镜下计数肿瘤内CD8+免疫细胞的数量,不包括肿瘤边界的免疫细胞。应用ROC 曲线法计算TILs 和CD8+表达的截断值。肿瘤细胞膜染色或免疫细胞有颗粒状细胞质或膜染色被视为PDL1 阳性。PD-L1(CPS)定义为PD-L1 阳性肿瘤细胞和免疫细胞(淋巴细胞和巨噬细胞)的数量总和相对于所有重要肿瘤细胞数量的比值。CTLA-4 膜染色细胞被视为CTLA-4 阳性。CTLA-4 定义为CTLA-4阳性肿瘤浸润淋巴细胞占全部肿瘤浸润淋巴细胞的百分比;所有病理及免疫组化均由两名资深病理科医师评估。
1.3 统计方法 采用SPSS 26.0 统计软件进行分析,计数资料采用检验或校正检验,P <0.05 表示差异有统计学意义。
2 结果
2.1 43 例乳腺癌患者的临床病理特征 43 例乳腺癌患者年龄25~67岁,中位年龄51.9岁,其中HER2阳性乳腺癌占72.1%,TNBC 占27.9%。经6 ~8 个疗程新辅助治疗,44.2%的患者达到bpCR,见表1。TILs 的截断值为57%,TILs≥57%确定为TILs 高表达,TILs <57%确定为TILs 低表达。CD8 表达的截断值为163,CD8≥163 确定为CD8 高表达,CD8<163 确定为CD8 低表达。PD-L1(CPS)≥1 确定为高表达,PD-L1(CPS)=0 确定为低表达。CTLA-4≥1%确定为高表达,CTLA-4=0 确定为低表达。TILs、CD8、PD-L1、CTLA-4表达高低结果见图1。2.2 不同免疫标志物与乳房bpCR的关系 CD8 高表达组与低表达组、PD-L1 高表达组与低表达组bpCR 差异均有统计学意义(均P <0.05),TILs 和CTLA-4 高表达组与低表达组bpCR 差异均无统计学意义(均P >0.05),见表2。
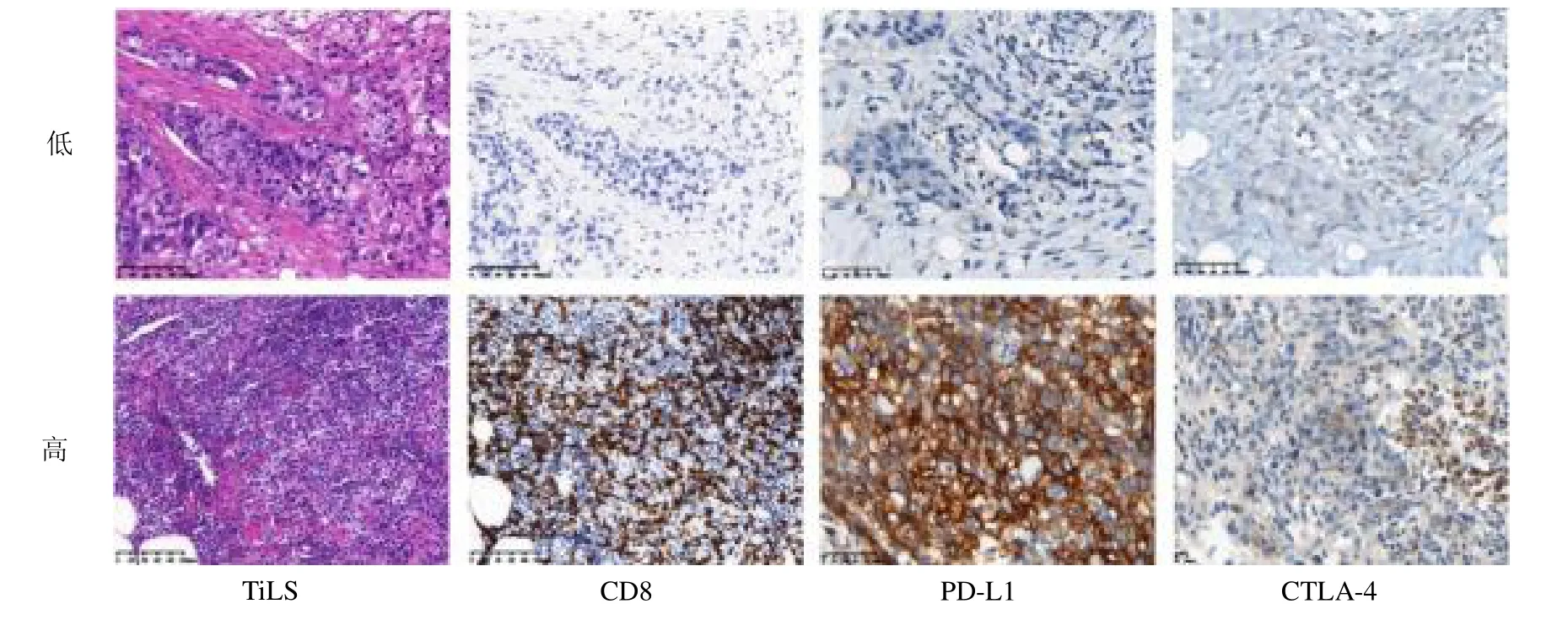
图1 不同免疫标志物的表达情况

表1 43 例接受新辅助治疗的乳腺癌患者临床病理特征
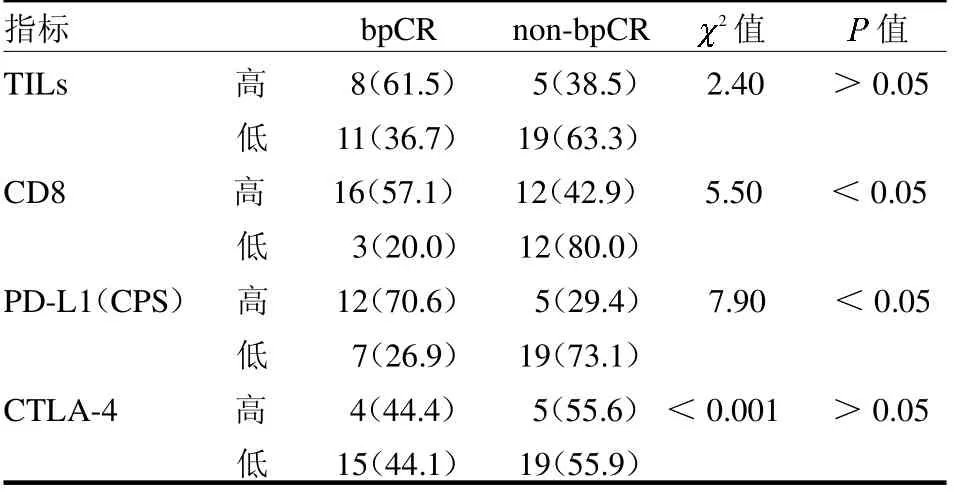
表2 不同免疫标志物在pCR 与non-pCR 中的表达差异 例(%)
CD8 高表达T 细胞在HER2 阳性乳腺癌中占61.3%(19/31),而在TNBC 中占75.0%(9/12)。PDL1高表达在HER2 阳性乳腺癌中占25.6%(8/31),在TNBC 中占75.0%(9/12)。在HER2 阳性乳腺癌中,5例CD8 高表达且PD-L1 高表达的乳腺癌患者经新辅助治疗后MP分级均为5 级,全部获得乳房病理完全缓解。而在TNBC 中,仅50.0%(4/8)CD8 高表达且PD-L1 高表达患者的新辅助治疗疗效评估为MP 分级5 级,见图2。

图2 不同免疫标志物表达强度与乳房病理缓解MP 分级的相关性
3 讨论
肿瘤学家Schreiber 于2002 年提出了肿瘤免疫编辑学说[3]。癌细胞可以重塑免疫细胞的生物学特性,逃脱免疫监视,使得肿瘤细胞逃逸并发生转移。在乳腺肿瘤微环境中,各种免疫细胞(包括淋巴细胞)浸润到肿瘤基质中。高水平的TILs 和CD8+TILs可以预测乳腺癌新辅助化疗反应,尤其在HER2 阳性和TNBC中,与较好的临床预后相关[1,4-6];相反,在激素受体阳性、HER2 阴性乳腺癌中TILs 是不良的生存预后因素[1]。Kaewkangsadan 等[7]应用免疫组化评估33 例局部晚期乳腺癌新辅助化疗前后肿瘤免疫细胞和免疫分子的表达水平,研究发现瘤内和间质TILs、CD4+、CD8+高表达均与bpCR 相关。TNBC 新辅助化疗后残留肿瘤组织中较高的TILs与无复发生存和总生存改善显著相关[8]。本研究中,TILs 高表达组bpCR 率亦高于低表达组,但是由于本研究病例数较少,差异无统计学意义(P >0.05)。CD8 高表达患者新辅助治疗的bpCR率高于CD8 低表达组,这表明CD8+TILs亚群可以作为乳腺癌新辅助治疗疗效的潜在预测指标,尤其是在HER2 阳性乳腺癌中,CD8+TILs 与NAC 后的病理反应级别存在相关性。
乳腺癌中PD-L1 的表达水平与肿瘤大小、肿瘤高分化、淋巴结转移、ER 阴性、PR 阴性、HER2 阳性等不良预后相关的临床病理因素普遍相关,然而其与预后的关系却在不同的研究中有所差异[9-10]。Wimberly 等[11]提出PD-L1 表达和TILs 能共同预测新辅助化疗的治疗反应。Abdelrahman 等[9]研究了50 例接受新辅助化疗的早期(T1、T2)TNBC 患者肿瘤免疫微环境与临床病理反应的相关性,结果显示pCR 与高表达TILs、缺失Foxp3+和PD-L1 相关(均P<0.05)。另有研究发现新辅助化疗后未达到bpCR的TNBC 患者残留肿瘤组织中PD-L1 表达升高[10]。在本研究中,PD-L1 高表达组和低表达组经新辅助化疗后bpCR 率差异有统计学意义(<0.05)。在HER2 阳性乳腺癌中,CD8 高表达且PD-L1 高表达的乳腺癌患者经新辅助治疗后更易获得bpCR,而在TNBC 中CD8 高表达或PD-L1 高表达与新辅助治疗疗效无明显相关性。
综上所述,乳腺癌患者的免疫状态可以预测新辅助治疗疗效,CD8 高表达且PD-L1 高表达的乳腺癌患者经新辅助治疗后更易获得bpCR。因此,对乳腺癌患者免疫微环境进行更深入的研究将有助于改善乳腺癌生存。
利益冲突所有作者声明无利益冲突
作者贡献声明蔡仕彬:实验操作、论文撰写;江姜乐、刘鹏鹏、周毅、郑琎:数据整理、统计学分析;陈述政:研究指导、论文修改、经费支持
