富勒醇促进小鼠皮肤创面愈合的疗效及机制
2023-10-24梁富程何志强张伟楠巩志丹范晓棠鲁元刚
梁富程,何志强,张伟楠,巩志丹,范晓棠,鲁元刚
(1. 陆军军医大学大坪医院整形美容科,重庆 400042;2. 中国人民解放军31411部队,辽宁 沈阳 110020;3. 陆军军医大学医学心理系军事认知心理学教研室,重庆 400038)
临床上烧创伤、肿瘤及溃疡等常导致皮肤创面不能愈合或无愈合倾向,不仅增加了治疗难度,还加重了患者的经济负担,已成为一个棘手的公共问题[1]。研究发现,各种致病因素会引起核因子κB(nuclear factor kappa-B,NF-κB)信号通路的持续激活,并促进白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子的释放,进而导致炎症过程的持续存在[2]。持续的炎症状态和异常的炎症因子分泌会导致伤口愈合停留在炎症阶段,是临床上皮肤创面迁延不愈的重要原因[3]。目前,针对创面延迟愈合的治疗方法仍不能很好地解决炎症问题,导致病情反复,效果不佳。因此,寻找一种新型主动抗炎药物促进皮肤创面的愈合,从而实现创面解剖和功能的重建与修复具有重要意义[4-5]。
富勒醇(fullerenol,FUL)作为一种新型的生物材料,是具有多羟基的C60分子,因其具有性质稳定、价格低廉、较好的生物相容性等优点而被广泛关注。但其生物合成过程中可能会产生大量的有机溶剂及酸碱,限制了其应用。本研究所采用的富勒醇通过催化剂辅助机械化学方法合成,可提高产量且不需要纯化[6]。在抑郁症及放射性皮炎等动物模型中,富勒醇表现出良好的抗氧化活性和化学抗炎等功能[6-7];但其对小鼠皮肤创面愈合的影响目前尚不清楚。基于此,本研究建立小鼠皮肤创面模型,观察经富勒醇治疗的效果并初步探讨其机制,以期为临床皮肤创面修复提供新的治疗策略。
1 材料与方法
1.1 实验动物
6~8周龄雄性健康C57BL/6小鼠24只,购自湖南斯莱克景达实验动物有限公司[生产许可证号:SYXK(渝)2017-0002],体质量18~23 g,每笼4只饲养,自由饮水、饮食,环境温度21~24 ℃,相对湿度50%~60%,维持12 h光照/12 h黑暗的昼夜交替节律。所有实验均在陆军军医大学军事认知心理学教研室动物实验室进行。
1.2 主要试剂
富勒醇根据高能物理研究所和国家纳米科学技术中心(中国北京)的报告合成,并溶于0.9%生理盐水中(10 mg/mL)。RIPA裂解缓冲液购自上海碧云天公司,ELISA试剂盒购自厦门慧佳科技有限公司,反转录试剂盒购自美国赛默飞公司,脱毛膏购自法国薇婷公司,HE染色试剂盒购自上海碧云天公司,Masson染色试剂盒购自上海贝博生物公司。
1.3 实验分组及模型建立
将24只小鼠随机分为假手术组(对照组)、模型组+生理盐水组(NS组)及模型组+富勒醇组(FUL组),每组8只。给予小鼠1%戊巴比妥钠腹腔注射麻醉,背部术区备皮后,于俯卧位固定,术区常规碘伏消毒,乙醇脱碘,脱毛膏脱毛。真手术组建模:通过打孔的方式在小鼠背部作2个直径6 mm的圆形全层皮肤缺损创面,术后单笼喂养[8-9]。建模成功后,立即给予FUL组小鼠腹腔注射10 mg/kg富勒醇[6],其余2组注射等体积生理盐水。各组小鼠每日给药1次,连续7 d。干预结束后,麻醉状态下处死小鼠,取材制作切片并进行相应检测。
1.4 皮肤创面愈合率的计算
治疗后第3、7天,数码相机采集小鼠皮肤创面图片,利用Image J软件分析图像,每只小鼠的创面面积取平均值,创面愈合率=(创面初始面积-第n天创面面积)/创面初始面积×100%。
1.5 HE染色
采用HE染色试剂盒,将创缘石蜡切片放入二甲苯中,梯度乙醇水化后,依次放入苏木素、伊红染液进行染色,然后梯度乙醇脱水、二甲苯透明,中性树胶封片并拍照。分析图像,计算上皮爬行距离及肉芽组织厚度。
1.6 Masson染色
采用Masson染色试剂盒,将创缘切片脱蜡(方法同HE染色),依次加入苏木素、丽春红、苯胺蓝等进行染色,梯度乙醇脱水、二甲苯透明,中性树胶封片后拍照。分析图像,统计胶原容积分数。
1.7 Western blot检测相关蛋白表达
每组分离3只小鼠皮肤创面样本,在4 ℃的RIPA裂解缓冲液中研磨匀浆,4 ℃下以15 000 r/min离心裂解产物10 min,使用二辛可宁酸试剂盒测定蛋白浓度。将样品(每泳道10 μL)在10% SDS-PAGE上以80 V分离120 min,然后以220 mA转移到PVDF膜上120 min。5%脱脂牛奶室温封闭3 h。然后将膜与IL-1β(1∶1 000)、IL-6(1∶1 000)、TNF-α(1∶1 000)、NF-κB(1∶1 000)、β-actin (1∶10 000)一抗孵育,再与辣根过氧化物酶结合的二抗孵育。通过增强化学发光法观察膜上的特异性蛋白条带。使用Image Lab软件计算条带的灰度值。
1.8 RT-qPCR检测相关mRNA表达
每组分离3只小鼠皮肤创面样本,研磨匀浆后置于4 ℃ TRIzol试剂中,加入200 μL氯仿,剧烈振荡15 s,4 ℃下以12 000 r/min离心裂解产物10 min。取水相溶液,添加200 μL 70%乙醇(无RNase水配制)到吸附柱。离心后,使用Nano Drop 2000分光光度计测定RNA浓度,按照说明书逆转录为cDNA,PCR仪进行RT-qPCR,采用比较周期阈值方法定量RNA的相对量。引物见表1。

表1 RT-qPCR引物序列
1.9 ELISA检测血清炎症因子水平及氧化应激水平
干预结束后,每组取6只小鼠血液常温放置2 h后离心,得到血清样本;取创缘组织采用预冷的PBS清洗,去除血迹及多余筋膜,剪碎并称重。组织和PBS(含蛋白酶抑制剂)按照质量体积比1∶9混匀,充分研磨后,以3 000 r/min离心10 min,获取组织匀浆。按照说明书操作,使用比色法分别计算血清中IL-1β、IL-6、TNF-α的含量及创缘组织中丙二醛(malondialdehyde,MDA)含量和超氧化物歧化酶(superoxide dismutase,SOD)活性。
1.1 0 统计学分析
使用SPSS 25.0软件进行统计学分析,数据以均数±标准差()表示,2组间比较采用配对样本t检验,多组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠体质量变化
各组小鼠每天的体质量无明显变化(P>0.05),见图1,说明富勒醇对小鼠的生长发育无明显影响。

图1 小鼠每日体质量变化图
2.2 小鼠创面愈合情况
NS组和FUL组小鼠的创面均随着时间推移不断变小,在同一时间点,FUL组小鼠的愈合率均高于NS组,差异有统计学意义(P<0.05),见图2。
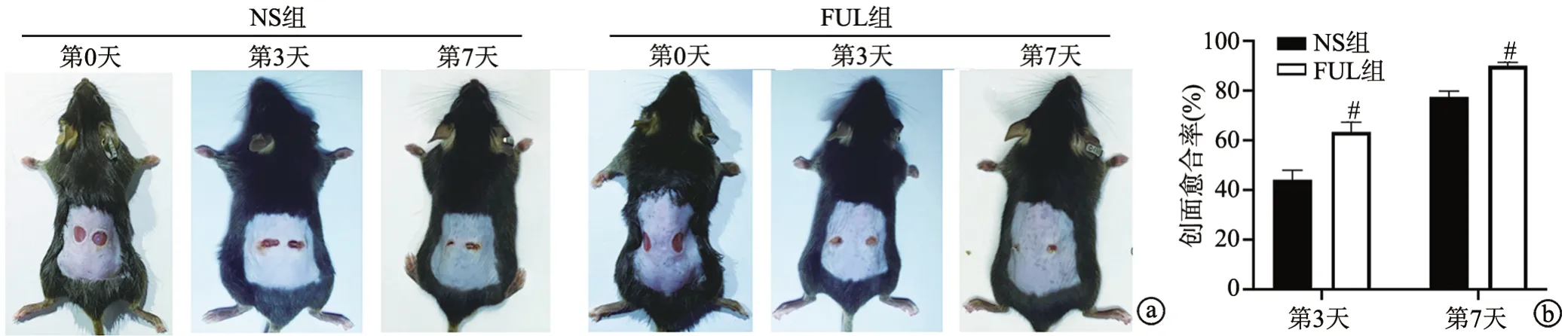
图2 小鼠创面愈合情况
2.3 小鼠创面HE染色及Masson染色
HE染色结果显示,治疗后第7天,与NS组相比,FUL组上皮结构连续、完整,上皮爬行距离远,肉芽组织更厚,差异有统计学意义(P<0.05)。Masson染色结果显示,治疗后第7天,FUL组的胶原纤维更加密集且排列整齐,胶原容积分数高于NS组,差异有统计学意义(P<0.05),见图3。

图3 小鼠创面组织HE染色及Masson染色
2.4 各组小鼠创面组织IL-1β、IL-6、TNF-α、NF-κB的蛋白表达水平比较
治疗后第7天,FUL组小鼠皮肤创面组织的IL-1β、IL-6、TNF-α、NF-κB的蛋白表达水平均低于NS组,差异有统计学意义(P<0.05);但FUL组以上蛋白表达水平与对照组比较,差异无统计学意义(P>0.05),见图4。

图4 小鼠创面组织炎症因子的蛋白表达
2.5 各组小鼠创面组织IL-1β、IL-6、TNF-α的mRNA表达水平比较
RT-qPCR结果显示,治疗后第7天,FUL组的创面组织炎症因子IL-1β、IL-6、TNF-α mRNA表达均低于NS组,差异有统计学意义(P<0.05),但FUL组以上炎症因子mRNA的表达与对照组比较,差异无统计学意义(P>0.05),见图5。

图5 小鼠创面组织炎症因子的mRNA表达
2.6 各组小鼠血清炎症因子及创面组织氧化应激水平比较
ELISA结果显示,治疗后第7天,FUL组的血清炎症因子IL-1β、IL-6、TNF-α水平均低于NS组,差异有统计学意义(P<0.05),FUL组以上血清炎症因子水平与对照组比较,差异无统计学意义(P>0.05)。与NS组相比,FUL组创面组织的MDA含量明显下降,SOD活性明显升高,差异均有统计学意义(P<0.05);但FUL组氧化应激水平与对照组比较,差异无统计学意义(P>0.05),见图6。

图6 小鼠血清炎症因子及创面组织氧化应激水平
3 讨论
创面修复是一个复杂而有序的生物学过程,大致可以分为出血炎症期、细胞增殖期、组织重塑期,三个时期相互独立又彼此紧密联系。皮肤伤口修复的关键因素是伤口炎症、伤口收缩和上皮再形成[10]。皮肤创面难治愈的主要原因在于其不遵循正常有序的愈合过程,可能出现角化细胞迁移障碍、创面上皮化困难、炎症因子持续释放、巨噬细胞比例失调等。既往研究发现,创面难愈合与氧化应激和炎症过程持续存在有关,炎症和氧化应激之间相互作用,互为因果[11]。目前,药物治疗均无法达到理想效果,精准调节炎症过程,并解决伤口过度氧化应激问题是促进皮肤创面愈合的关键。
出血炎症期作为创面愈合的初期,也是伤口的第一道防御机制,对整个愈合过程至关重要[12]。炎症反应中的抗炎和促炎因子是一把双刃剑,适度炎症对组织修复有益,但过度炎症不利于伤口愈合[13]。适度炎症可以激活中性粒细胞,释放炎症因子,同时激活机体释放转化生长因子、血小板衍生生长因子、碱性成纤维细胞生长因子和表皮生长因子等,这些生长因子会吸引更多的免疫细胞参与创面的愈合过程。NF-κB是一种参与先天和适应性免疫反应的转录因子,其适度活化对于机体抵御创伤、感染等具有重要意义,过度活化又可诱导IL-1β、IL-6、TNF-α等炎症因子的过度表达;TNF-α也可以激活NF-κB通路的转录和表达,NF-κB通路的激活又可以诱导多种炎症介质的表达,形成一个自分泌增强的回路,加剧炎症反应。本研究中,FUL组IL-1β、IL-6、TNF-α、NF-κB的表达水平较NS组均有不同程度下降,说明富勒醇具有调节伤口炎症的能力,其可以调控创缘NF-κB的水平,从而减少创面周围组织及血液中IL-1β、IL-6、TNF-α等炎症因子的表达,有助于创面正常愈合。
皮肤创面的局部微环境被破坏,如氧化应激水平升高、血液灌注不良等,会导致创面愈合困难[14-15]。因此,调节创面氧化应激水平也极为重要。MDA是脂质与氧自由基反应形成的产物之一,其与皮肤创面不愈合密切相关[16]。氧自由基可加快巨噬细胞迁移,引起炎症和促纤维化细胞因子的释放,进一步刺激活性氧产生。过量的活性氧可通过激活对氧化还原状态敏感的转录因子NF-κB从而促进促炎因子的表达,进一步上调血管细胞黏附分子-1、细胞间黏附分子-1及单核细胞趋化蛋白-1等与炎症相关的基因产物的表达,加剧炎症反应;此外,自由基所致的氧化应激与炎症通过调控转录水平进而相互影响,形成自由基-氧化应激-炎症-氧化应激-自由基的恶性循环。氧化应激通过氧化加重炎症反应,炎症通过炎症介质促进氧化。本研究结果显示,与NS组相比,FUL组小鼠创面组织中MDA水平显著降低,而SOD水平显著升高,说明经富勒醇治疗后,伤口周围的氧化应激水平下降,表明富勒醇在抑制炎症反应的同时,可降低伤口周围组织中的氧化应激水平,协同降低炎症水平,共同促进皮肤创面的愈合。
再上皮化和伤口收缩是影响伤口愈合的另一重要因素。急性损伤的治疗需要快速有效的上皮化过程以恢复皮肤完整性。皮肤愈合需要新生上皮在伤口床上扩张[17-19]。本研究HE染色结果显示,与NS组相比,FUL组新生上皮更长,肉芽组织更厚,说明富勒醇可促进再上皮化。有效的伤口收缩有利于缩短愈合时间,而胶原纤维的沉积与有序排列对于提高伤口组织重塑也有不可或缺的作用[20-21]。本研究Masson染色结果显示,FUL组较NS组有更多的胶原纤维沉积,胶原结构排列更密集,胶原容积分数更高,说明富勒醇可加快伤口收缩,从而促进伤口愈合。
综上,富勒醇可有效促进小鼠皮肤创面愈合,其机制可能与富勒醇抑制NF-κB信号通路及下游炎症因子表达,从而减轻炎症、氧化应激,促进伤口再上皮化和增强伤口收缩有关。本研究结果可为临床上创面的相关治疗提供参考和实验依据。但本研究为动物实验,其临床有效性和实用性仍有待进一步证实。
