紫檀芪保护HT22细胞抗过氧化氢诱导凋亡的机制研究
2023-10-24范崇熙张云水孙兵兵王晓莹赵东林杨全龙石学汇刘磊
范崇熙,张云水,孙兵兵,王晓莹,赵东林,杨全龙,石学汇,刘磊
(1. 空军特色医学中心消化内科,北京 100142;2. 空军特色医学中心重症医学科,北京 100142)
活性氧(reactive oxygen species,ROS)主要包括超氧阴离子(O2·-)、过氧化氢(H2O2)和羟自由基(·OH),可导致神经细胞线粒体和内质网等结构功能障碍,进而诱导DNA损伤和细胞凋亡[1]。氧化应激是ROS过度产生介导的代谢性级联反应[2]。目前认为,氧化应激是导致神经退行性疾病的重要因素[2-3]。寻找能够抑制氧化损伤的活性物质,有望成为预防和治疗神经退行性疾病的有效方法[4]。
紫檀芪(C16H16O3,pterostilbene,PTE)是白藜芦醇的甲基化衍生物,首次从紫檀等木材中分离并提取[5]。研究发现,紫檀芪具有广泛的药理学作用,包括抗癌、抗炎、抗糖尿病以及抗衰老等[6-7]。本研究采用HT22细胞构建氧化应激损伤模型,探索PTE对H2O2介导细胞凋亡的保护作用,同时关注线粒体及内质网功能变化,旨在为揭示PTE抗神经元退行性病变提供新的理论基础。
1 材料与方法
1.1 主要材料与仪器
HT22细胞系及培养基购自武汉普诺赛生命科技有限公司,PTE购自上海陶术生物科技有限公司,CCK-8试剂盒购自北京翱擎生物科技有限公司,乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自南京建成生物工程研究所,TUNEL试剂盒购自瑞士Roche公司,DAPI染色剂、ROS检测试剂盒和细胞浆蛋白抽提试剂盒购自上海碧云天生物技术有限公司,JC-1线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒购自上海翊圣生物科技有限公司,BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,兔抗鼠Bax、eIF2α、p-eIF2α抗体购自美国Cell Signaling Technology公司,兔抗鼠Bip和鼠抗鼠CHOP、Cytochrome C(Cyto C)抗体购自美国Abcam公司,兔抗鼠AIF、Bcl-2、PERK、Lamin B抗体购自美国Proteintech公司,兔抗鼠p-PERK和鼠抗鼠β-actin抗体购自常州Affinity Biosciences公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IgG和HRP标记山羊抗小鼠IgG抗体购自北京中杉金桥生物技术有限公司。多功能酶标仪购自美国Biotek公司,激光共聚焦显微镜购自日本奥林巴斯公司,ChemiDocTMMP型成像系统购自美国Bio-Rad公司。
1.2 细胞培养
HT22细胞培养于37 ℃、5%CO2饱和无菌湿环境中,常规每2天换液一次。适时应用0.25%胰酶消化传代,传代比例为1∶2~1∶3。将对数生长期的细胞作为后续实验对象。
PTE溶解于DMSO中配成储存液,-20 ℃分装保存,使用时按比例以无血清的培养基稀释。采用不同浓度(2.5~20.0 μmol/L)的PTE处理细胞24 h,并测定细胞活力,以筛选合理的PTE浓度用于后续实验。此外,构建H2O2(200.0 μmol/L)损伤模型[8]。
1.3 CCK-8法测定细胞活力
按照每孔1×104个细胞将HT22细胞接种于96孔板,每组设4个复孔。按照1.2实验结果给予PTE(5.0 μmol/L和10.0 μmol/L)或H2O2(200.0 μmol/L)处理细胞,加入10% CCK-8混合液100 μL,37 ℃避光孵育2 h。应用酶标仪测定450 nm处的光密度(optical density, OD)值。
1.4 比色法检测LDH释放量
按照每孔2×106个细胞将HT22细胞接种于6孔板,给予PTE(5.0 μmol/L和10.0 μmol/L)或H2O2(200.0 μmol/L)处理细胞,根据说明书步骤,测定上清液450 nm波长处的OD值,空白处理组的值设为100%。
1.5 TUNEL染色
按照每孔3×105个细胞将HT22细胞接种于带圆玻片的24孔板,37 ℃培养过夜,并给予PTE(5.0 μmol/L和10.0 μmol/L)或H2O2(200.0 μmol/L)处理细胞,4%多聚甲醛室温固定10 min,用0.3%的Triton X-100溶液室温孵育10 min。按说明书要求,配置TUNEL工作液,37 ℃避光染色1.5 h,随后用DAPI溶液(1 μg/mL)避光标记细胞核约10 min[9]。甘油封片后,激光共聚焦显微镜观察并随机选取5个视野中的细胞,计算凋亡率(绿色荧光百分比)。
1.6 ROS含量测定
制作细胞爬片,加入一定量的DCFH-DA工作液(10 μmol/L),37 ℃避光孵育30 min。应用激光共聚焦显微镜观察并采集信号,其中激发波长为488 nm、发射波长为525 nm,Image J分析采集的图像。
1.7 MMP检测
配置JC-1工作液,37 ℃避光孵育细胞20 min。加入600 μL染色缓冲液,洗涤2次。以400 μL无血清培养基覆盖细胞,激光共聚焦显微镜下观察染色结果,并用Image J分析结果。其中,检测JC-1单体时激发光波长为485 nm,发射光波长为535 nm;检测JC-1聚合体时激发光波长为550 nm,发射光波长为600 nm[10]。
1.8 蛋白提取及免疫印迹检测
按照试剂盒说明书进行蛋白分离,经BCA法定量后,加入1/5体积的上样缓冲液(5×),100 ℃沸水处理7 min,-80 ℃分装保存。选取适合浓度的SDS-PAGE凝胶进行电泳,随后将蛋白转移至PVDF膜上,用含5%脱脂奶粉的TBST缓冲液室温孵育2 h。应用一定浓度的抗体溶液,与对应蛋白条带4 ℃孵育过夜。次日加入相应的HRP标记抗体(1∶5 000)室温孵育2 h;ChemiDocTMMP型Bio-Rad成像系统采集化学发光信号,并用Image Lab 5.1软件分析蛋白的相对表达量。以内参蛋白(β-actin和相应总蛋白)为基准,计算各组样本目的蛋白表达量或磷酸化水平,其中对照组为100%。
1.9 统计学方法
采用SPSS 13.0统计软件进行统计学分析,计量资料以均数±标准差(x-±s)表示,采用单因素方差分析比较差异,组间采用LSD法进一步分析;多组间率的比较采用Fisher精确概率检验,P<0.05表示差异有统计学意义。
2 结果
2.1 PTE对H2O2诱导的HT22细胞损伤的影响
CCK-8结果显示,PTE浓度在低于10.0 μmol/L时无明显细胞毒性作用(P<0.05),见图1a,此浓度将用于后续实验。进一步检测发现,与对照组相比,H2O2显著降低HT22细胞活力,表现为细胞折光性增加、形态变圆、部分脱落,且OD值明显降低;H2O2处理后的细胞活力随PTE浓度增加而增加(P<0.05),见图1b。此外,H2O2处理组LDH释放量明显增加,表明H2O2会损伤细胞,PTE明显抑制LDH释放(P<0.05),见图1c。
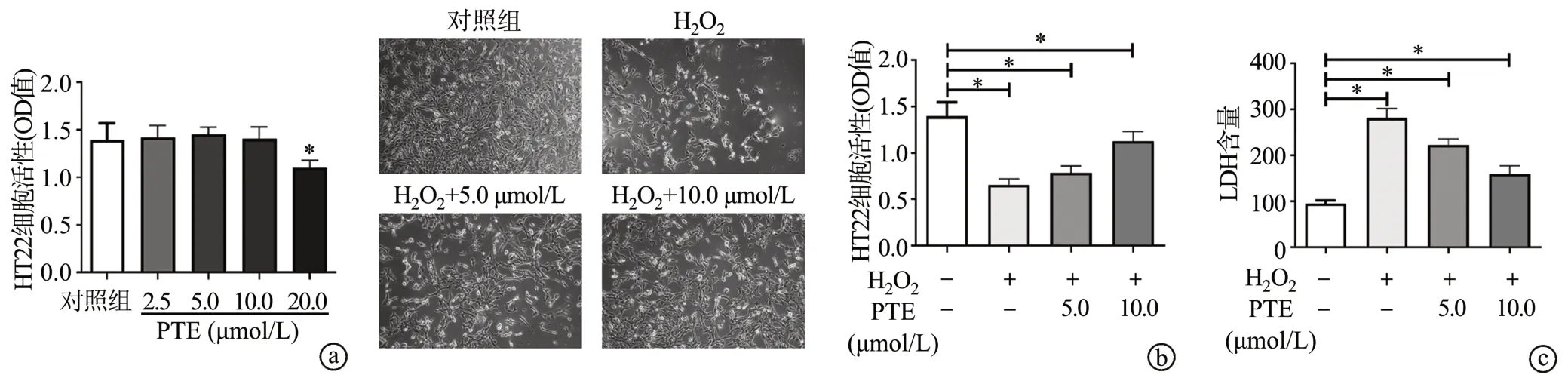
图1 PTE对H2O2诱导的HT22细胞损伤的影响
2.2 PTE对H2O2诱导的HT22细胞凋亡的影响
H2O2处理后,蓝色荧光减弱且绿色荧光表达增强;不同浓度的PTE可使绿色荧光表达减弱(P<0.05),见图2a。进一步蛋白分析表明,随着PTE浓度的增加,抗凋亡蛋白Bcl-2的表达增加,而促凋亡蛋白Bax明显下调;核质蛋白分离检测发现,H2O2处理后凋亡诱导因子(apoptosis inducing factor,AIF)由细胞质向细胞核转移的趋势明显增加,PTE可减缓上述蛋白移位过程(P<0.05),见图2b。
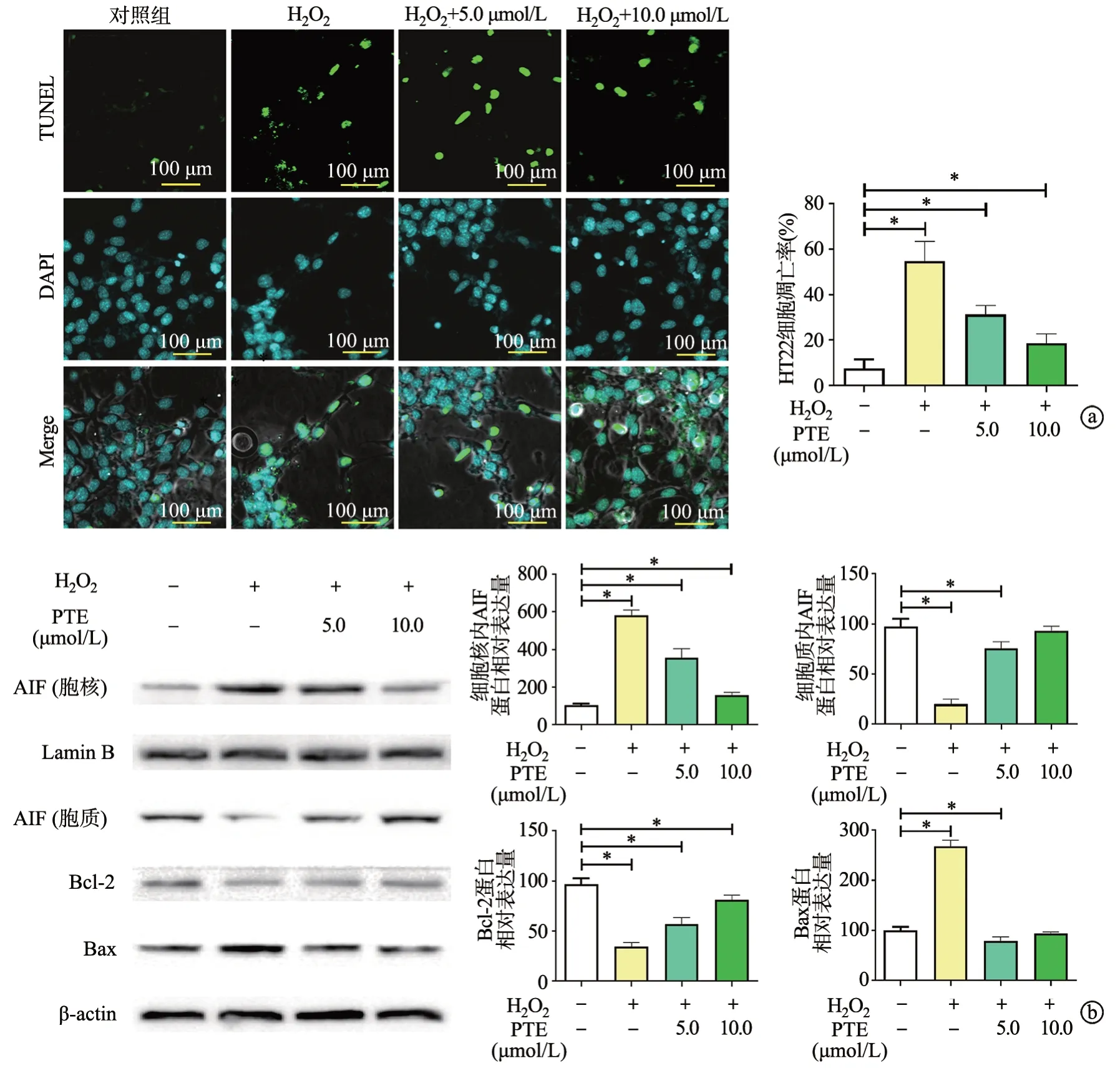
图2 PTE对H2O2诱导的HT22细胞凋亡的影响
2.3 PTE对H2O2诱导的HT22细胞ROS的影响
细胞内ROS水平检测显示,H2O2有效增加了带有绿色荧光的HT22细胞(DCF阳性)数量,各剂量(5.0 μmol/L和10.0 μmol/L)PTE有效减少了绿色荧光细胞数量,且呈剂量依赖性(P<0.05),见图3。
2.4 PTE对H2O2诱导的HT22细胞线粒体功能的影响
H2O2增加了JC-1单体的表达,降低了JC-1聚合体的表达(图4a),说明H2O2可诱导HT22细胞线粒体功能障碍。PTE逆转H2O2诱导HT22细胞 的MMP降低,提示PTE通过上调MMP水平进而维持H2O2损伤后的线粒体功能。Western blot结果显示,与对照组相比,HT22细胞经H2O2处理后,细胞质内Cyto C表达明显增加,PTE处理则减轻Cyto C在胞质内聚集的趋势(P<0.05),见图4b。

图4 PTE对H2O2诱导的HT22细胞线粒体功能的影响
2.5 PTE对H2O2诱导的HT22细胞内质网功能的影响
Western blot分析ER stress关键蛋白的结果显示,H2O2处理后,PERK和eIF2α蛋白磷酸化水平上调;同时,H2O2处理的细胞中Bip和Chop蛋白表达水平显著升高;相较H2O2处理组,PTE显著下调上述蛋白表达,见图5。说明PTE对HT22细胞中H2O2引起的ER stress具有抑制作用。
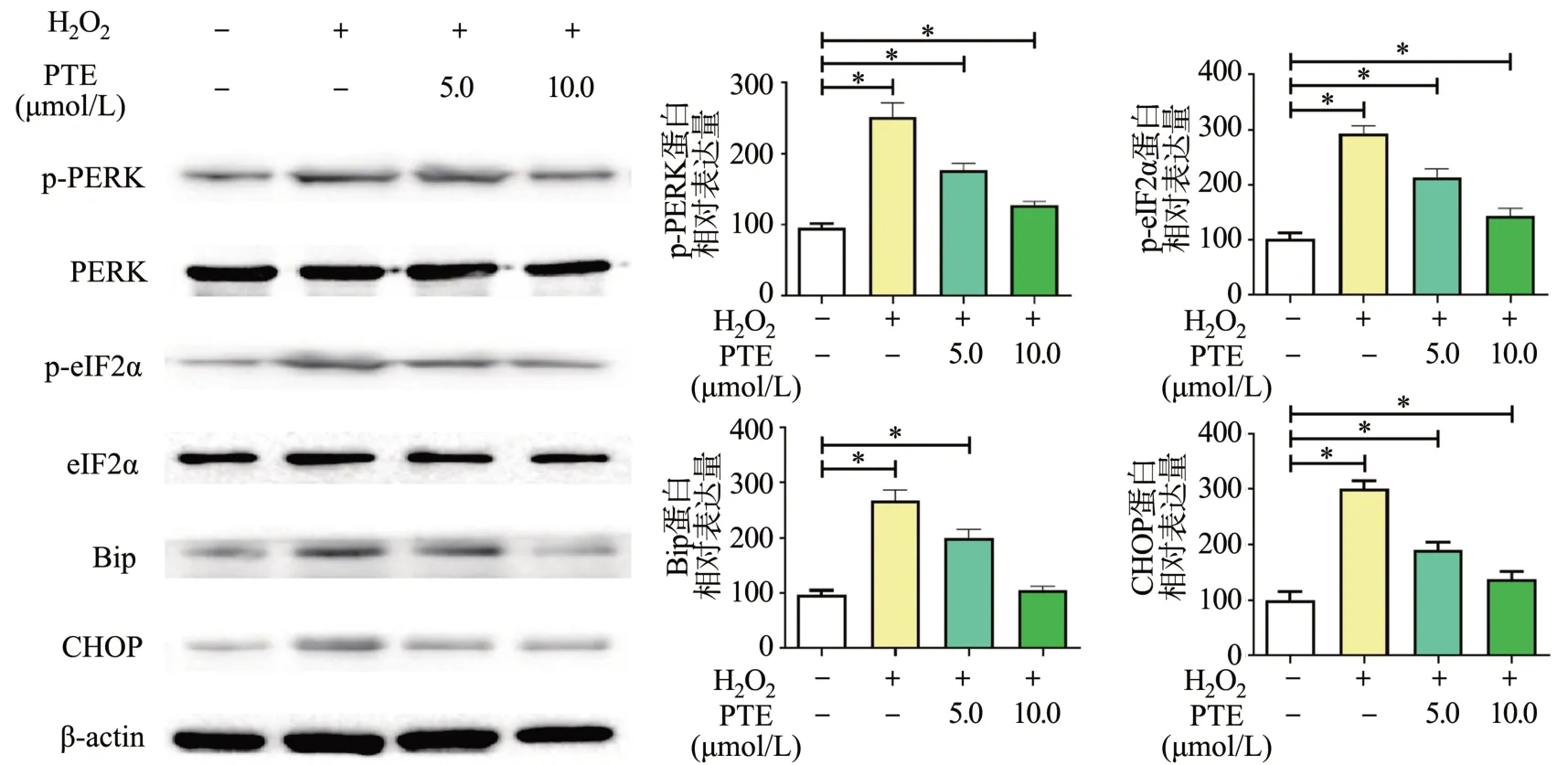
图5 PTE对H2O2诱导的HT22细胞ER stress相关蛋白的影响
3 讨论
中枢神经系统是氧自由基攻击的主要器官之一,氧自由基主要影响蛋白质结构和酶活性[11],该过程是多种神经退行性疾病(如阿尔茨海默病和帕金森)的病理生理基础[2]。H2O2是一种温和的氧化剂,常用来模拟神经元细胞氧化应激损伤。本研究揭示了H2O2诱导神经细胞毒性作用伴随的关键蛋白表达,以及中药单体对神经元细胞氧化应激损伤的保护作用,旨在为寻找新型抗神经退行性疾病药物提供理论基础。
由于氧自由基的有害作用,中和或清除自由基的抗氧化防御机制对于预防和应对神经元损伤至关重要。PTE是从紫檀、葡萄或蓝莓中提取的一种芪类多酚类化合物,具有多种生物学特性,如抗癌、抗炎、抗糖尿病及延缓衰老等[12]。目前,PTE的抗氧化作用也得到证实。Xu等[13]发现PTE通过调节AMPK/sirt1和Nrf2/HO-1信号通路缓解氧化应激和过敏性气道炎症反应,认为PTE可作为治疗哮喘的新型药物。近年来,PTE对神经系统的保护作用受到广泛的关注[14]。Zhu等[15]的研究证实,PTE能有效减轻Aβ25-35诱导的小鼠行为缺陷,其机制可能与抑制线粒体依赖性细胞凋亡并改善突触可塑性有关。此外,Liu等[16]发现,PTE可减轻缺血再灌注诱导的脑损伤,表现为抑制星形胶质细胞介导的炎症和神经元氧化应激反应;这种效应可能通过阻断NF-κB的磷酸化和核内移位而实现。综上,PTE调控多种信号通路发挥抗神经系统病变作用,有望成为治疗AD和脑卒中的备选药物;然而,考虑到PTE广泛生物学功效和神经元氧化应激损伤复杂的分子机制,上述保护作用尚需进一步证实。
凋亡是神经系统退行性病变发生及进展的关键过程,关乎神经元损伤的程度。多项证据表明,Bcl-2蛋白家族的调节对维持线粒体完整性和功能至关重要,其具体成员包括抗凋亡蛋白(Bcl-2和Bcl-xL)和促凋亡蛋白(Bax、Bad和Bim等)[17]。其中,Bax介导神经元凋亡模型的线粒体损伤,而Bcl-2通过异二聚体的形式阻断Bax的活性[18]。AIF是另一种促凋亡蛋白,主要通过移位到细胞核并刺激染色质凝结发挥作用[19]。本研究结果显示,PTE(5.0 μmol/L和10.0 μmol/L)可显著增加H2O2处理后的HT22细胞活性,并减少LDH释放,降低细胞凋亡率;蛋白质分析发现,PTE减轻Bax的表达及AIF的移位,同时上调Bcl-2的水平,说明PTE缓解H2O2介导HT22损伤的效应主要是通过抑制细胞凋亡而实现。
大脑是机体高氧代谢器官,氧分子作为产生ROS(O2·-、·OH、H2O2)的底物涉及神经元突触可塑性、细胞增殖和衰老等调控过程[2]。本研究中,PTE显著下调H2O2诱导的DCF含量升高,说明PTE可抑制ROS的异常堆积。Cyto C主要定位于线粒体内膜的外侧,其释放是线粒体呼吸链功能失衡的重要标志,也是线粒体介导凋亡的重要信号传递分子[20]。本研究中H2O2处理后,细胞MMP发生去极化且线粒体膜通透性增加,而PTE处理显著提升了MMP水平并减少了Cyto C向胞质内移动,提示PTE通过恢复线粒体功能和结构完整性发挥抑制细胞ROS异常产生的作用。
内质网对蛋白质折叠、分泌和翻译后修饰至关重要[21],受生理或病理刺激时,会触发未折叠和错误折叠蛋白的积累,即ER stress[22]。PERK/eIF2α/CHOP是ER stress经典的调控通路之一。其中,PERK作为跨内质网膜蛋白,通常与Bip结合,保持稳定状态;一旦激活则可诱导eIF2α磷酸化,进一步活化CHOP发挥效应;然而,长时间持续表达CHOP可通过不同途径触发细胞凋亡,如调控Bcl-2/Bax表达等[22]。在神经系统中,ER stress与线粒体功能相互影响,共同调控氧化应激损伤[23]。结合本次实验,H2O2显著激活PERK/eIF2α/CHOP信号通路,PTE处理可降低HT22细胞中PERK和eIF2α的磷酸化水平,抑制GRP78和CHOP的表达。以上结果提示,PTE可有效阻断H2O2诱导的HT22细胞ER stress过程。
综上,PTE具有保护神经元HT22细胞的作用,该作用与稳定线粒体功能、减少ROS堆积、抑制ER stress及阻断氧化应激诱导的凋亡有关。PTE有望成为一种治疗神经系统退行性疾病的新策略,但其具体作用机制尚未完全阐明,仍需深入研究。
